Коррозия металлических конструкций и методы их защиты
Обновлено: 04.10.2024
Один из наиболее существенных недостатков металлических конструкций — коррозия. Ежегодно потерн металла от коррозии составляют около четверти всего произведенного в мире железа.
Коррозия (от латинского corrodere — разъедать) стали является процессом химического или электрохимического разрушения ее. Разрушающей средой может быть кислород воздуха, разные газы и особенно водные растворы — электролиты, находящиеся на стали часто в виде тончайшей водяной пленки.
Таким образом, коррозией называют процесс электрохимического или химического разрушения металла при взаимодействии его с агрессивной средой (например следы ржавчины на поверхности стальных и чугунных изделий).
Коррозия вызывает серьезные экологические и экономические последствия, так как затраты, связанные с ремонтом или заменой приборов и коммуникаций, водопроводных труб, во много раз превышают стоимость металла, из которого они изготовлены, а ее продукты вызывают загрязнение окружающей среды, негативно отражаются на здоровье и жизни людей.
Различают виды коррозии: атмосферную, подземную, контактную, электрохимическую, биологическую (в результате жизнедеятельности микроорганизмов), химическую (при высоких температурах в газах), коррозию блуждающими токами, коррозию в жидкостях, газовую коррозию, радиационную коррозию, коррозионную кавитацию, фреттинг-коррозию, межкристаллитную, коррозия-щелевую.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохимическую коррозию металлов.
Электрохимическая коррозия происходит под действием электролита, причем ионы металла переходят в раствор. В растворе гидраты закиси и окиси железа образуют собственно ржавчину, оседающую на поверхности стали.
Процесс химической коррозии происходит под действием сухих газов или в жидкостях, не проводящих электрического тока. Нередко оба указанных процесса развиваются совместно.
По виду коррозионной среды и условиям протекания различают несколько видов коррозии:
- газовая коррозия — это химическая коррозия металлов в газовой среде при минимальном содержании влаги или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто (например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т. д.);
- контактная коррозия вызвана контактом металлов, имеющих разные стационарные потенциалы в данном электролите;
- коррозия внешним током возникает под воздействием тока от внешнего источника и коррозия блуждающим током под воздействием блуждающего тока;
- радиационная коррозия — это коррозия, обусловленная действием радиоактивного излучения;
- коррозия под напряжением — коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Самый опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки.- Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов;
- коррозионная кавитация — разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды;
- фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т. д.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает одинаковой скоростью по всей поверхности металла, и неравномерной, когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв — разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек, глубоко проникающих в металл.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т. д.
Ржавчина вследствие высокой пористости не образует защитной пленки; наоборот, адсорбируя влагу, она интенсифицирует процесс коррозии. При высоких температурах коррозия протекает быстрее.
Металлические конструкции в большей степени подвержены атмосферной коррозии, потери от которой составляют около 50% всех коррозионных потерь и которая поражает около 70% используемого металла.
Агрессивность атмосферы зависит от ее влажности и загрязненности. Агрессивность среды увеличивается при усилении загрязненности воздуха; например, сернистый газ, растворясь в воде, превращается в серную кислоту, окислы азота образуют азотную и азотистую кислоты и т. д.
Стали, неоднородные по химическому составу и по структуре, подвержены ускоренному процессу коррозии: например, то- масовская и бессемеровская стали более подвержены коррозии, чем мартеновские, а стали кипящие разрушаются быстрее, чем спокойные.
Стойкость сталей в отношении коррозии неодинакова. Например, малоуглеродистые и низколегированные стали необходимо защищать от коррозии. Имеется группа сталей, которые можно использовать без защиты от коррозии. Такие стали называются атмосферостойкими. К ним относятся слаболегированные стали, содержащие медь, никель, хром, фосфор и др. При взаимодействии с атмосферой на поверхности этих сталей образуется естественный защитный слой из продуктов коррозии, препятствующий дальнейшему корродированию.
Алюминиевые сплавы к коррозии в большинстве случаев более устойчивы, так как на открытом воздухе поверхность алюминия и его сплавов покрывается тонкой плотной пленкой окислов, хорошо защищающей металл. При тяжелых условиях эксплуатации алюминиевых сплавов в агрессивных средах требуется дополнительная защита с помощью различных покрытий. Детали из алюминиевых сплавов, соприкасающиеся с бетоном или сталью, должны быть изолированы с помощью специальных прокладок из пластмассы или других материалов или защитных покрытий во избежание образования контактной коррозии.
Потери от коррозии во много раз превышают потери от разрушения стальных конструкций по многим причинам: от недостаточной прочности, устойчивости, выносливости и т. п. Поэтому принимать меры по защите металлических конструкций от коррозии столь же необходимо, как и обеспечивать их прочность и устойчивость. Это особенно относится к стальным конструкциям гидромелиоративного назначения, часть которых постоянно находится в воде, часть — на воздухе, а часть — попеременно то в воде, то на воздухе, т. е. в условиях, наиболее трудных для защиты от коррозии. Меры по борьбе с коррозией нужно предусматривать в процессе проектирования, затем в процессе изготовления и во все время эксплуатации конструкций.
Меры борьбы с коррозией можно разбить на три основных группы: конструктивные, эксплуатационные и специальные защитные.
Конструктивные: правильный выбор марки стали с учетом . реальных условий эксплуатации и опасности коррозии; применение сталей успокоенных плавок; правильный выбор материалов для креплений и деталей, если их изготовляют из других металлов.
В случае повышенной опасности коррозии применяют сплошные конструкции или сквозные, составленные из малого числа крупных сплошных элементов, которые легче осмотреть, проще очистить и окрасить с использованием механизмов.
В конструкциях, подверженных атмосферным осадкам, следует отдавать предпочтение таким сечениям элементов и конструкциям узлов, которые устраняли бы возможность затекания и застоя воды и длительного накопления снега.
В конструкциях, периодически находящихся в воде (а также подверженных переплескиванию волн), следует предусмотреть быстрый сток воды и по возможности уход с этой водой большей части наносов. В горизонтально расположенных корытообразных элементах необходимо устраивать специальные отверстия для стока воды. Все выступающие вверх ребра в таких элементах затрудняют сток воды и очистку от грязи и наносов.
Эксплуатационные: создание и соблюдение такого режима, который уменьшал бы отложение пыли и производственных выделений на элементах конструкций; интенсивное проветривание пространства у конструкций для уменьшения концентрации вредных газов, а также для снижения темперагуры воздуха и конструкций.
Проветривание должно создавать в зоне расположения конструкций осушающий режим, препятствующий конденсации и адсорбции влаги на частях конструкции и способствующий быстрому удалению влаги.
Следует периодически осматривать конструкции для выявления мест повреждения защитных покрытий и мест развития коррозии; очищать и заделывать такие места; периодически полностью возобновлять защитные покрытия конструкций.
Специальные защитные мероприятия. Вода является наиболее распространенной и дешевой технологической жидкостью, применяемой в промышленности. Основными проблемами, связанными с использованием воды в оборудовании, являются ее высокая коррозионная активность и склонность к образованию отложений. При этом снижается эффективность технологических процессов и ускоряется износ оборудования и конструкций. Существенные экономические потери несут предприятия из-за коррозии проката и готовых изделий при их хранении и транспортировке. Вдвойне осложняется борьба с коррозией в отопительных системах промышленных зданий из-за отложения солей жесткости и продуктов коррозии на внутренних стенках труб систем отопления и охлаждения. Солевые отложения и коррозия со временем разрушают трубы, значительно сужая проходное сечение трубопроводов.
Мерой, дающей полную гарантию от коррозии, является введение в состав стали во время плавки легирующих добавок, делающих сталь нержавеющей.
Введение никеля, хрома, меди и других добавок в десятых долях процента от веса стали делает эту сталь значительно более устойчивой против коррозии, чем углеродистые стали обыкновенного качества, и экономически может быть оправдано. При этом необходимо учитывать, что сталь, обладающая достаточной сопротивляемостью коррозии в атмосферных условиях, может оказаться подверженной ей в воде, и наоборот.
Для защиты металлических конструкций от коррозии используют различные типы искусственных покрытий. Они бывают лакокрасочными (из различных материалов) и металлоизоляционными. Для нанесения металлоизоляционных покрытий применяют плакирование (покрытие при горячей прокатке слоем чистого алюминия толщиной около 2% толщины листа), анодирование (покрытие в серной или хромовой кислоте под воздействием постоянного тока), гальванизацию (покрытие слоем цинка или никеля с последующим нанесением слоев меди, кадмия, хрома и др.) и обрызгивание (используют и после монтажа).
Все больше распространяются пластмассовые покрытия из полиэтилена, полиизобутилена, фторопласта, нейлона, поливинилхлорида и др., обладающие высокой водо-, кислото- и щелоче- стойкостью. Многие пластмассы используют как футеровочный материал для химических аппаратов и гальванических ванн (винипласт, фаолит и др.). Эффективно защищают от действия кислот и др. реагентов покрытия на основе каучука (гуммирование). Подземные сооружения, например трубопроводы, защищают от коррозии битумами и асфальтами, а также полимерными лентами и эмалями; от влаги — с помощью дренажа, который отводит ее от конструкции.
Протекторная защита достигается добавлением в материал покрытия порошков более стойких к коррозии металлов, чем защищаемый. Для железа это цинк, магний, алюминий. Под действием агрессивной среды происходит растворение порошка-добавки, а защищаемый металл консервируется и не корродирует.
Широко применяются сегодня ингибиторы коррозии и наки- пеобразования для воды. Ингибиторы коррозии — это вещества, замедляющие коррозию металлов (от лат. «ингибео» — останавливаю, сдерживаю). Ингибиторы кислотной коррозии были известны еще в средневековье. Ингибиторами коррозии могут быть и композиции химических соединений. Содержание ингибиторов в коррозионной среде должно быть небольшим.
Ингибиторы коррозии подразделяются: по механизму своего действия — на катодные, анодные и смешанные; по химической природе — на неорганические, органические и летучие; по сфере своего влияния — в кислой, щелочной и нейтральной среде.
Действие ингибиторов коррозии обусловлено изменением состояния поверхности металла вследствие адсорбции ингибитора или образования с катионами металла труднорастворимых соединений. Защитные слои, создаваемые ингибиторами коррозии, всегда тоньше наносимых покрытий. Ингибиторы коррозии могут действовать двумя путями: уменьшать площадь активной поверхности или изменять энергию активации коррозионного процесса.
ЗАЩИТА ОТ КОРРОЗИИ МЕТАЛЛИЧЕСКИХ конструкций
Наиболее распространенными видами коррозионных повреждений в металлических конструкциях являются: равномерное разъедание металла; местные коррозионные поражения в виде каверн; щелевая и контактная коррозии; коррозия в местах концентрации напряжений. Оптимальными способами защиты металлических конструкций являются покрытия: металлизационные, металлизационные с последующей их окраской и полимерные лакокрасочные – эпоксидные, полиуретановые, поливинил-хлоридные, хлоркаучуковые и др.
Перед нанесением покрытий поверхность металла очищают механическим, термическим или химическим способами. К механическим способам относятся: очистка ручным или механизированным инструментом, обдувка абразивами – пескоструйная и дробеструйная. Термический способ заключается в обработке металлической поверхности пламенем ацетилено-кислородной или керосиновой горелки. Группу химических способов очистки составляют обработки поверхности: растворами кислот – для удаления окалины и ржавчины; растворами щелочей, органическими растворителями – для удаления старых лакокрасочных покрытий; преобразователями ржавчины – для обработки поверхностей с тонким слоем продуктов коррозии; органическими растворителями – для обезжиривания поверхности металла перед окраской.
Металлизацию осуществляют сразу же после подготовки поверхности под окраску. Допускаемый разрыв во времени между подготовкой поверхности и металлизацией зависит от состава, воздуха, его влажности и температуры и не должен превышать на открытом воздухе 3 часов в сухую погоду и 30 мин – в сырую.
Большая пористость металлизационных покрытий ограничивает область их применения. Для устранения этого недостатка применяют комбинированные металлизационно-лакокрасочные покрытия, представляющие собой сочетание двух раздельно наносимых слоев: металлизационного, наносимого газоплазменным напылением и лакокрасочного, наносимого по металлизационному слою кистью, распылением или другим способом. Пористость и шероховатость металлизационного слоя делают его эффективной грунтовкой для лакокрасочного материала. Первый слой лакокрасочного покрытия, являющийся пропиточным, должен обладать высокой смачивающей способностью, хорошей адгезией к напыляемому слою и быть достаточно жидким, чтобы заполнить поры металлизационного покрытия. Лакокрасочные материалы, наносимые в качестве последующих слоев, должны иметь обычную вязкость.
Покрытие обычно состоит из грунтовки и покрывных слоев. Грунтовкой называют первый слой лакокрасочного покрытия, наносимый на очищенную поверхность металла с целью создания надежного противокоррозионного слоя, обеспечивающего прочность сцепления с окрашиваемой поверхностью и с последующими слоями лакокрасочного покрытия.
Покрывные слои лакокрасочного покрытия для обеспечения надежной защиты от коррозии мостов должны обладать хорошей адгезией, высокой механической прочностью и атмосферостойкостью, обеспечивать стойкость и непроницаемость всей системы покрытия для окружающей среды в эксплуатационных условиях. Лакокрасочные материалы следует накладывать на поверхность несколькими тонкими слоями. Покрытие только одним слоем не может служить надежной защитой от коррозии, поскольку имеет большое количество пор. Последующие слои покрытия перекрывают эти поры и пленка становится более сплошной. Уменьшение количества слоев за счет увеличения их толщины недопустимо, так как это снижает качество покрытия, вызывает его растрескивание и образование подтеков.
Для лакокрасочных покрытий по металлу рекомендуются:
эпоксидная эмаль – биметаллическая смесь порошков цинка и алюминиевой пудры в растворе эпоксидной смолы. Наносится по грунтовке распылением в два слоя, жизнеспособность эмали не менее 7 часов. Покрытие повышенной атмосферостойкости, рекомендуется для защиты от коррозии металлических конструкций в условиях промышленной и морской атмосферы;
перхлорвиниловая эмаль – раствор поливинилхлоридной смолы в смеси летучих органических растворителей с добавлением пластификатора и алюминиевой пудры. Покрытие повышенной атмосферостойкости, предназначается для окраски металлоконструкций в условиях повышенной влажности, морской атмосферы и холодного климата;
полиуретановая эмаль – суспензия пигментов в растворе полиэфира с добавлением отвердителя. Жизнеспособность готовой к употреблению эмали не менее 8 часов. Покрытие атмосферостойко с высокой адгезией, твердостью, морозостойкостью и стойкостью к истиранию. Предназначается для защиты от атмосферных воздействий в условиях повышенной влажности, морской атмосферы и холодного климата.
Коррозия металлов и способы защиты от нее
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме +n + n? → Me 0 ; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме 0 - n? → Me + n ; ΔG<0). В результате такого самопроизвольно протекающего коррозионного процесса металлы переходят в оксиды, гидроксиды, карбонаты, сульфиды и другие соединения и теряются безвозвратно.
Итак, коррозию можно определить как самопроизвольно протекающий окислительно-восстановительный процесс (ΔG<0) разрушения металла под воздействием окружающей среды, происходящий с выделением энергии (ΔН<0) и рассеиванием вещества (ΔS>0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную (наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
- электрохимическая (концентрационная, контактная, электрокоррозия);
- особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
- коррозию под влиянием механических напряжений;
- коррозию при трении;
- кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a2O3, ZnO, NiO и т.д.).
При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина). Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
Анодный процесс: Fe 0 - 2? → Fe 2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4? → 4OH - 1 деполяризация
Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3, образующийся Fe(OH)3 при нагревании может терять воду.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.
Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1-0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро - и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е 0 Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е 0 Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn | H2SO4 | Cu (K)
Анодный процесс: Zn 0 - 2? → Zn 2+
Катодный процесс: 2Н + + 2? → Н2 деполяризатор
Суммарное ионное уравнение: Zn + 2H + → Zn 2+ + H2
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al | HCl | Zn (K)
В 0,1 М растворе HCl в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1. Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2. Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3. Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4. Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe 2+ ® Fe3(PO4)2¯ + 4H ( фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
A: Zn 0 - 2? → Zn 2+ 2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
(А) Fe | 2H + | Sn (K)
A: Fe 0 - 2? → Fe 2+ 1
Fe + 2H + → Fe 2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защита заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn 0 – 2 ® Zn 2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4® 4OH - ; E 0 = 0,40 B.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ = 1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5 — NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO3 2- , NO2 - , Cr2O7 2- , а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl - , Br - , F - , SO4 2- , NO3 - .
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Коррозия металлических конструкций. Коррозия каменных конструкций.
По своей природе различают коррозию химическую и электрохимическую. Химическая коррозия возник: в результате непосредственного воздействия на металл aгpeccивных жидкостей или газов. Электрохимическая коррозия вызывается воздействием влаги и атмосферы на поверхностный слой металла. Коррозия приводит к уменьшению поперечного сечения несущей способности элементов конструкций. Скорость коррозии зависит от степени агрессивности окружающей среды и от фор поперечных сечений конструкций. Скопление пыли на поверхности и периодическое ее смачивание увеличивают скорость коррозии
Коррозионное разрушение металла является одной из существенных причин потери работоспособности и снижения долговечности металлических конструкций. Коррозией металлов называется окислительно-восстановительный процесс разрушения металлов и сплавов в результате химического или электрохимического взаимодействия с окружающей средой, происходящий на поверхности раздела фаз. Более всего от коррозии страдают железо и его сплавы, а также алюминий. Металлические конструкции подвержены в основном электрохимической коррозии, возникающей при соприкосновении металлов с электролитами.
При оценке технического состояния конструкций, пораженных коррозией, необходимо прежде всего определить вид коррозии. Это дает возможность сузить интервал поиска основных причин коррозионного повреждения конструкций, более точно определить влияние коррозионного повреждения на несущую способность элементов конструкций, а также разработать наиболее обоснованные мероприятия по восстановлению несущей способности и защите конструкций от коррозии.
По характеру поражения металла различают сплошную (общую) и локальную коррозию.
Сплошная коррозия в свою очередь может быть равномерной и неравномерной в зависимости от глубины поражения на различных участках поверхности. Если при коррозии нарушается одна структурная составляющая сплава (графитизация чугуна) или один из компонентов сплава, то коррозию называют структурно-избирательной (рис. 2.1).
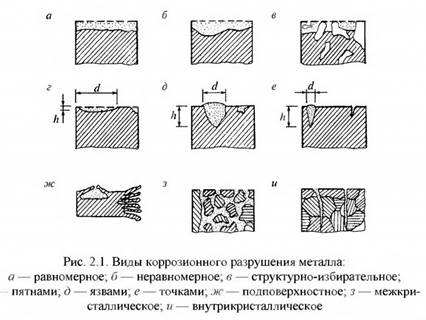
Сплошная коррозия характерна для стали, алюминия, цинковых и алюминиевых защитных покрытий в любых средах, в которых коррозионная стойкость данного материала или металла покрытия недостаточна. Этот вид коррозии характеризуется относительно равномерным по всей поверхности постепенным проникновением вглубь металла, то есть уменьшением толщины сечения элемента или толщины защитного слоя металлического покрытия. При коррозии в нейтральных, слабощелочных и слабокислых средах элементы конструкции покрываются видимым слоем продуктов коррозии, после механического удаления которого до чистого металла поверхность конструкций оказывается шероховатой, но без видимых язв, точек коррозии и трещин. При коррозии в кислых (а для цинка и алюминия и в щелочных) средах видимый слой продуктов коррозии может не образовываться Общей коррозии наиболее подвержены, как правило, поверхности в узких щелях, зазорах и на участках скопления пыли и влаги.
Язвенная коррозия характерна в основном для углеродистой и низколегированной сталей при эксплуатации конструкций в жидких средах и грунтах, в меньшей степени — для алюминия, алюминиевых и цинковых покрытий. Язвенная коррозия низколегированной стали в атмосферных условиях чаще всего связана с неблагоприятной структурой металла, с повышенным количеством неметаллических включений, в первую очередь сульфидов с высоким содержанием марганца. Язвенная коррозия обычно сопровождается образованием толстых слоев продуктов коррозии, покрывающих всю поверхность металла или значительные ее участки вокруг отдельных крупных язв. Коррозионные язвы являются острыми концентраторами напряжений и могут оказаться инициаторами зарождения усталостных трещин и хрупких разрушений.
Наиболее опасны межкристаллитная и транскристаллитная коррозии (рис. 2.1,з, и). Первая проходит по наименее стойким границам зерен, не затрагивая зерен металла. Вторая — рассекает зерна металла, проходя через них трещиной. Межкристаллитной коррозии подвержены многие сплавы: строительные стали, нержавеющие высокохромистые и хромоникелиевые стали, дюралюминиевые сплавы и др. Межкристаллитная коррозия характеризуется относительно равномерным распределением множественных трещин на больших участках поверхности конструкций. Под оптическим микроскопом на поперечных шлифах, изготавливаемых из отобранных проб, видно, что трещины распространяются только по границам зерен металла.
Коррозионное растрескивание — вид квазихрупкого разрушения стали и высокопрочных алюминиевых сплавов при одновременном воздействии статических напряжений растяжения и агрессивных сред. Разрушение характеризуется образованием единичных и множественных трещин, связанных с концентрацией основных и внутренних напряжений. Трещины могут распространяться между кристаллами или по телу зерен. Коррозионное растрескивание характерно для сталей с повышенным содержанием водорода. Коррозионное растрескивание выявляется фрактографическим анализом проб.
Аналогичные признаки имеет коррозионная усталость — вид квазихрупкого разрушения материалов при одновременном воздействии циклических напряжений и жидких агрессивных сред. Об интенсивности коррозионной усталости судят по числу циклов до зарождения трещин или по скорости роста наиболее длинных трещин.
Основным фактором, влияющим на развитие коррозии, служит атмосферная среда. Показателями, определяющими степень агрессивности среды, являются: относительная влажность, температура, возможность образования конденсата, состав и концентрация газов и пыли, туманы агрессивных жидкостей. В зависимости от условий эксплуатации конструкции могут находиться под воздействием общезаводской атмосферы и внутрицеховой. Особенно неблагоприятным фактором является относительная влажность. Наибольшая скорость коррозии реализуется при периодическом выпадении конденсата, однако она резко возрастает уже при достижении так называемой критической влажности — для стали 70. 75 %. При наличии продуктов коррозии на поверхности конструкций критическая влажность снижается до 50. 60 %.
Степень коррозионного износа определяют измерением толщины тщательно очищенного от продуктов коррозии прокатного профиля. Измерения осуществляют с помощью скобы с индикатором часового типа с ценой деления 0,01 мм. Замеры должны быть произведены в 10—20 местах по длине элемента для получения достоверного результата надо сделать около 200 замеров однотипных элементов.
Своевременная защита от коррозии металлических конструкций в процессе эксплуатации — одно из главных условий долговечности и надежности сооружений. Наиболее распространенным и достаточно эффективным средством для защиты металлоконструкций от коррозии являются лакокрасочные (органические) покрытия — высокомолекулярные пленки естественного и искусственного происхождения. Физико-химическую основу лакокрасочных материалов составляют многокомпонентные системы, содержащие пленкообразующие вещества, растворители, пигменты и добавки различного назначения. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать хорошей адгезией и механической прочностью.
В зависимости от рода пленкообразующего вещества лакокрасочные материалы подразделяются на масляные, битумные, глифталевые, перхлорвиниловые, эпоксидные и др. В большинстве случаев материал наносится на предварительные слои грунтовки и шпатлевки, обычно в несколько покрывных слоев. Выбор типа лакокрасочного материала зависит от степени агрессивности эксплуатационной среды и определяется нормативными документами
При восстановлении защитных покрытий большое значение имеет подготовка поверхности элементов под окраску. Перед нанесением покрытия поверхность очищается механическим или химическим способом от ржавчины, старой краски, жировых и других загрязнений до степени 1 (ГОСТ 9.402-80*). К механическим способам относятся пескоструйная и дробеструйная очистка, обработка поверхности механизированным инструментом. При пескоструйной очистке применяется специальный порошок (металлический песок), расход которого примерно в 10 раз меньше по сравнению с обычным кварцевым песком. Запыленность воздуха ниже допустимой по требованиям санитарных норм. Такие же преимущества имеет и дробеструйная очистка. Применяется гидропескоструйный способ очистки, осуществляемый эжектором, подающим струю воды с песком. Для предотвращения коррозии металлической поверхности в воду добавляют -1,6 % замедлителя коррозии (ингибитора). Возможна очистка пневматическими или электрическими инструментами.
· Коррозия каменных конструкций.
Коррозия — это разрушение материалов строительных конструкций под воздействием окружающей среды, сопровождающееся химическими, физико-химическими и электрохимическими процессами.
По механизму протекания различают физическую, химическую и биологическую коррозию. Вид коррозийных процессов зависит от местоположения конструктивного элемента и характера среды. Так, подземные конструкции могут подвергаться всем видам коррозии: надземные – преимущественно физической, реже – химической коррозии.
Химическая коррозия сопровождается необратимыми изменениями материала конструкций в результате взаимодействия с агрессивной средой.
Электрохимическая коррозия возникает в металлических конструкциях в условиях неблагоприятных контактов с атмосферной средой, водой, влажными грунтами, агрессивными газами.
Наибольшее влияние на износ конструкций оказывает водная среда. Поскольку большинство конструкций зданий (фундаменты, стены, перегородки, перекрытия и элементы крыш) выполнены из искусственных материалов с пористо-капиллярной структурой, при контакте с водой они интенсивно увлажняются.
В зависимости от вида связи с материалом различают химически связанную, адсорбционно-связанную, капиллярную и свободную влагу. Последняя заполняет крупные пустоты и поры материала и удерживается в них гидростатическими силами. Такая влага легко удаляется из материала конструкции при высушивании.
Влияние влаги на процесс разрушения конструкций неодинаковое. В одних случаях она как поверхностно-активное вещество ускоряет разрушение, в других, являясь хорошим растворителем, действует в качестве химически активной агрессивной среды.
На начало разрушения каменных конструкций указывают появляющиеся на поверхности конструктивного элемента белые высолы. Они свидетельствуют о том, что в материале происходит растворение солей материала и их вынос наружу в направлении миграции растворов более низких температур. Во многих случаях при отсутствии постоянного увлажнения карбонатная корка СаСО3 выполняет функцию защиты каменных конструкций. Опасны для каменных и бетонных конструкций воды, содержащие химически активные вещества.
Коррозия конструкций из силикатных материалов.
Разрушение пористых силикатных конструкций при наличии сообщающихся пор происходит не только на поверхности, но и в толще материала. В замкнутых, не сообщающихся друг с другом порах (например, в красном кирпиче мокрого прессования) разрушительное влияние агрессивных сред проявляется в более ограниченном масштабе, чем в открытых порах. Силикатные конструкции устойчивы к щелочным агрессивным средам. Благодаря наличию в воздухе и грунтовой воде веществ (оксидов, газов), образующих растворы кислот, во влажной среде силикатные изделия быстро разрушаются.
Разрушение кирпичных стен может происходить при периодическом увлажнении и высыхании, поэтому конструкции из кирпича наиболее интенсивно подвергаются химической и физической коррозии в систематически увлажняемых местах (фундаменты, стены подвалов, стены и кирпичные перегородки влажных помещений, карнизы, сандрики и другие элементы зданий, не защищенные от попадания влаги из атмосферных осадков).
Защита бетонных и железобетонных конструкций от коррозии должна предусматриваться, начиная со стадии проектирования сооружений и конструкций. Создавая проект сооружения, необходимо разработать мероприятия, которые обеспечат требуемую долговечность строительным конструкциям, т. е. необходимо осуществить проектирование защиты конструкций от коррозии. Проектирование защиты бетонных и железобетонных конструкций от коррозии следует начинать .с определения вида агрессивной среды, степени ее агрессивности и длительности воздействия, а затем на основании анализа установить вид защиты, произвести выбор материалов для ее осуществления, выработать конструктивные решения по защите и подобрать требуемые способы ее осуществления.
Различают два вида защиты бетонных и железобетонных конструкций от коррозии: первичная и вторичная.
Первичная защита от коррозии заключается в придании способности бетону и железобетону сопротивляться воздействию агрессивных сред посредством обеспечения оптимального их состава и структуры при изготовлении конструкций.
Вторичная защита от коррозии заключается в создании условий, ограничивающих или исключающих воздействие агрессивных сред на бетонные или железобетонные конструкции после их изготовления.
Первичную защиту следует проектировать путем выбора стойких составляющих бетона и железобетона, необходимых технологических параметров приготовления, уплотнения и твердения бетона, геометрической конфигурации конструкции, препятствующей образованию или уменьшению скопления агрессивных веществ на их поверхности, толщины защитного слоя бетона, обеспечения трещиностойкости конструкции и допустимого раскрытия трещин при эксплуатационных нагрузках. Первичная защита включает также нанесение защитного металлического, пленочного или лакокрасочного покрытия на поверхность арматуры. Металлические покрытия для защиты стальной арматуры, стальных закладных деталей и соединительных элементов железобетонных конструкций должны образовывать слой толщиной от 0,05 до 0,2 мм. В качестве материалов для покрытий следует применять алюминий или цинк. Защитные свойства металлических покрытий могут быть усилены посредством последующего нанесения на них лакокрасочных покрытий или полимерных материалов.
Вторичную защиту от коррозии следует проектировать в зависимости от требуемой химической стойкости, проницаемости, адгезии с защищаемой поверхностью, трещиностоикости и прочности путем выбора вида покрытий для защиты, материалов для защитной обработки или пропитки бетона, способов ее выполнения. Вторичную защиту от коррозии осуществляют путем пропитки бетона или нанесения лакокрасочного, пленочного, облицовочного или футеровочного защитного покрытия на поверхность бетонной или железобетонной конструкции с целью уплотнения поверхностного слоя бетона толщиной от 3 до 30 мм.
Читайте также:
