Коррозия металлов 9 класс габриелян
Обновлено: 21.09.2024
Конспект урока разработан в соответствии с программой по химии для общеобразовательной школы, автор программы О. С. Габриелян.
| Вложение | Размер |
|---|---|
| konspekt_korroziya.docx | 16.9 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
урока по химии для учащихся 9 класса
на тему «Коррозия металлов»
ТЕМА УРОКА: КОРРОЗИЯ МЕТАЛЛОВ
ЦЕЛЬ УРОКА: знать определение понятия «коррозия», разъяснять его на примерах химической и электрохимической коррозии металлов. Знать условия, способствующие и препятствующие коррозии металлов и способы защиты от коррозии.
Продолжаем изучение темы «Общие свойства металлов»
1.Опрос по теме «Электролиз» и «Ряд напряжений металлов»
Учащиеся работают по группам во главе с консультантом в форме поисковой беседы:
- (устно) Какие химические свойства металлов вам известны?
- (устно) Чем (какой энергией) определяется активность металлов вне раствора?
- (устно) Чем определяется активность металлов в растворе?
- (в тетрадях по вариантам) Составьте уравнения возможных реакций:
I вариант: Cu + PbCl 2 →
II вариант: Mn + FeCl 2 →
- (по группам) Дайте определение электролиза
- (по группам) Какой электрод называется катодом? анодом?
- (в тетрадях по вариантам) Составьте уравнения электролиза следующих солей в растворе:
I вариант: CuBr 2
II вариант: Na 2 S
2. Цель нашего урока - изучить ещё одно общее свойство металлов – коррозию. Какой процесс называется коррозией? Виды коррозии. Вред или польза от коррозии? Как от неё избавиться?
Процесс разрушения металлов называется коррозией, от латинского corrodere – разрушать. Коррозия – самопроизвольное разрушение металлов под действием внешней среды.
Коррозия – окислительно-восстановительная реакция, в
которой окисляется металл: Me – ne → Me.
Коррозия причиняет народному хозяйству огромные убытки. И хотя потери металла от коррозии за последние годы сократились в результате выявления причин коррозии, эти потери ещё недопустимо велики.
Вред коррозии многообразен: помимо выхода из строя машин, станков, приборов, аппаратов ухудшаются технические свойства ещё не «отживших» изделий, увеличивается трение, уменьшается их твёрдость, пластичность. Условия, в которых работают металлические изделия в ракетной, авиационной, космической технике, на химических производствах, особенно благоприятствуют коррозионным процессам.
По механизму действия различают два вида коррозии: химическую и электрохимическую.
Демонстрация таблицы «Виды коррозии»
- Химическая коррозия вызывается сухими газами или жидкостями-неэлектролитами:
Zn + O2 → ZnO (электроны с атомов цинка переходят к частицам окислителя)
- Электрохимическая коррозия вызывается жидкостями-электролитами или влажным воздухом, который также является электролитом. Чтобы понять её механизм, проделаем лабораторный опыт. Поместим в пробирку кусочек цинка, прильём кислоту. Реакция почти не идёт. А теперь коснёмся кусочка цинка очищенной медной проволокой – идёт бурное выделение водорода. Уберём проволоку – перестаёт идти. Почему? Возникает гальваническая пара цинк/медь, в которой цинк, как более активный, окисляется. Чем чище металл, тем менее он подвергается коррозии.
Давайте посмотрим, какие условия влияют на коррозию.
Демонстрация заранее поставленного опыта по изучению влияния условий на коррозию металлов.
Учащиеся делают следующие выводы:
- Повышение концентрации катионов водорода ускоряет коррозию;
- Повышение концентрации гидрокс-анионов замедляет коррозию;
Таким образом, катионы водорода ускоряют коррозию, а гидрокс-анионы - замедляют.
Защита металлов от коррозии
Существуют несколько способов защиты металлов от коррозии:
- Изоляция металлов от окружающей среды. Изолируют металлы поверхностными защитными покрытиями:
а) металлами (никель, серебро, золото);
б) неметаллами (лаки, краски, смазки, эмали);
в) химическими пассиваторами
2. Вводят в металл специальные добавки, чтобы повысить коррозионную стойкость (сталь – 18 % хрома, 8 % никеля, остальное - железо)4
3. Используют ингибиторы;
4. В последнее время всё шире используется протекторная защита (от лат. протектор – покровитель). Так, алюминий активнее, чем железо, и окисляясь, предохраняет железо от ржавления. А медная проволока провоцирует ржавление железа, т. к. медь менее активна, чем железо, и в этой паре первым будет окисляться железо.
Выполняем упражнения из учебника
I вариант: 1) Что называется химической коррозией?
II вариант: 1) Что называется электрохимической коррозией?
5. Домашее задание : П. 10, упр. 1, 2, 3, 4 ( по учебнику О. С. Габриеляна «Химия – 9»)
Конспект урока и презентация на тему " Коррозия металлов" 9 класс
образовательная – учащиеся должны усвоить понятие коррозии как окислительно-восстановительного процесса, разобраться в сущности электрохимической коррозии и причинах, вызывающих ее ускорение; уяснить влияние на скорость коррозии образования микрогальванической пары в среде электролита;
развивающая – развить умение на основании знаний об условиях коррозии предполагать способы защиты металлов от коррозии в быту, т.е. применять свои знания на практике;
воспитательная – вырабатывать у школьников познавательную активность, интерес к предмету, умение работать в коллективе, в группах.
Методы – словесный (объяснение, беседа), наглядный, практический.
Организационный момент. ( видео ролик « С добрым утром»
Актуализация знаний ( слайд №3)
Тестирование (5 мин). 2 варианта по 10 вопросов
( слайд№4)Взаимопроверка по ключам (выставление оценок в лист учета)
5-6 вопросов – оценка «3»
7-8 вопросов – оценка «4»
9-10 вопросов – оценка «5»
Тесты по теме: «Железо».
вариант І
а) ванадия. в) марганца.
б) хрома. г) железа.
2. Железо в соединениях имеет:
а) постоянную валентность. в) переменную валентность.
б) валентность, равную нулю. г) отрицательную валентность
3. Окислительными и восстановительными свойствами обладает частица:
4. Молекулярная формула гематита:
5. Железо горит в кислороде, при этом образуется железная окалина. Ее молекулярная формула:
6. Продуктом коррозии железа является:
а) серая ржавчина в) белая ржавчина
б) бурая ржавчина г) зеленая ржавчина.
7. Качественной реакцией на является реакция с гексацианоферратом( І ) калия ( желтой кровяной солью ). Какое окрашивание дает при этом продукт реакции:
8. Чугун- сплав, в состав которого входят:
а) железо и сера в)железо и кислород б) железо и углерод г) железо и медь
9. Вещество, имеющее формулу Fe ( , называется:
а) гидроксид железа( ІІІ ) в) гидроксид железа б)оксид железа ( ІІІ ) г)
10. В виде какого минерала встречается железо в природе:
а) красный железняк в) желтый железняк б)серый железняк г) черный железняк
В каком виде железо менее всего подвергается коррозии:
а) чугун в) сталь б)чистое г) железо с содержанием меди
2. Какой цвет имеет осадок гидроксид железа( ІІІ ) :
3. Качественной реакцией на является реакция с гексацианоферратом( І ) калия ( желтой кровяной солью ). Какое окрашивание дает при этом продукт реакции:
4. Железо в соединениях имеет:
б) валентность, равную нулю. г) отрицательную валентность.
5. Для получения какого металла применяют доменный процесс:
6. Какая из этих формул относится к бурому железняку:
7. Изделие из железа с целью защиты его от коррозии покрывают: а) б) цинком как металлом, на поверхности которого имеется защитная пленка в) ртутью как самым активным металлом г)
8. Молекулярная формула гематита:
9. Какая формула соответствует дигидрофосфату железа
10. В состав стали «нержавейка» входят:
а) в) железо,титан и никель
б) железо, цинк и алюминий г)
включение в новую тему.
На предыдущих уроках мы с вами познакомились с темой : Железо и его соединения. Сегодня мы с вами продолжим изучать данную тему, и рассмотрим один из самых опасном и коварном процессе, который носит название КОРРОЗИЯ.
( слайд №5) Хвастается новенький металл:
«Как силен я, смел и как удал!
Неподвластен никакой угрозе я,
Кроме рыжей крысы с именем
История металла. Железо – элемент, всем хорошо известный. Железо используют как в чистом виде, так и в составе различных сплавов.
(слайд№7) О значении железа очень ярко сказал академик А.Е.Ферсман: «Я хочу поразить читателя и нарисовать картину того, что было бы с человеком, если бы он вдруг узнал, что все железо на поверхности земли исчезло и что его ниоткуда больше достать нельзя. Правда, он узнал бы это довольно решительным образом, ибо исчезли бы его кровать, распалась бы вся мебель, уничтожились все гвозди, обвалились потолки и уничтожилась крыша. На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей, ни экипажей, ни решеток не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без живительного металла. Разрушение ураганом прошло бы по всей Земле, и гибель человека сделалась бы неминуемой».
Иногда создается впечатление, что природа, творя железо, снабдила его таким комплексом свойств, которые необходимы и вполне достаточны, чтобы сполна удовлетворить все разнообразные нужды человека. Ошиблась природа в одном: не обеспечила железо устойчивостью к внешней среде – оно легко корродирует и этим создает человеку очень много проблем научных, технических и, конечно, материальных. Человеку приходится применять сложные и чрезвычайно энергоемкие металлургические процессы, чтобы извлечь металлы из химических соединений, в виде которых они находятся в рудах. Значительную долю результатов этого труда у людей отнимает злейший враг металлов – коррозия. В процессе коррозии металлы снова превращаются в сложные вещества, подобные тем, которые содержались в рудах. О коррозии упоминается даже в Ветхом Завете: «не сотвори себе кумира на земле, ибо ржавчина и моль его разрушат»
I . Изучение новой темы.
Слово «коррозия» происходит от латинского «коррозио» - разъедание.
Коррозия – самопроизвольное разрушение металлов вследствие химического или электрохимического взаимодействия их с окружающей средой. «Поедают» металл все вещества, которые могут с ним реагировать: кислород и вода, кислоты и щелочи, растворы солей (морская вода).
Аппетит у «металлоедов» чудовищный – ежегодно они уносят до 30% производимого металла; 2/3 этого количества в виде металлолома возвращаются в промышленность, а 1/3 теряется безвозвратно. Но убытки этим не ограничиваются. ? Какие еще расходы возникают в результате коррозии?
Стоимость деталей и конструкций, вышедших из строя вследствие коррозии, выше стоимости самого металла. По причине коррозии случаются аварии. Коррозия увеличивает расходы на ремонт машин, на бензин. Значительные средства требует профилактика коррозии. Таким образом, коррозия порождает своеобразную цепную реакцию расходов, которые растут как снежный ком, причем косвенные расходы во много раз превышают прямые.
Коррозия это окислительно-восстановительный процесс, при котором атомы металлов переходят в ионы (идет процесс окисления)
Слайд №12 самостоятельная работа ( стр 172-173). Заполнить таблицу
Виды коррозии
В чем сущность каждого вида?
Различают два вида коррозии: химическую и электрохимическую.
Химическая коррозия – это разрушение металла в результате взаимодействия их с сухими газами или жидкостями, не проводящими электрический ток.
Этот вид не приносит особого вреда.
Электрохимическая коррозия – это разрушение металлов при контакте двух металлов в воде или среде другого электролита.
В данном случае наряду с химическим процессом идет электрический – перенос электрона, т.е. возникает электрический ток.
Этот вид приносит большой вред.
Работа в группах
Сейчас каждая группа получит задания и, внимательно рассмотрев их даст ответы на поставленные вопросы.
1.Гвоздь в дистиллированной воде.
Гвоздь в растворе хлорида натрия.
Гвоздь в контакте с медью растворе соли.
Гвоздь в контакте с цинком в растворе соли.
Гвоздь в растворе соли и щелочи.
№ 1. Железный гвоздь + чистая вода.
Насколько сильно корродировал гвоздь в чистой воде?
Сделайте вывод о скорости коррозии в чистой воде.
№ 2. Железный гвоздь + раствор хлорида натрия NaCl .
Насколько сильно корродировал гвоздь в растворе хлориде натрия?
Что из себя представляет по внешнему виду ржавчина?
Сделайте вывод о скорости коррозии в растворе соли.
№ 3. Железный гвоздь + медная проволока + раствор NaCl .
Насколько сильно корродировал гвоздь в контакте с медной проволокой?
Почему из двух металлов в первую очередь корродирует железо?
Сделайте вывод о скорости коррозии железа при контакте его с медью.
№ 4. Железный гвоздь + цинковая пластинка + раствор NaCl
Какой из металлов (железо или цинк) подвергся коррозии?
Почему железо осталось не измененным?
Сделайте вывод о скорости коррозии железа при контакте его с цинком.
№ 5. Железный гвоздь + раствор NaCl + раствор NaOH .
Присутствие каких ионов, по вашему мнению, затормозило процесс коррозии?
Сделайте вывод о скорости коррозии железа в контакте с гидроксид-ионами.
( слайд № 14,15)
1. Железо слабо корродировало, в чистой воде коррозия идет медленнее, т.к. вода слабый электролит.
2. Железо корродирует сильнее, т. к. хлорид натрия более сильный электролит и это увеличивает скорость коррозии.
3. Скорость коррозии велика. Образовалось много ржавчины. Железо сильно корродирует в контакте с менее активным металлом – медью.
4. Наблюдаем коррозию не железа, а цинка, т.к. железо в контакте с более активным металлом даже в сильно коррозионной среде – растворе хлорида натрия – не корродирует, остается защищенным до тех пор, пока не прокорродирует весь цинк.
5. Коррозия практически отсутствует. Щелочь замедляет коррозию, ионы ОН - являются ингибиторами коррозии.
Теперь мы знаем сущность коррозии, а знать, значит победить. Таков девиз нашего урока.
А сейчас творческая работа.
Каждая группа должна придумать рекламу для выбранного способа защиты металлов от коррозии. Сейчас нужно рассказать об этом способе защиты и прорекламировать его.
Простейшее средство защиты – это лакокрасочное покрытие.
Изготовление сплавов, стойких к коррозии.
1. Простейшее средство защиты – лакокрасочное покрытие, оно защищает поверхность металла от непосредственного контакта с окружающей средой и другими металлами. Борта теплоходов и других кораблей обычно снаружи покрывают масляной краской. Краска или лак прочно пристают к поверхности , но такие покрытия недолговечны. Однако в домашних условиях предотвратить ржавление батарей центрального отопления, канализационных труб этот способ поможет . Отправляя машины с завода, их густо покрывают смазочным маслом. Оно тоже не пропускает ни воздух, ни воду. Но масло годится только на время, пока машина в пути. Однако есть еще один способ сделать сталь нержавеющей. Это использование металлических покрытий - это нанесение на поверхность металла слоя другого, более или менее активного, чем защищаемый металл. Металлические покрытия получают в результате хромирования, никелирования, меднения, золочения, лужения (покрытие оловом) и т.д.
2. Протекторная защита – это электрохимический способ защиты металлов. Он заключается в том, что защищаемый металл, например железо, соединяют с протектором – более активным металлом (цинк, алюминий, магний). Чтобы спасти стальные конструкции, «приносят в жертву» магниевые блоки, расположенные во влажном грунте на некотором расстоянии друг от друга. Примерно также защищают цинковыми пластинами стальные корпуса морских судов. При контакте двух металлов протектор, сделанный из более активного металла будет разрушаться, защищая конструкцию. Протекторную защиту используют для металлических конструкций, соприкасающихся с морской и речной водой. В быту - пример электрохимической защиты - это оцинкованное ведро. Цинковый слой может иметь дефекты, царапины, он может даже не покрывать полностью все ведро – защитное действие все равно будет обеспечено.
5. Очень важным способом защиты металлов от коррозии является создание антикоррозийных материалов – сплавов, замена металлов полимерными материалами. Если хром добавить в сталь, когда она варится, получается очень твердый сплав, из которого можно делать и танки, и броню для боевых кораблей, и стволы пушек. А если побольше хрома прибавить, тогда получится сталь для подводных лодок. Она не ржавеет и называется нержавеющей сталью. Если в сталь добавить никель, то такую сталь ржавчина никогда не съест. Нержавеющая сталь, содержащая хром или никель, вероятно, есть у многих дома. Из такой стали делают ложки, вилки, ножи. Они довольно легкие, по цвету немного темнее серебра..
Выводы по уроку
Слайд № 24,25 Дополнительный материал по теме.
О том, сколь коварна и прожорлива коррозия, знают все автомобилисты. Двигатель порой готов еще служить верой и правдой, а кузов машины уже насквозь разъеден ржавчиной. Вот почему проблемам борьбы с коррозией ведущие автомобильные фирмы придают огромное значение. В январе 1986 г в Брюсселе проходил международный автосалон, на котором демонстрировалось более 1300 автомобилей из трех десятков стран. Всеобщее внимание привлекли машины шведской фирмы «Вольво», которая сумела существенно повысить антикоррозионную стойкость своей продукции и дает покупателям гарантию на 8 лет. Чтобы ни у кого на этот счет не возникало сомнений, фирма придумала оригинальную рекламу: на одном из ее стендов был установлен гигантский аквариум с водой, в котором, пока функциониров ал салон, все время находился автомобильный остов, прошедший перед этим специальную антикоррозионную обработку. «Не знаем, как насчет 8 лет, но за дни работы салона, - шутила одна из бельгийских газет, - металлическая рыбка «Вольво» не проржавела».
IV . Задание на дом. Что нужно учитывать инженеру- конструктору при проектировании новых машин и аппаратов?
§ 13. Коррозия металлов
«Ржа ест железо» — гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, — это яркий пример коррозии.

У поэта В. Шефнера есть очень образные строчки:

Ежегодно из-за коррозии теряется около четверти всего произведённого в мире железа. Однако не только потеря металлов, но и порча изготовленных из них изделий обходится очень дорого. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов и коммуникаций во много раз превышают стоимость металла, из которого они изготовлены.
Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей. Понятно, почему на защиту металлов и сплавов от коррозии тратят большие средства.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металлы — происходит химическая коррозия.
Чаще всего коррозии подвергаются изделия из железа. Особенно сильно корродирует металл во влажном воздухе и при соприкосновении с водой (рис. 43). Упрощённо этот процесс можно выразить следующим уравнением химической реакции:

Химически чистое железо почти не корродирует, а техническое железо, которое содержит различные примеси, например в чугунах и сталях, ржавеет. Следовательно, одной из причин возникновения коррозии является наличие примесей в металле, т. е. его неоднородность.


Сущность процесса коррозии для этого случая покажем на следующем примере. Если два различных металла, находящихся в контакте между собой, опустить в водный раствор электролита (в реальных условиях это, например, грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, предохраняя менее активный металл от коррозии.
Например, при контакте железа с медью в водной среде железо, как более активный металл, постепенно корродирует, переходя в воду в виде ионов железа (рис. 44, а).
Электроны, высвободившиеся из атомов железа, перейдут к меди и на её поверхности соединятся с ионами водорода, выделившимися из компонентов водной среды (например, серной или других кислот; вам, очевидно, известно выражение «кислотные дожди»). Этот электрохимический процесс можно представить так:

И наоборот, при контакте железа с более активным цинком последний, разрушаясь, защищает железо от коррозии (рис. 44, б).
Для борьбы с коррозией существует много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхности предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки (рис. 45). Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башню в Париже.
Предохраняемый металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др.

Один из самых старых способов — это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.

2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. Лёгкие нержавеющие сплавы включают алюминий или титан. Всякий, кто был во Всероссийском выставочном центре, видел перед входом обелиск «Покорителям космоса», облицованный пластинками из титанового сплава (рис. 46). На его блестящей поверхности нет ни одного пятнышка ржавчины.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.

4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк (рис. 47). На суше металлические конструкции линии электропередачи (ЛЭП) и трубопроводов соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.

1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.

1. Медь на воздухе покрывается тонким слоем оксида, придающим ей тёмную окраску, но во влажном воздухе и в присутствии углекислого газа на её поверхности образуются соединения зелёного цвета ((СиOН)2СO3). Напишите уравнения реакций коррозии меди.
2. Щелочные и щёлочноземельные металлы хранят под слоем керосина для предотвращения контакта с воздухом, так как они интенсивно взаимодействуют с составными частями воздуха. Напишите уравнения возможных реакций, сопровождающих коррозию этих металлов.
3. Что такое ингибиторы коррозии? Что такое протекторы? Чем отличается механизм их действия при защите металлов от коррозии?
4. Лужёное железо, покрытое защитной оловянной плёнкой, поцарапали. Что будет происходить с изделием?
5. О каком материале строка В. В. Маяковского: «По крыше выложили жесть. » ?
6. В начале XX в. из нью-йоркского порта вышла в открытый океан красавица яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус яхты был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклёпками. Это было красиво — сверкающий серебристым блеском корабль, усеянный золотистыми головками заклёпок! Однако через несколько дней обшивка корпуса начала расходиться и яхта быстро пошла ко дну. Почему?
Коррозия металлов и сплавов (окончание)
Электрохимическая коррозия усиливается в присутствии сильных электролитов, при наличии в металле примесей, в том числе другого металла. Коррозия осуществляется и в слабых электролитах, но ее скорость в сильных выше. Так, корродирующее действие водопроводной воды как слабого электролита усиливается, если в ней растворены атмосферные газы — углекислый газ, сернистый газ. Наличие их особенно ощутимо в промышленных районах, вблизи железных и автомобильных дорог. Химическая коррозия существенно усиливается при высоких температурах (в металлургии, в ракетных двигателях и газовых турбинах при их работе).
Коррозия приносит огромный ущерб хозяйству страны. Только прямые потери железа от коррозии составляют около 10% его ежегодной выплавки. Поэтому большое внимание придается мерам борьбы с коррозией.
Способы защиты от коррозии
- металлические (покрытия цинком, оловом, свинцом, никелем, хромом и другими металлами);
- неметаллические (покрытия лаком, эмалью, красками и т. д.);
- химические (покрытия оксидными, фосфатными и другими защитными пленками в результате химической обработки металла).
В случае металлических покрытий в зависимости от роли каждого металла в гальванической паре различают покрытия анодные и катодные. К анодным покрытиям относят металлы более активные, электродный потенциал которых по алгебраической величине меньше, чем у защищаемого металла (например, анодным покрытием для железа служит цинк). К катодным покрытиям, наоборот, относят защитные металлы с более высокими, чем у защищаемых, значениями электродных потенциалов (например, для железа и стали катодными покрытиями являются олово, никель, медь и др.; в данном случае быстрее разрушается железо).
Металлические покрытия можно наносить разными способами (гальванические горячие покрытия, металлизация и др.).
2. Создание сплавов, стойких к коррозии. Достигается введением в состав стали хрома, марганца, никеля (нержавеющая сталь). Изготавливают антикоррозийные сплавы, содержащие до 1 2 % Сг, а также сплавы с добавками никеля, кобальта, меди и других металлов.
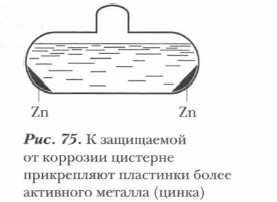
3. Протекторная защита. Сущность протекторной защиты заключается в том, что металлическую конструкцию (подземный трубопровод, корпус судна и т. д.), находящуюся в растворе электролита (подземные и почвенные воды, морская вода и т. д.), соединяют с протектором — более активным металлом, чем металл защищаемой конструкции; в процессе коррозии протектор служит анодом и разрушается, предохраняя от разрушения конструкцию. В качестве протектора для стальных конструкций обычно используют алюминий, цинк, магний и их сплавы (рис. 75).
Ниже приведен вариант схемы-конспекта, которая поможет вам обобщить и систематизировать изученное, послужит опорой для дальнейшего использования этих знаний (схема 4, а также табл. 35).
Урок по теме "Коррозия металлов", 9 класс
· воспитательные - совершенствовать коммуникативные умения в ходе коллективного обсуждения, продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.
10. Оборудование и реактивы:
- медиаоборудование, презентация «Коррозия металлов»;
- инструкция по проведению лабораторных опытов, таблица «Правила техники безопасности»;
- для проведения лабораторных опытов: штатив с пробирками, спиртовка, тигельные щипцы, спички;
р-р соляной кислоты, гранулы цинка, медная проволока;
заранее подготовленные (за 4-5дней) образцы -
пробирка №1 - раствор хлорида натрия +железный гвоздь
пробирка №2 - раствор хлорида натрия +железный гвоздь, обвитый медной проволокой
пробирка №3- раствор хлорида натрия +железный гвоздь +цинк
пробирка №4- вода + железный гвоздь
Организационный момент
Постановка проблемы
Актуализация знаний
Усвоение знаний и способов действия
Возвращение к проблеме
Ответ на проблему
Первичное закрепление
Самостоятельная работа
Домашнее задание
Подведение итогов
- На прошлом уроке мы рассмотрели химические свойства металлов, определили их реакционную способность, выявили круг их реагентов. Значение металлов в нашей жизни огромно, мы пользуемся изделиями из них ежедневно, и закономерно встает вопрос: насколько долго прослужит нам то или иное изделие из металла?
- Ознакомьтесь с листом информации. (Приложение 1) (слайд 1,2)
- Как вы думаете, что объединяет все эти происшествия?
- Действительно, у большинства применяемых в технике и быту металлов есть враг – «Рыжий дьявол». Днем и ночью ведет он наступление на позиции металлов по всему фронту. Коварство этого извечного врага в том, что, невидимый, он остается всегда целым и невредимым, а сплавы и металлы несут огромные потери. (слайд 3)
- Ну как, догадались, что это за враг?
- Какова тема нашего урока?
Коррозия металлов (слайд 4)
- Какова проблема нашего урока?
Почему происходит разрушение металлов? Как бороться с этим явлением? (слайд 5)
- Повторим химические свойства металлов ответив на вопросы теста (Приложение 2)
- Итак, цель нашего урока состоит в рассмотрении видов коррозии, ее причинах, механизмах действия, факторов, усиливающих коррозию и способах защиты от коррозии
-«Ржа ест железо» - гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, - это яркий пример коррозии.
Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют.
И так, что же такое коррозия металлов?
Слово коррозия происходит от латинского corrodere, что означает разъедать.
Коррозией металлов называют самопроизвольный процесс разрушения металлов и сплавов под воздействием окружающей среды. (слайд 7)
-Коррозию можно классифицировать (слайд 8)
-Рассмотрим более подробно механизм химической и электрохимической коррозии
Химическая коррозия – разрушение металла при взаимодействии его с сухими газами или жидкостями, не проводящими электрический ток (слайд 9)
Лабораторный опыт №1 «Прокаливание медной проволоки»
(Инструктаж по технике безопасности с использованием таблицы «Правила техники безопасности») (Приложение 3)
Вывод: химическая коррозия - это ОВР, в ходе которой металл окисляется, а присутствующий в среде окислитель восстанавливается, электроны переходят от металла к окислителю без возникновения в цепи электрического тока.
Электрохимическая коррозия – разрушение металла в среде электролита с возникновением электрического тока (слайд 12)
Лабораторный опыт №2 «Коррозия в условии контакта двух металлов»
Вывод: при контакте двух металлов в растворе электролита корродировать будет более активный металл.
- Следующим этапом нашего урока будет рассмотрение факторов, влияющих на коррозию металлов.
Лабораторный опыт №3 «Факторы, влияющие на коррозию металлов»
Вывод: скорость коррозии меняется в зависимости от контакта с другими химическими веществами.
- Мы ответили с вами на первый вопрос нашей проблемы: «Почему происходит разрушение металлов?». Теперь нам необходимо ответить на второй вопрос: «Как бороться с коррозией?
- Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (V в. до н.э.) уже имеется упоминание о применении олова для защиты железа от коррозии.
Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить.
- Ответить на вопрос нам поможет материал учебника.
Задание : используя информацию в учебнике (с.50-51) выяснить основные способы защиты от коррозии и записать в тетрадь.
- Коррозия металлов наносит большой экономический вред. Коррозия приводит к уменьшению надежности работы оборудования, агрегатов, разрушению трубопроводов, судов, мостов. Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции. Коррозия также приводит к загрязнению продукции, а значит, и к снижению ее качества . Коррозия вызывает серьезные экологические последствия. Из-за разрушения нефтепроводов в реки, на грунт выливается нефть, вызывая загрязнение почв, рек; из-за разрыва газопроводов выходят из строя коллекторы и трубы (слайд 23)
Задание: ответить на вопросы:
- Почему многие детали быстрее корродируют вблизи предприятий?
- Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
- Давайте вернемся к листу информации и на основе полученных сегодня на уроке знаний ответим на вопрос:
«Какие процессы послужили причиной разрушения яхты «Зов моря»? (слайды 24,25)
1вариант: Почему на оцинкованном баке, на месте царапины, цинк разрушается, а железо не ржавеет
2 вариант: На алюминиевой крышке стоит медная заклепка. Что разрушится быстрее, крышка или заклепка?
Читайте также:
