Коррозия металлов в водной среде
Обновлено: 04.10.2024
Одним из наиболее опасных для металла явлений считается морская коррозия. Это электрохимический процесс, который запускается и протекает из-за особенностей состава жидкости.
В этом материале мы подробнее разберем особенности явления, его протекание и методы защиты.
Почему морская вода так опасна для металла
По статистике, металлические изделия в море портятся намного быстрее, чем в стандартных условиях на открытом воздухе.
Катализатором становится 3 особенности жидкости:
- Большое количество кислорода. Как известно, именно он запускает окисление, которое и понимается под коррозией. Уровень содержания кислорода – до 8 мг на один литр.
- Электропроводность. Морская вода выступает как хороший электролит. В некоторых морях ее электропроводность составляет 3х10-2 Ом-1 см-1.
- Особый состав. Химики давно установили, что в жидкости присутствует весь набор веществ, делающих ее опасной для металла – от сульфатов натрия и солей кальция до хлоридов.
Коррозия в морской воде протекает быстрее, потому что у нее есть выраженное депассивирующее действие. Если на поверхности начинает формироваться защитная пассивная пленка, вода быстро разрушает ее.
Все что попадает в море начинает разрушаться. Убедитесь в этом, если посмотрите на состояния днищ кораблей, погруженных металлоконструкций, трубопроводов, проложенных по дну.
То же относится и к металлическим изделиям, которые периодически соприкасаются с агрессивной средой, к примеру, при охлаждении.
Особенности протекания процесса
Морская коррозия металлов протекает под воздействием множества внешних агрессивных факторов. Как мы уже отмечали, этот процесс относится к электромеханическим разновидностям процессов.
Его протекание напрямую связано с кислородной деполяризацией и дифузионно-кинетическим катодным контролем.
Проблем добавляет то, что сама вода постоянно двигается. Это связано не только с давлением, но и с тем, что суда постоянно находятся в движении с собственной скоростью.
В зависимости от условий, в которых находится металлоконструкция, меняется тип контроля:
- При сильной аэрации и в местах с сильным течением, частым волнением, кинетический контроль выходит на первый план.
- На участках где морская вода находится в неподвижном состоянии, преобладающим оказывается катодный контроль.
Если рассматривать процесс как катодно-анодную реакцию, мы увидим, что в качестве анода выступает металл, в то время как катодом становится оксидная пленка на его поверхности.

Морская коррозия становится заметной быстро. Она вызывает масштабное разрушение материала, на нем появляются язвы большой глубины, структура металла разрушается и становится хрупкой. Материал уже переносит прежнего нагрузок.
Также не стоит сбрасывать со счетов атмосферную коррозию в морских районах. Она связана с особым составом воздуха, воздействием других особых условий среды.
Что усиливает морскую коррозию
На разных морях ржавение металла протекает с разной скоростью. На скорость и особенности явления влияет 6 факторов среды:
- Степень солености воды. Чем больше твердых веществ растворено в жидкости, тем больше будет степень солености. Этот фактор не сильно влияет на скорость или характер процесса, но чем больше содержание, тем выше будет опасность на контрасте с другими факторами.
- Состав воды. Состав жидкости формирует благоприятную среду, в которой коррозия могла бы развиваться намного быстрее. Состав отличается в зависимости от географического расположения места. Одними из самых опасных веществ становятся хлориды и сероводород. Если их много, катодный и анодный процесс становятся более интенсивными. Также такой состав приводит к появления сульфидов, которые будет сложно растворить. Еще один фактор риска – большое количество ионов брома. Интересная особенность заключается и в том, что в ряде случае состав выступает и в качестве защитного фактора – он помогает сформировать специальную пленку, отталкивающую внешние угрозы.
- Скорость течения. Чем быстрее течение, тем лучше будет диффузия кислорода. Потому, когда судно движется с большой скоростью, риск морской коррозии становится все более и более ощутимым. Но опасность представляет и неподвижная вода. Даже когда на море штиль, есть риск что ржавение начнет протекать с диффузионным контролем.
- Место расположения ватерлинии. Место, с которым соприкасается морская вода, намного больше других поражено коррозионными процессами. Причина в том, что на этом участке кислород наиболее сильно влияет на металл. Также сказывается и температура. Вода, которая омывает ватерлинию более теплая из-за контакта с солнечными лучами.
- Наличие прокатной окалины на поверхности металла. Опасность ее присутствия заключается в том, что в этом случае сильно упрощается формирование гальванопары. Это опасно, потому что возникает анодное растворение металла.
- Биологический состав морской воды. Как и в почве, в морской воде много микроорганизмов, флоры и фауны, которые стимулируют разложение металла. К ним относятся различные виды бактерий, а также кораллы и моллюски. При их большом скоплении увеличивается риск образования коррозийных поражений. Исключение составляют только некоторые виды морских существ, которые не позволяют кислороду контактировать с металлическими частями. Скорость протекания коррозийного поражения также зависит от сплава, который был использован при изготовлении той или иной конструкции. Так опасность для биокоррозии представляют сплавы, в которых есть много свинца, никеля, олова и алюминия. Наиболее защищенными оказываются магниевые сплавы и медь.
Виды морской коррозии
В морской воде протекает 2 вида коррозии.
Наиболее распространенными среди них считаются следующие:
- Контактная. Проявляется из-за контакта жидкости и металла. Причиной становится хорошая электропроводность. Если рядом в воде находится несколько металлических изделий, металл становится по отношению к стали катодом.
- Электрокоррозия. Появляется, потому что в воде находятся блуждающие токи. Иногда проблемы оказываются связанными и с самими морскими судами, состоянием проложенной на них электросети.
Коррозия металла в морской воде способна за короткое время вывести из строя даже крупную металлоконструкцию. Как результат – она теряет прочность и обрушиться.
Это всегда риск появления человеческих жертв и больших убытков.
К 2020 году разработано множество средств, позволяющих или обеспечить защиту от агрессивной среды или замедлить протекание процесса. Их качество доказано на практике – удается получить заметный результат.
Рассмотрим вопросы защиты от морской коррозии более подробно.
Как защитить металл от повреждения
В работе используется несколько видов защитных средств, к которым относятся такие, как:
Использование специальных лакокрасочных покрытий
Как и в случае с борьбой с ржавением под открытым воздухом, очень важно не допустить контакта агрессивной среды с металлом. ЛКМ в таком случае подходят отлично.

Есть несколько типов материалов, которые можно свободно использовать в окрашивании.
К ним относятся такие, как:
- Краски на основе битумов.
- Составы с фенолформальдегидной основой.
- Этинолевые лакокрасочные материалы.
Хорошо показывают себя вещества с эпоксидной, каменноугольной основой. Главное требование, чтобы в них было как можно меньше растворителей.
Главное преимущество использования такого средства заключается в простоте нанесения.
Краска наносится на поверхность, защищенные места сразу становятся хорошо видимыми.
Для дополнительного усиления, ограждающего от агрессивной среды эффекта, можно также применять разные окиси, в том числе, ртути и меди. В таком случае конструкция не будет обрастать морскими обитателями.
Чтобы нанесение ЛКМ дало лучшие результаты, поверхность металлоконструкции нужно будет фосфатировать. Только после этого допускается проведение окрашивания.
Стоит также учитывать, что оно должно быть как можно более толстым, чтобы удержаться дольше и сохранить заметный эффект.
Применение металлических защитных покрытий
В этом направлении работает наша компания. Среди самых распространенных видов составов можно назвать цинк.
Он наносится на металл слоем толщиной до 200 мкм. При этом создается хорошая защита от контакта со средой.
Еще одно преимущество – такой материал можно окрашивать.
Оцинковывают самые разные изделия, в том числе, днища морских судов.
Зачистка поверхности
Процесс очень важен, потому что позволяет снять окалину. Как мы уже говорили выше, ее присутствие способно в несколько раз ускорить негативный процесс.
Для удаления окалины могут применяться высокие температуры, химическое травление и очистка пескоструйным методом.
Низкое легирование
Изменение самого характера стали – один из действенных методов для борьбы с коррозией. По данным исследований, стали с большим содержанием никеля портятся особенно быстро, в то время как добавление меди помогает сделать конструкцию намного более стойкой.
Создание дополнительной электрохимической защиты
Она может быть двух типов – от внешнего источника тока или от протектора. При этом удается остановить формирование пор и протекание электрохимического процесса, представляющего большую опасность для материалов.
Все перечисленные методы используются и в месте. В таком случае, вероятность повреждения металла станет намного ниже. Вопрос о подборе материалов, правильном конструировании также стоит очень остро.
Защита методом горячего цинкования
Наша компания предлагает горячую оцинковку различных видов конструкций, в том числе тех, которые постоянно находятся в контакте с морской водой.
Работаем с 2007 года и готовы быстро выполнить даже наиболее сложный и крупный заказ.
4 причины обратиться к нам:
- Действуют три цеха горячего цинкования. Наши производственные мощности – 120 тысяч тонн в год.
- Работаем с большинством видов деталей и конструкций. На предприятии установлена одна из самых крупных ванн в ЦФО. Ее глубина составляет 3,43 метра.
- Гарантируем качество. Горячее цинкование проводится строго по ГОСТ 9.307-89.
- Используем передовое оборудование. Установлена европейская техника от KVK KOERNER и EKOMOR.
Готовы ответить на все интересующие заказчика вопросы и быстро приступить к работе. Звоните или оставляйте заявку на сайте.
33. Коррозия металлов в водной среде. Факторы, влияющие на интенсивность процесса коррозии.
В процессе водоподготовки и очистки самые различные материалы постоянно контактируют с водой. Это – материалы, применяемые для строительства гидротехнических сооружений и сооружений водопровода и канализации. Материалы трубопроводов, транспортирующих воду различного состава, материалы машин и механизмов, охлаждаемых водой и т.д. В практике водоснабжения и канализации широко применяются чугун, сталь и железобетон. Активное воздействие воды на эти материалы проявляется в коррозии металлов.
Коррозией называется процесс разрушения поверхности металла в результате химического или электрохимического воздействия на нее окружающей среды.
Химически чистая вода – очень слабый электролит. Электропроводность природных и сточных вод значительно выше, т.к. они содержат достаточно много разнообразных солей, диссоциирующих в воде на ионы.
Электропроводность металлов объясняется наличием в кристаллической структуре свободных или очень подвижных электронов. При контакте металлической поверхности с водой заряженные частицы металла (катионы) могут переходить в раствор, а электроны остаются в металле. В результате водный слой, контактирующий с металлом, приобретает положительный заря, а оставшиеся в металле некомпенсированными электроны сообщают ему отрицательный заряд.
Поскольку и металл и электролит являются сложными системами, содержащими электрические заряды, на границе (металл –раствор) возникает скачок электрического потенциала, который называют электродным потенциалом. Электрохимическая неоднородность границы (металл –электролит) приводит к тому, что электродный потенциал, возникающий на отдельных участках, оказывается различным. Это различие в электродных потенциалах на некоторых участках границы (металл –электролит) приводит к возникновению электрохимических пар (анодных и катодных участков), между которыми протекает коррозионный ток.
Электрохимическая коррозия протекает как два достаточно самостоятельных процесса:
анодный процесс, состоящий в переходе ионов металла в раствор; для железа он может быть представлен след. образом: [Fe 2+ + 2e - ] → Fe 2+ + [ 2e - ]
металл раствор металл
катодный процесс, заключающийся во взаимодействии избыточных электронов металла с каким-либо атомом или ионом, способным восстанавливаться; основными реакциями на катоде являются восстановление протона до газообразного водорода:
2Н + + 2е - → Н + Н → Н
и восстановление кислорода с образованием гидроксил-ионов
Ток между анодом и катодом протекает в результате движения электронов в металле и ионов в растворе в соответствии со знаком заряда. При электрохимической коррозии разрушение металла происходит только на анодных участках. Тогда как на катоде потерь металла не обнаруживается.
Факторы, влияющие на интенсивность процесса коррозии На скорость и интенсивность коррозии оказывает влияние как характер обработки поверхности металла, так и состав и условия воздействия внешней среды. Грубо обработанная поверхность активно корродирует, тогда как шлифовка и полировка металла повышают устойчивость его против коррозии. Поверхность металла может стать пассивной в результате образования на ней защитной оксидной пленки. Пассивация наблюдается при контакте металла с сильными окислителями, в том числе с кислородом. Основными определяющими факторами коррозии в водной среде являются:
углекислое равновесие и концентрация растворенного кислорода;
концентрация солей в воде;
присутствие в воде микроорганизмов.
Углекислое равновесие Различные соединения углекислоты в воде находятся в состоянии динамического равновесия. Практическое значение имеет карбонатно-кальциевая система равновесий, которая обусловливает такие свойства воды, как стабильность и агрессивность:
полусвязанная связанная свободная
В условиях равновения концентрация свободной углекислоты в воде точно соответствует тому ее количеству, которое необходимо для поддержания в растворе определенной концентрации гидрокарбоната кальция. Это равновесная углекислота. Если количество СО2 в точности отвечает равновесной концентрации, вода называется стабильной , в ней не происходит ни растворения, ни выпадения карбонатов.
Если концентрация СО2 меньше равновесной, реакция происходит слева направо, в результате чего карбонат кальция – соединение малорастворимое – выделяется на поверхности металла, образуя пленку с выраженными защитными свойствами.
Избыток СО2 сверх равновесной концентрации называется агрессивной углекислотой. Углекислотная агрессивность воды по отношению к металлам обусловлена понижением рН воды. Кроме того, защитная пленка карбоната кальция при контакте с агрессивной водой растворяется, что способствует развитию коррозии.
Стабильность воды оценивается рядом способов, один из которых – определени6е разности величин рН исследуемой воды (рН0) и воды с равновесными концентрациями соединений углекислоты (рНs). Разность между этими величинами называется индексом насыщения:
Если I= 0, вода считается стабильной ; при I> 0 вода способна выделять карбонат кальция; при I
Концентрация солей в воде. Увеличение общего солесодержания повышает электропроводность воды и таким образом приводит к ускорению коррозионных процессов. Однако значительное повышение концентрации солей может привести к снижению скорости коррозии в результате уменьшения растворимости кислорода.
Некоторые катионы и анионы, присутствующие в воде, играют роль стимуляторов коррозии. Например, хлорид-ионы могут замещать кислород в защитной оксидной пленке, что приводит к образованию в ней пор и облегчает начало коррозии. Сульфаты ускоряют коррозию непосредственно увеличивая электропроводность и косвенно способствуя развитию биологической коррозии. К числу стимуляторов коррозии относятся также ионы металлов с переменной степенью окисления., например Сu 2+ → Cu + , Fe 3+ → Fe 2+ . Они ускоряют реакцию на катоде, выполняя роль деполятора: Fe 3+ + е - → Fe 2+
Хроматы, силикаты, гидроксил-иоы, напротив, снижают интенсивность коррозионных процессов, способствуя образованию защитных пленок на металле.
Роль микроорганизмов в коррозии металлов Многие виды бактерий являются активными коррозионными агентами. Наибольшее значение имеют группы бактерий, участвующих в превращениях железа и серы.
Роль микроорганизмов в процессах сводится к ускорению деполяризации катода путем ферментативного переноса электронов, выделению коррозионных продуктов обмена, образованию пар дифференциальной аэрации.
Поселяясь в трубах, бактерии образуют на них стенках слизистые скопления, обладающие высокой механической прочностью и поэтому не смываемые током воды. Прочность этих образований обусловлена волокнистой структурой оболочек железобактерий. Коррозия начинается с образования на внутренней поверхности трубы желтых или темно-коричневых налетов или каверн, состоящих из гидроксида трехвалентного железа. Участки труб под кавернами оказываются изолированными от воды, и доступ кислорода к ним затруднен. Т.о., развитие железобактерий приводит к образованию на поверхности трубы зон с различной степенью аэрации, что приводит к возникновению коррозионного тока. Участки под кавернами функционируют как аноды. Деятельность железобактерий на анодных участках приводит к окислению Fe 2+ в Fe 3+ и его гидролизу. Образование гидроксида трехвалентного железа сопровождается снижением рН до 5-6, т.е. созданием коррозионной среды.
Сульфатредуцирующие бактерии- строгие анаэробы. Микробиологическая коррозия такого типа является вторичным процессом и развивается вслед за обычной электрохимической коррозией. При этом под слоем ржавчины – продукта коррозии – создаются благоприятных анаэробные условия для развития сульфатредуцирующих бактерий. Необходимым условием для начала процесса является наличие сульфатов. В природных и сточных водах они всегда есть. Сульфатредуцирующие бактерии часто развиваются под массой железобактерий, обеспечивающих им строго анаэробные условия. В этом случае выделяющийся при восстановлении сульфатов серрводород вступает во взаимодействие с гидроксидом трехвалентного железа – продуктом жизнедеятельности железобактерий:
Защита металлических трубопроводов и конструкций от коррозии Основными способами защиты поверхности металла от коррозии являются нанесение на металлическую поверхность защитного слоя и электрохимическая защита.
Для защиты трубопроводов обычно применяют первый способ. Наружную поверхность труб защищают от коррозии нанесением слоя каменноугольной смолы. Для внутренней поверхности чугунных труб применяют битумные или полимерные покрытия, которые наносятся при изготовлении труб на заводе.
Предотвратить или замедлить коррозию можно путем предварительной обработки транспортируемой по ним воды. В этом случае к воде добавляют соответствующие реагенты, которые обеспечивают осаждение на внутренней поверхности труб нерастворимых соединений, образующих защитную пленку. Так называемая стабилизационная обработка воды - один из самых эффективных способов борьбы с коррозией водопроводных труб.
При положительном индексе насыщения воду обрабатывают соляной или серной кислотой. При этом содержание в воде ионов НСО3 - снижается, а концентрация СО2 возрастает согласно реакции НСО3 - + Н + → СО2 + Н2О вследствие чего выпадение из воды карбоната кальция прекращается.
При I3 - по реакции СО2 + ОН - → НСО3 - , в результате такой обработки вода перестает быть коррозионной. К числу веществ, добавление которых к воде приводит к образованию защитных пленок и торможению процесса коррозии, относятся гексаметафосфат натрия и жидкое стекло. При обработке воды гексаметафосфатом натрия образуются малорастворимые соединения, которые цементируют коррозионные отложения, делают их плотными и малопроницаемыми для воды и кислорода. Применение жидкого стекла для защиты от коррозии основано на его способности взаимодействовать с ионами кальция и магния, присутствующими в воде, и образовывать защитную пленку, состоящую из силикатов указанных металлов.
Сущность электрохимической защиты состоит в предотвращении растворения железа на анодных участках путем присоединения к системе анодов (протекторов), изготовленных из металлов с более отрицательным электродным потенциалом, чем защищаемый металл. Для защиты стальных конструкций могут быть использованы аноды из цинка, алюминия и их сплавов. Защищаемое сооружение выполняет роль катода.
Универсальных средств защиты от микробиологической коррозии не существует. Описанные методы создания защитных покрытий обеспечивают изоляцию металлической поверхности от воды, а следовательно, и от микробиологического воздействия. В некоторых случаях могут использоваться бактерицидные или бактериостатические вещества.
Ржавчина, самый распространённый вид коррозии.
Коррозия металлов — разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой. Для процесса коррозии следует применять термин «коррозионный процесс», а для результата процесса — «коррозионное разрушение». Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Типы коррозии
Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.
Примером крупномасштабной электрохимической коррозии может служить происшествие, случившееся в декабре 1967 года с норвежским рудовозом «Анатина» [3] (англ. Anatina), следовавшим из Кипра в Осаку. Налетевший в Тихом океане тайфун привёл к попаданию в трюмы солёной воды и образованию большойгальванической пары: медного концентрата со стальным корпусом судна, который вскоре размягчился, и судно подало сигнал бедствия. Экипаж был спасён подоспевшим немецким судном, а сама «Анатина» еле-еле добралась до порта.
Коррозия и консервация оборудования - Влияние примесей на коррозию металлов в водной среде
1.2. Влияние примесей на коррозию металлов в водной среде
На скорость и характер коррозии металла влияют как внутренние факторы - состав, гетерогенность, механические напряжения металла, так и внешние. Одним из решающих внешних факторов следует считать влияние на процессы коррозии присутствующих в воде различных химических соединений.
Так, анионы С1 , Вr, I мало влияют на кинетику анодного растворения металла в активной области коррозионного процесса и даже несколько тормозят реакцию. В пассивной области эти анионы часто вызывают депассивацию, и локальную коррозию металла. Депассивирующее действие галогенов имеет адсорбционную природу. Механизм депассивации объясняется адсорбцией хлор-ионов пассивной пленкой, из которой соответственно вытесняются и замещаются ионы кислорода. При этом получаются растворимые хлористые соединения металла и на участках металлической поверхности образуются поры [2].
Аустенитные нержавеющие стали способны пассивироваться в растворах и в присутствии хлоридов, но с увеличением концентрации последних область пассивного состояния уменьшается. В растворе хлоридов при отсутствии кислорода аустенитная сталь не подвергается коррозионному растворению, а с введением кислорода она корродирует тем быстрее, чем выше его концентрация в растворе При температуре 250-300 С коррозионное растрескивание аустенитных сталей наступает уже при содержании в воде хлорилов и кислорода более 0,5 мг/кт каждого.
В слабокислых растворах при наличии хлор-иона возникает точечная коррозия нержавеющих аустенитных сталей, развивающаяся не на границах зерен, а в отдельных точках поверхности и распространяющаяся со временем вглубь. Этот вид коррозии наблюдается для металла, находящегося на границе пассивного состояния, когда защитная пленка еще не обладает достаточной прочностью. Ослабленными частями поверхности могут быть отдельные включения оксидов реагирующих элементов, неровности поверхности, места, где защитная оксидная пленка еще только зарождается, и др.
Для развития точечной электрохимической коррозии в этом случае необходимо чтобы работала коррозионная пара анод-катод. Устойчивая работа такой пары возможна, если возникающий точечный анод в данных условиях не пассивируется под действием анодного тока. Это обеспечивается, например, наличием в растворе активных ионов хлора с одновременным присутствием кислорода или другого окислителя при слабокислой среде. В результате протекания анодного процесса на дне язвинки образуются вторичные гидрооксидные продукты коррозии, снижающие pH раствора. Скорость коррозии в глубину увеличивается из-за малых площадей анода и больших площадей катодных участков.
Высокая степень перехода продуктов коррозии в хлоросодержащую воду определяется уменьшением концентрации ионов Fe2+, преобразующихся в комплексное соединение трехвалентного железа по реакции
Однако введение в раствор посторонних ионов может подавить депассивацию галогенами за счет их вытеснения из пассивной оксидной пленки.
Поданным [41] существует определенное соотношение концентраций посторонних анионов и хлоридов
При совместном воздействии кислорода пассивное состояние
стали нарушается значительно легче в кислом электролите, чем нейтральном. Пассивирующие свойства электролита, содержащего анион дают определенные соотношения сульфатов и хлор-ионов, при которых депассивирующее действие на металл хлор-ионов прекращается.
Значения а для иона С вводом кислорода, например до 200 мг/кг, в нейтральной среде, содержащей хлориды, скорость коррозии стали повышается в 2 раза.
Нитриты выполняют двойственную роль при коррозии металла. С одной стороны, они служат мощным деполяризатором катодных участков коррозионных пар, ускоряя процессы электрохимической коррозии, с другой, нитриты, обладая окислительными свойствами, окисляют металл, создавая защитные оксидные пленки. Чем выше концентрация нитритов в растворе, тем больше вероятность образования защитных пленок.
Процесс нитритной коррозии металла можно охарактеризовать следующими реакциями:
(16)
При повышенных температурах предполагается, что коррозия металла обуславливается и кислородом, образующимся в результате термического разложения нитритов по реакции:
Рис. 1.3. Зависимость скорости коррозии стали от концентрации нитритов в котловой воде: 1,2 - при р, равном 3 и 10 МПа
Так, при давлении 3 МПа коррозионные свойства нитритов возрастают с ростом их концентрации в воде до 100 мг/кг, затем снижаются, при концентрации 500 мг/кг коррозия металла практически прекращается. При давлении 10 МПа скорость коррозии возрастает непрерывно с ростом концентрации нитритов (рис. 1.3). При введении едкого натра пассивирующие свойства нитритов возрастают, а при введении в раствор хлоридов понижаются При добавлении сульфита натрия в раствор, содержащий NaNO2, заметно уменьшается как общая, так и локальная скорость коррозии металла. Наилучший эффект получен при соотношении Возникновению и развитию коррозионного растрескивания углеродистых и слаболегированннх хромистых и хромоникелевых сталей способствует сероводород. Уже при концентрации H2S, равной 0,0002 %, на металлической поверхности возникает межкристаллитная сетка сульфидов. Атомарный водород, образующийся при сероводородной коррозии, может диффундировать в железо, где его часть, находясь в пустотах кристаллической решетки металла может соединяться в молекулы. При скоплении большого количества молекул водорода в пустотах кристаллической решетки на поверхности стали могут образоваться вздутия. Внутри этих вздутий создается давление водорода. Склонность к образованию межкристаллитных трещин в присутствии сероводорода проявляется в слабокислой и щелочной средах.
Большой интерес представляет влияние углекислоты на коррозию металла. Углекислота в растворе диссоциирует не полностью
Наличие буферных свойств раствора затрудняет нейтрализацию угольной кислоты, так как разрядившиеся ионы водорода пополняются новыми за счет дальнейшей диссоциации, и pH среды изменяется незначительно. Атомарный и молекулярный водород восстанавливают и отслаивают оксидные пленки с поверхности металла, вследствие чего кислород через поврежденные участки беспрепятственно поступает к поверхности металла, и коррозия протекает с неизменной скоростью.
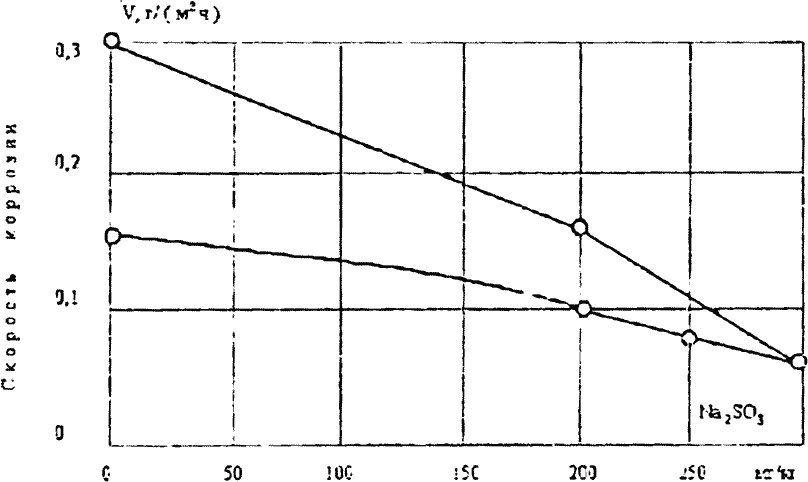
С повышением концентрации СO2 в обессоленной воде уже при pH равном 5,7 скорость коррозии стали значительно увеличивается по сравнению со скоростью коррозии при pH = 7. На коррозию заметное влияние оказывает скорость движения потока среды. Так, по данным [7] при движении жидкости скорость общей коррозии углеродистой стали в оборотной воде в 1,4-3,4 раза больше, а в дистиллированной воде в 6-16 раз больше, чем в статических условиях.
В воде, содержащей ионы В дистиллированной воде скорость коррозии со временем непрерывно растет в связи с отсутствием ионов Раствор, содержащий NaOH, КОН может вызвать щелочную хрупкость металла как при наличии кислорода, так и при его отсутствии. Опасная концентрация щелочей в растворах для разных марок сталей различна. Так, разрушение стали 18 Cr.SNi происходит уже под действием 1,47 н. гидроксида натрия при температуре 330°С и при отсутствии упаривания. На теплопередающей поверхности за счет упаривания концентрация щелочи может увеличиваться в 50-100 раз.
Рис. 1.4. Зависимость скорости нитритной коррозии стали от концентрации сульфита натрия в котловой воде (концентрация в котловой воде нитрита натрия 100 мт/кг). 1,2- при р - 3 и 100 МПа.
Коррозионные процессы идут уже при концентрации свободной щелочи у стенки металла свыше 5% [43]. При концентрации NaOH более 30% и с ростом температуры защитные оксидные пленки растворяются особенно интенсивно с образованием феррита натрия Na2Fe2O4 и гипоферита натрия Na2FeO2. Наличие в обессоленной воде щелочи в малых количествах (менее 100 мг-экв/л) способствует локализация коррозии металла при этом важное значение имеет не абсолютная щелочность воды, а относительная, т.е. доля едкого натра в общем солевом составе котловой воды.
Болотная и речная вода как коррозионная среда
Факторы, влияющие на процесс протекания коррозии в водной среде
Коррозия – это процесс разрушения поверхности металла из-за электрохимического и химического влияния окружающей среды.
Электропроводность металлов обусловлена наличием в их кристаллической структуре подвижных или свободных электронов. Во время контакта поверхности металла с речной или болотной водой катионы (положительно заряженные частицы металла) переходят в раствор, а электроны остаются. Таким образом водный слой, который контактирует с поверхностью металла, получает положительный заряд, а оставшиеся в металле электроны сообщают ему отрицательный. Металл и электролит представляют собой сложные системы, которые содержат электрические заряды, поэтому на границе металл-вода возникает скачок электрического потенциала - электродный потенциал. Неоднородность металл-электролит становится причиной того, что электродный потенциал на различных участках границы металл-вода может быть различным. Данное различие становится причиной появления электрохимических пар (катодных и анодных участков), между которыми протекает коррозионный ток. Такая коррозия протекает в виде двух самостоятельных процессов:
- Катодный процесс, который заключается во взаимодействии лишних электронов металла с атомом или ионом, которые могут восстанавливаться, в основном это реакции восстановления протона до газообразного водорода.
- Анодный процесс, который заключается в переходе ионов металла в раствор.
На интенсивность и скорость процесса коррозии в болотной и речное воде оказывает влияние характер обработки поверхности металла, состав коррозионной среды, а также ее условия. Например, плохо и грубо обработанная поверхность очень активно корродирует, а ее шлифовка или полировка повышают степень устойчивость к процессу коррозии. Поверхность металла становится пассивной из-за образования на ней оксидной пленки.
Оксидная пленка на металле – это пленка, образующаяся при определенных условиях в воздухе или окислительной среде и состоящая из окислов данной среды.
Основными факторами, которые определяют коррозию металла в условиях речной или болотной воды являются:
Готовые работы на аналогичную тему
- Углекислое равновесие.
- Концентрация солей в воде.
- Наличие в воде микроорганизмов.
При углекислом равновесии концентрация свободной углекислоты в речной или болотной воде соответствует тому ее объему, которое нужно для поддержания необходимого объема гидрокарбоната кальция. Если количество углекислого газа соответствует условию равновесной концентрации, то вода называется стабильной. В такой воде протекание процессов выпадения карбоната или растворения не происходит. В случае, если количество углекислого газа ниже, чем равновесной, то при контакте такой воды с поверхностью металла происходит образование пленки (из-за выделения карбоната кальция) с ярко выраженными защитными свойствами. При избытке углекислоты в воде ее называют агрессивной. Защитная пленка карбоната кальция при контакте с такой агрессивной водой разрушается, что способствует протеканию процесса коррозии.
Повышенное содержание солей в болотной или речной воде становится причиной увеличения ее электропроводности, которая способствует росту скорости протекания коррозионных процессов. При этом, значительное превышение содержания солей в воде может быть причиной уменьшения скорости из-за уменьшения степени растворимости кислорода. Некоторые анионы и катионы, присутствующие в составе воды, являются стимуляторами коррозии. Например, ионы хлорида могут замещать собой кислород в защитной пленке, что способствует образованию пор, что облегчает начало процесса коррозии. Сульфаты могут увеличивать электропроводность, что способствует протеканию биологической коррозии.
Некоторые микроорганизмы являются коррозионными агентами. Роль микроорганизмов в протекании процесса коррозии заключается в деполяризации катода при помощи образования пар дифференциальной аэрации, выделения продуктов обмена, а также ферментативного переноса электронов.
Защита трубопроводов от коррозии
Основными способами, задачей которых является защита поверхности металла от коррозии, являются электрохимическая защита или нанесение на металлическую поверхность защитного слоя. Для защиты нефтегазопроводов применяют нанесение защитного слоя. Внешнюю поверхность трубопроводов от коррозии в водной среде защищают при помощи нанесения на нее каменноугольной смолы. При транспортировке речной или болотной воды внутреннюю поверхность защищают при помощи полимерных или битумных покрытий, которые наносятся в процессе изготовления труб на заводе. Также интенсивность и скорость коррозии, во время транспортировки воды можно снизить за счет ее обработки. В воду добавляются специальные реагенты, способствующих осаждению на трубах нерастворимых соединений, которые образуют защитную пленку.
Читайте также:
