Кристаллическая решетка галогенов атомная ионная молекулярная металлическая
Обновлено: 19.05.2024
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой .
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную , металлическую , атомную и молекулярную .
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na + и хлора Cl − , а в узлах решётки сульфата калия чередуются простые ионы калия K + и сложные сульфат-ионы S O 4 2 − .
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые , тугоплавкие , нелетучие . Такие вещества хорошо растворяются в воде .

Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск , ковкость , пластичность , хорошо проводят электрический ток и тепло .

Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит , кремний , бор и германий , а также сложные вещества, например, карборунд SiC и кремнезём , кварц , горный хрусталь , песок , в состав которых входит оксид кремния(\(IV\)) Si O 2 .
Таким веществам характерны высокая прочность и твёрдость . Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения . Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.

Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость , низкие температуры плавления и кипения .
Такие вещества летучи . Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами ( He , Ne , Ar , Kr , Xe , Rn ), а также неметаллы с двух- и многоатомными молекулами ( H 2 , O 2 , N 2 , Cl 2 , I 2 , O 3 , P 4 , S 8 ).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд , иод , твёрдые аммиак , кислоты , оксиды большинства неметаллов . Большинство органических соединений тоже представляют собой молекулярные кристаллы ( нафталин , сахар , глюкоза ).


Попробуем определить, каковы примерно температуры плавления у фторида натрия , фтороводорода и фтора .
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF , HF и F 2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
1. Типы кристаллических решёток
Кристаллические решетки. Строение вещества
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом .
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло.

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества , образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы(O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями(кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптони др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка

И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью . Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы , как при образовании ионной связи, и образуются общие электроны , как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют « электронным газом ». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
Галогены молекулярная структура (Пример)

Химические элементов главной подгруппы седьмой группы (устаревшая таблица) и по новой в 17-й группе периодической таблицы химических элементов Д. И. Менделеева — которые являются типичными неметаллами, фтор, хлор, бром, иод и астат.
Особенности атомной и молекулярной структуры галогенов
Элементы группы галогенов очень сходны по свойствам, поэтому рассматриваются вместе. Несколько отличен от других фтор. «Галогены» в переводе означает «солероды». Действительно, все галогены — фтор F, хлор Сl, бром Вr и иод I — при непосредственном взаимодействии с металлами образуют соли. Галогеном является и астат At, открытый в 1940 г.
Распределение по орбиталям электронов внешнего электронного слоя у всех галогенов однотипное
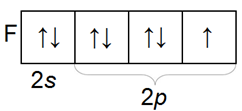



Общие свойства строения
Галогены имеют много общего в строении атомов и молекул. У них завершается застройка р-оболочки внешнего слоя, поэтому все они принадлежат к числу р-элементов. Внешнему электронному слою атомов галогенов недостает до завершения одного электрона, поэтому электроотрицательность у этих элементов выражена ярко и в окислительно-восстановительных реакциях они ведут себя в основном как окислители.
Молекулы галогенов состоят из д вух атомов (F2, Сl2, Вr2, l2), соединенных между собой посредством ковалентной неполярной связи. Между атомами в молекулах галогенов возникает одна общая электронная пара. Это свидетельствует о том, что в простых веществах данные элементы одновалентны. Кристаллическая решетка галогенов молекулярного типа.
Атомы разных галогенов различаются числом электронных слоев, в связи с чем радиусы атомов галогенов различны (табл.). С возрастанием зарядов ядер радиусы атомов увеличиваются, что ведет к постепенному уменьшению величины электроотрицательности от фтора к иоду и снижению неметалличности свойств. Наиболее ярко выраженным неметаллом среди галогенов является фтор, наименее ярким — йод.
Вопросы и ответы на прочитанный материал
- Как меняется величина атомного радиуса в зависимости от возрастания заряда ядра атома?
- Какого типа химическая связь в молекулах галогенов?
- Какого типа кристаллическая решетка у галогенов?
- Какова валентность галогенов в свободном состоянии?
- Почему при образовании молекулы галогена между атомами возникает лишь одна электронная пара?
- Как меняется величина электроотрицательности с возрастанием радиусов атомов? (См. Ответ)
Физические свойства галогенов
Все свойства галогенов, как физические, так и химические, зависят от строения атомов элементов. Эти свойства различных галогенов во многом сходны, но в то же время каждому галогену присущ ряд особенностей.
Фтор — газ светло-зеленого цвета, отличающийся чрезвычайно ядовитыми свойствами. Температура кипения фтора —188°, температура затвердевания —218°. Плотность 1,11 г/см3.
Хлор — газ желто-зеленого цвета. Он также ядовит, имеет резкий, удушливый, неприятный запах. Хлор тяжелее воздуха, сравнительно хорошо растворяется в воде (на 1 объем воды 2 объема хлора), образуя хлорную воду; Cl2agi при температуре— 34° превращается в жидкость, а при— 101° затвердевает. Плотность 1,568 г/см3.
Бром —единственный жидкий неметалл. Это вещество красно-бурого цвета, тяжелое, летучее. Сосуд, в котором находится бром, всегда окрашен его парами в красно-бурый цвет.
Бром имеет тяжелый неприятный запах («бром» в переводе на русский язык значит «зловонный»). В воде растворяется плохо, образуя бромную воду HBrO и HBr. Гораздо лучше бром растворяется в органических растворителях — бензоле, толуоле, хлороформе.
Если к бромной воде прилить небольшое количество бензола и хорошенько взболтать, то после расслаивания жидкостей можно заметить, как окраска бромной воды исчезает, а собравшийся наверху бензол окрашивается растворенным бромом в ярко-оранжевый цвет. Это объясняется тем, что бензол извлек из воды бром вследствие его лучшей растворимости в бензоле.
Хранят бром в склянках с притертыми пробками и притертыми колпаками. Резиновые пробки для работы с бромом, как и для работы с хлором, неприменимы, так-как они быстро разъедаются. Бром намного тяжелее воды (плотность 3,12 г/см 3 ). Температура кипения брома 63°, температура затвердевания —7,3°.
Йод — вещество кристаллическое, темно-серого цвета, в парах — фиолетового. Плотность йода 4,93 г/см3, температура плавления 113°, температура кипения 184°. Довести йод до плавления, а тем более до кипения при обычных условиях не удается, так как уже при слабом нагревании он из твердого состояния сразу переходит в пар —возгоняется.
Переход вещества из твердого состояния в газообразное, минуя жидкое, и обратно называется возгонкой. Это свойство характерно не только для йода, но и для некоторых других веществ. Его удобно использовать для очистки веществ от примесей.
Иод плохо растворяется в воде. Окраска йодной воды I2aq всегда светло-желтая. Но зато он прекрасно растворяется в спирте. Этим пользуются для приготовления 5—10% раствора иода в спирте, называемого йодной настойкой.
Иод растворяется также в бензоле, толуоле, эфире, сероуглероде и других органических растворителях. Интересно, что иод очень хорошо растворяется в растворе собственных солей, например в йодистом калии. Этот раствор, называемый раствором Люголя, широко применяется в клинических лабораториях.
Если в йодную воду I2aq добавить немного бензола, то при встряхивании на поверхности также образуется окрашенное бензольное кольцо, но только малинового цвета.
- Как меняется интенсивность окраски галогенов с возрастанием зарядов ядер?
- Какое название имеют растворы хлора, брома и иода в воде?
- Как меняется плотность галогенов с возрастанием зарядов ядер? (См. Ответ)
- Составьте и заполните таблицу «Физические свойства галогенов» по следующему образцу:
- Как объяснить с точки зрения строения кристаллической решетки низкие температуры плавления и кипения галогенов?
- Какова относительная плотность фтора и хлора по воздуху и водороду? Если вы не знаете, что такое относительная плотность газов, как она определяется и как ею пользоваться при расчетах, . После этого вы сможете ответить на вопрос.
- Какой объем займут 20 кг хлора при нормальных условиях? Если вы забыли, как вычислять объем газа при нормальных условиях, обратитесь к приложению. (См. Ответ)
Физиологическое действие галогенов
Все галогены ядовиты по своему физиологическому действию. Особенно ядовит фтор: при вдыхании в небольших количествах он вызывает отек легких, в больших — разрушение легочной ткани и смерть.
Хлор — также вещество очень ядовитое, хотя в несколько меньшей степени. Во время первой мировой войны он применялся как боевое отравляющее вещество, потому что он тяжелее воздуха и хорошо удерживается над поверхностью земли, особенно при безветренной погоде. Предельно допустимая концентрация свободного хлора в воздухе 0,001 мг/л.
Хроническое отравление хлором вызывает изменение цвета лица, легочные и бронхиальные заболевания. При отравлениях хлором в качестве противоядия нужно применять смесь паров спирта с эфиром, а также водяных паров с примесью нашатырного спирта, причем предварительно обязательно вынести пострадавшего на свежий воздух.
В небольших же количествах хлор может излечивать заболевания верхних дыхательных путей, так как губительно действует на бактерии. Благодаря дезинфицирующему действию хлор применяется для обеззараживания водопроводной воды.
Пары брома вызывают удушье. Ядовит и жидкий бром, причиняющий при попадании на кожу сильные ожоги. Переливать бром из одного сосуда в другой рекомендуется в резиновых перчатках и под тягой.
При попадании на кожу бром следует смывать органическим растворителем — бензолом или четыреххлористым углеродом, протирая пораженное место ватой, смоченной этими растворителями. При смывании брома водой нередко ожога избежать не удается.
Иод наименее ядовит из всех галогенов. Вдыхание паров иода при его нагревании может вызвать отравление, но работать с парообразным иодом приходится редко, например при очистке его возгонкой. Кристаллический иод руками брать не следует, так как при попадании на кожу он вызывает появление характерных желтых пятен. Все работы с галогенами следует производить в вытяжном шкафу.
Вместе с тем галогены являются жизненно важными элементами. Хлор в виде поваренной соли постоянно применяется в пищу, а также входит в состав зеленого вещества растений — хлорофилла. Недостаток соединений фтора в питьевой воде вызывает разрушение зубов. Иод необходим всем живым организмам, как растительным, так и животным. Он участвует в регулировании обмена веществ.
В организме человека иод сосредоточен главным образом в щитовидной железе и участвует в образовании ее гормона. Недостаток иода вызывает болезненные изменения щитовидной железы. Для предотвращения заболевания в пищу в очень небольших количествах добавляют иод, разводя несколько капель йодной настойки на стакан воды, но чаще в виде иодида натрия и иодида калия.
• Запишите в тетрадь меры техники безопасности в работе с галогенами и первой помощи при отравлениях.
Химические свойства галогенов
По характеру химических свойств, как отмечено выше, все галогены являются типичными неметаллами, обладающими значительной электроотрицательностью. Наиболее электроотрицательным элементом, обладающим наибольшей неметаллической активностью, является фтор, наименее активен иод.
Рис. 21. Горение водорода в хлоре. 1- хлор 2- водород
Взаимодействие галогенов с простыми веществами. Проследить уменьшение химической активности от фтора к хлору можно на примерах разных реакций. Особенно интересно взаимодействие разных галогенов с водородом. Условия реакций у них при этом разные.
Так, фтор реагирует с водородом со вз рывом даже в темноте. При этом образуется фтористый водород по уравнению.
Фтористый водород является наиболее прочным соединением среди галогеноводородов.
Взаимодействие хлора с водородом происходит со взрывом только на свету:
Если же поджечь струю водорода в атмосфере хлора, то он будет сгорать спокойно бесцветным пламенем (рис. 21).
С водородом бром образует бромистый водород.
Процесс идет при слабом нагревании.
Иод с водородом реагирует только при нагревании с образованием йодистого водорода:
Однако это соединение весьма неустойчивое и легко распадается с образованием водорода и иода. Во всех этих случаях галогены ведут себя как окислители. Галогено-водороды при растворении в воде образуют кислоты.
Окислительные свойства галогенов
Окислительные свойства галогены проявляют и при взаимодействии с металлами, которое протекает обычно очень активно.
Фтор реагирует практически почти со всеми металлами. Легко проследить взаимодействие х л о р а с металлами. Многие металлы в хлоре горят, например сурьма самовоспламеняется (рис. 22). Другие металлы реагируют с хлором при нагревании, например натрий (рис. 23).
2Na + Сl2 = 2NaCl
Если металлы могут иметь различную степень окисления, то при реакции с хлором они обычно проявляют высшую.
Рис. 22. Самовоспламенение сурьмы в хлоре
Примеры реакций галогенов с металлами
Здесь железо в реакции с хлором проявляет степень окисления, равную +3 — Fe +3 , а медь равную +2— Cu +2 . Во всех приведенных случаях хлор ведет себя как окислитель .
Бурно реагирует с металлами и бром. Если насыпать в пробирку с жидким бромом немного алюминиевых опилок, то они сгорают в броме с образованием бромистого алюминия, что сопровождается выделением бурых паров брома и снопом искр. Реакция идет по следующему уравнению:
Опыт производится в приборе, изображенном на рис. 24. Длинная трубка 1 выполняет роль воздушного холодильника. Горят в броме также олово, сурьма, а калий с бромом дает сильный взрыв.
Иод также реагирует с металлами, образуя йодистые соли. Особенно интересно происходит реакция алюминия с иодом. Для этого кристаллы иода растирают в ступке до образования мелкого порошка, а затем на асбестированной сетке смешивают иод с алюминиевой пылью.
Смесь, посуда и материалы должны быть совершенно сухими. Если после этого добавить к смеси каплю воды, которая является катализатором в этом процессе, то смесь воспламеняется и горит, выделяя фиолетовые клубы паров иода
Следует отметить, что иод реагирует с металлами труднее, чем хлор и бром.
В отличие от большинства других простых веществ галогены в непосредственное взаимодействие с кислородом не вступают, так как кислород и галогены обладают близкими значениями электроотрицательности. Вместе с тем кислородные соединения галогенов косвенным путем получены и существуют.
Рис. 23. Горение натрия в хлоре.
1- металлический натрий
2- хлоркальциевая трубка
3- хлор
4- едкий калий
- Докажите путем составления электронного баланса, что в реакциях с водородом и металлами галогены ведут себя как окислители. Обоснуйте такое поведение строением атома галогенов.
- Какой объем хлористого водорода может быть получен при реакции с водородом 20 л хлора? (эта задача решается целиком в объемах).
- 16. Для того чтобы образующийся хлористый водород не был загрязнен хлором, при взаимодействии хлора с водородом последнего берут на 5% больше требуемого количества. Рассчитайте, какой объем водорода следует взять для получения 50 л хлористого водорода. (См. Ответ)
Статья на тему Галогены
Похожие страницы:
Галогены это Элементы фтор, хлор, бром, йод и астат, входящие в VIIA-группу , называют галогенами, что по-гречески означает «солерождающие». Это.
Характеристика галогенов Атомы всех галогенов имеют семь электронов в наружном слое. Поэтому они особенно легко присоединяют по одному электрону, превращаясь в.
Физические свойства галогенов Фтор при обыкновенных условиях — газ, окрашенный в толстых слоях в слабый зеленовато-желтый цвет. При сильном охлаждении.
Галогены в природе это химические элементы которые считаются сильными окислителями, поэтому они встречаются только в соединении с другими химическими веществами.
Почему галогены сильные окислители При повторении подгруппы седьмой группы периодической системы «Галогены», как и последующих групп и подгрупп, целесообразно начинать.
Кристаллические решетки

Кристаллические решетки классифицируют по типу частиц, образующих правильную структуру твердого тела. Если в узлах решетки находятся ионы, связанные между собой прочными кулоновскими силами, ее называют ионной. Атомы, соединенные при помощи ковалентных связей, образуют атомную кристаллическую решетку. Молекулярная решетка состоит из отдельных молекул, связанных между собой слабыми силами Ван-дер-Ваальса. И наконец, если в узлах кристаллической решетки расположены нейтральные атомы и катионы металлов, окруженные «свободными» электронами, то говорят о металлической решетке.
Рис . кристаллическая решетка хлорида натрия
Ионные кристаллические решетки
Электрическое поле иона равномерно распределено в пространстве, поэтому ионная связь характеризуется отсутствием направленности и насыщаемости. Энергетически наиболее выгодно, чтобы каждый ион был окружен наибольшим числом ионов противоположного знака. Но одноименно заряженные ионы отталкиваются, поэтому устойчивыми будут только такие кристаллические решетки, для которых выполняются следующие два условия: разноименные ионы максимально сближены; одинаково заряженные ионы максимально удалены друг от друга.
Радиусы ионов играют основную роль при образовании тех или иных кристаллических форм. Так, если отношение радиуса катиона (rк) к радиусу аниона (rа) превышает 0,73, геометрически легко показать, что каждый ион может быть окружен восемью ионами противоположного знака. При чк: ча=0,41÷0,73 наблюдается октаэдрическая координация: вокруг каждого иона располагаются шесть противоположно заряженных ионов. И наконец, при чк: чак : ча равно 0,52, поэтому катион Na + в кристалле NaCl окружен шестью ионами хлора, а каждый анион Сl — — шестью ионами натрия. За счет равномерного распределения электронной плотности в пространстве все шесть связей оказываются совершенно равноценными. В кристалле хлорида натрия нельзя выделить отдельных ионных молекул Na + Cl — ; его необходимо рассматривать как гигантскую макромолекулу, построенную из равного числа катионов Na + и анионов Сl — (рис.).
Таблица 8 Ионные радиусы галогенов и щелочных металлов
| Катион | Радиус, нм | Анион | Радиус, нм |
| Li + | 0,078 | F — | 0,133 |
| Na + | 0,095 | Сl — | 0,181 |
| К + | 0,133 | Вr — | 0,196 |
| Cs + | 0,165 | I — | 0,220 |
Для хлорида цезия отношение чк:ча равно 0,91. Восемь катионов Cs + занимают вершины куба, в центре которого находится ион хлора.

При обычных условиях ионные соединения представляют собой хрупкие твердые вещества с высокими температурами плавления. Их переход в жидкое состояние происходит обычно с увеличением объема.
Рис.2. Структура алмаза
Ионные кристаллы, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например, в воде. Расположенные на поверхности ионы окружаются молекулами растворителя, отрываются от кристалла и переходят в раствор. Для одного и того же ионного соединения растворимость возрастает с увеличением взаимодействия между молекулами растворителя и соответствующими ионами кристалла, т. е. с увеличением полярности растворителя (табл.9).
Растворимость кристаллических ионных соединений в различных полярных растворителях
(температура 25°С; растворимость выражена в граммах растворенного вещества на 100 г растворителя; е — диэлектрическая проницаемость)
| Соединение | Растворимость в спиртах | ||
| метиловом (ε = 33) | этиловом (ε= 24) | пропиловом (ε= 20) | |
| KI | 90 | 46 | 28 |
| NaCl | 0,53 | 0,02 | 0,00 |
| Sr(NO3)2 | 1,26 | 0,02 | — |
Атомные кристаллические решетки
Атомные кристаллические решетки сформированы за счет ковалентных связей. Взаимная ориентация атомов определяется пространственным строением их электронных подуровней. Например, каждый атом углерода может образовать четыре ковалентные связи, направленные из центра правильного тетраэдра к его вершинам. С этим центральным атомом соединяются четыре атома углерода, находящихся в том же валентном состоянии. У каждого из этих атомов остается по три неспаренных электрона, занимающих три гибридных s р 3 -подуровня, поэтому они образуют связи с тремя другими атомами углерода. Так строится трехмерная кристаллическая решетка алмаза (рис. 2). Чтобы такой кристалл расплавился, необходимо разорвать большую часть ковалентных углерод-углеродных связей, обладающих высокой энергией. Поэтому алмаз плавится при очень высокой температуре (>3500°С) и его невозможно растворить в какой-либо жидкости.
Атомные кристаллы с ковалентными связями являются в большинстве случаев изоляторами, поскольку в них отсутствует как ионная , так и электронная проводимость.
Молекулярные кристаллические решетки
В узлах молекулярной кристаллической решетки находятся молекулы, связанные между собой силами Ван-дер-Ваальса. Такие решетки образуют водород, хлор, азот, оксид углерода (IV) и многие органические соедини. Вследствие небольшой энергии взаимо действия частиц молекулярные кристаллы плавятся при низких температурах и легко растворяются в различных жидкостях (табл. 10).
Молекулы, имеющие разветвленное строение, образует более компактную кристаллическую структуру. Силы Взаимодействия между ними оказываются при этом гораздо выше, чем для не разветвленных молекул. Поэтому соединения с близкой молекулярной массой, но неодинаковым строением имеют различные температуры плавле ния (сравним, например, «-гептан и 2, 2, 3-триметилбу тан в таблице 10).
Взаимодействие между молекулами усиливается также с усложнением строения их электронных оболочек и увеличением полярности. Температуры плавления полярных веществ существенно выше температур плавления неполярных соединений. От полярности молекул сильно зависит растворимость молекулярных кристаллов. Большое значение при этом играет соотношение между размерами полярной и неполярной части молекул. Например, уксусная кислота Н3С—СООН смешивается с водой в любых отношениях, в то время как растворимость стеариновой кислоты составляет при 25°С всего лишь 0,03 г на 100 г Н2О.
Для соединений, молекулы которых имеют полярные группы О—Н, N—Н, S—Н, структура кристаллов определяется в основном энергией водородных связей и характером их расположения в пространстве. Наличием большого числа водородных связей
объясняется, в частности, своеобразная структура льда.
Поскольку каждая молекула воды имеет два атома водорода и две не поделенные пары электронов, она может образовать четыре водородные связи:

В изолированной молекуле воды расстояние между ядрами атомов водорода и кислорода составляет примерно 0, 096 нм, а угол между направлениями связей О — Н равен 105°. В твердом и жидком состояниях параметры молекул Н2О незначительно изменяются. В кристаллической решетке льда вследствие образования водородных связей угол НОН приближается к тетраэдрическому (109,5°), а расстояние между ядрами атомов водорода и кислорода увеличивается до 0,099 нм.
Кристаллы льда принадлежат к гексагональной системе. Каждая молекула воды связана водородными связями с четырьмя другими молекулами. Вследствие относительно большой длины этих связей упаковка молекул Н2О оказывается очень неплотной, в структуре льда на каждые 46 молекул воды приходится шесть пустот диаметром 0,59 нм и две пустоты диаметром 0,52 нм.
За счет включения в полости кристалла молекул хлора, аргона, ксенона и некоторых других газов возникают так называемые клатратные соединения или соединения включения. Их образование с последующим разрушением применяется для разделения углеводородов и некоторых других веществ. Клатраты используют также как удобную форму хранения газов.
Если внедряющиеся молекулы газа сравнительно невелики (Аr, Хе, СН4, СO2), то они занимают все восемь пустот. Образующиеся при этом клатраты имеют состав X•5,75Н2О (8:46= 1:5,75). Более крупные частицы занимает только шесть пустот. Предельное отношение числа внедренных молекул к числу молекул воды составляет в этом случае 6:46=1:7,67. Например, при охлаждении Хлорной воды выпадают кристаллы гидрата хлора, имеющие состав Сl2•8Н2O.
При атмосферном давлении лед плавится при 0°С. С точки зрения молекулярно-кинетической теории плавление льда происходит при такой температуре, когда энергия теплового движения молекул оказывается достаточной для разрыва большинства водородных связей. Тетраэдрическая структура льда разрушается, и вода переходит в жидкое состояние. В жидкой воде существует подвижное равновесие: действие водородных связей воссоздает в каждый момент времени в каждом элементе объема тетраэдрическую структуру льда, а тепловое движение молекул эту структуру разрушает.
Плавление льда сопровождается поглощением тепловой энергии в количестве 6,01 кдж/моль. Большая часть ее расходуется на разрыв водородных связей.
Решетка металлов
Общее число валентных электронов атома металла недостаточно для образования обычных двухэлектронных связей со всеми ближайшими соседями в кристалле. Следовательно, связь атомов металла в кристаллической решетке имеет иную природу, чем ионная или ковалентная. С точки зрения современных представлений металл — это сложная система, состоящая из нейтральных атомов и положительно заряженных ионов, занимающих узлы кристаллической решетки, и «электронного газа», заполняющего межатомное пространство. В одних местах кристалла катионы захватывают электроны из окружающего пространства, превращаясь в нейтральные атомы, в других — атомы металла отдают свои валентные электроны и превращаются в катионы.
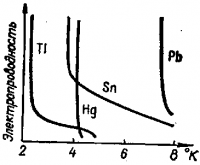
Рис. 5 . Изменение электропроводности металлов вблизи абсолютного нуля
Наличие «свободных» электронов в кристаллической решетке металла было подтверждено экспериментально опытами советских ученых Л. И. Мандельштама и Н. Д. Папалекси, которые наблюдали появление электрического тока при резком торможении вращающегося с большой скоростью куска металла. Ток возникает также при резком ускорении движения металлического тела (эффект Толмена). В последнем случае свободные электроны отбрасываются по инерции к противоположному по движению концу металла.
Одним из важнейших свойств металлов является их электропроводность. При одной и той же температуре одни металлы проводят электрический ток очень хорошо, другие — плохо. Величина электропроводности зависит от общего числа валентных электронов в атоме, степени за полнения отдельных энергетических подуровней и от типа кристаллической решетки:
Относительные значения электропроводности некоторых металлов
| Ag 59,0 | Na 20,8 | К 13,6 | Pt 9,7 | Be 5,2 | V 3,7 |
| Cu 56,9 | Ir 20,6 | Cd 12,6 | Pd 8,7 | Cr 5,1 | Hf 3,2 |
| Au 39,6 | Mo 20,0 | Ru 12,4 | Sn 8,3 | Cs 4,8 | Zr 2,3 |
| Al 36,1 | W 17,5 | Li 11,2 | Rb 7,7 | Nb 4,8 | Ti 2,2 |
| Ca 1,9 | Zn 16,0 | In 10,6 | Tl 6,3 | Pb 4,6 | Ba 1,9 |
| Rh 21,9 | Co 15,3 | Os 10,1 | Та 6,2 | Re 4,5 | Ce 1,2 |
| Mg 21,8 | Ni 13,9 | Fe 9,8 | Th 5,3 | Sr 4,2 | Hg 1,0 |
Для всех металлов характерно более или менее быстрое понижение электропроводности с увеличением температуры. Это объясняется усилением колебательного дви жения катионов и нейтральных атомов в узлах кристаллической решетки, что приводит к замедлению направленного перемещения свободных электронов под действием внешнего электрического поля. Очень интересным оказывается поведение металлов при низких температурах — вблизи абсолютного нуля (-273,16°С). Последовательно увеличиваясь с пониже нием температуры, электропроводность некоторых металлов, например свинца , олова, ртути, неожиданно возрастает практи чески до бесконечности (Рис. 5).
Это явление получило название сверхпроводимости. Оно характерно также для ряда сплавов и соединений металлов: карбидов, нитридов и т. д.
Статья на тему Кристаллические решетки
Содержание статьи1 Внутреннее строение кристаллов1.1 Рентгеновские лучи в изучении строения кристаллов1.2 Различие решетками1.3 Физические свойства кристаллов1.4 Структура солей кристаллов Внутреннее.
Процесс диссоциации Во время зарождения теории электролитической диссоциации атомы еще считались простейшими неделимыми частицами материи. Представление о сложной структуре атомов.
Что такое строение вещества Атомы и молекулы Атомная теория Дальтона Гипотеза Авогадро Теория химического строения Периодический закон и система элементов.
Состав коллоидных частиц Коллоидные растворы отличаются от истинных растворов значительно большими размерами дисперсных частиц. В истинных растворах дисперсными частицами являются.
Простые эфиры Простыми эфирами называются органические соединения, молекулы которых состоят из двух углеводородных радикалов, связанных с атомом кислорода. Примером может.
Содержание статьи1 Кристаллические и аморфные вещества1.1 Кристаллические вещества1.2 Теплопроводность кристаллических веществ1.3 Различие между кристаллическими и аморфными веществами Кристаллические и аморфные.
Читайте также:
