Кристаллическая решетка графита ионная молекулярная атомная или металлическая
Обновлено: 21.09.2024
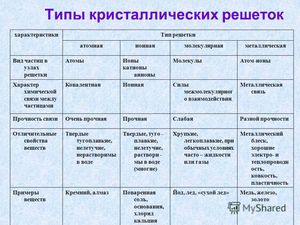
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
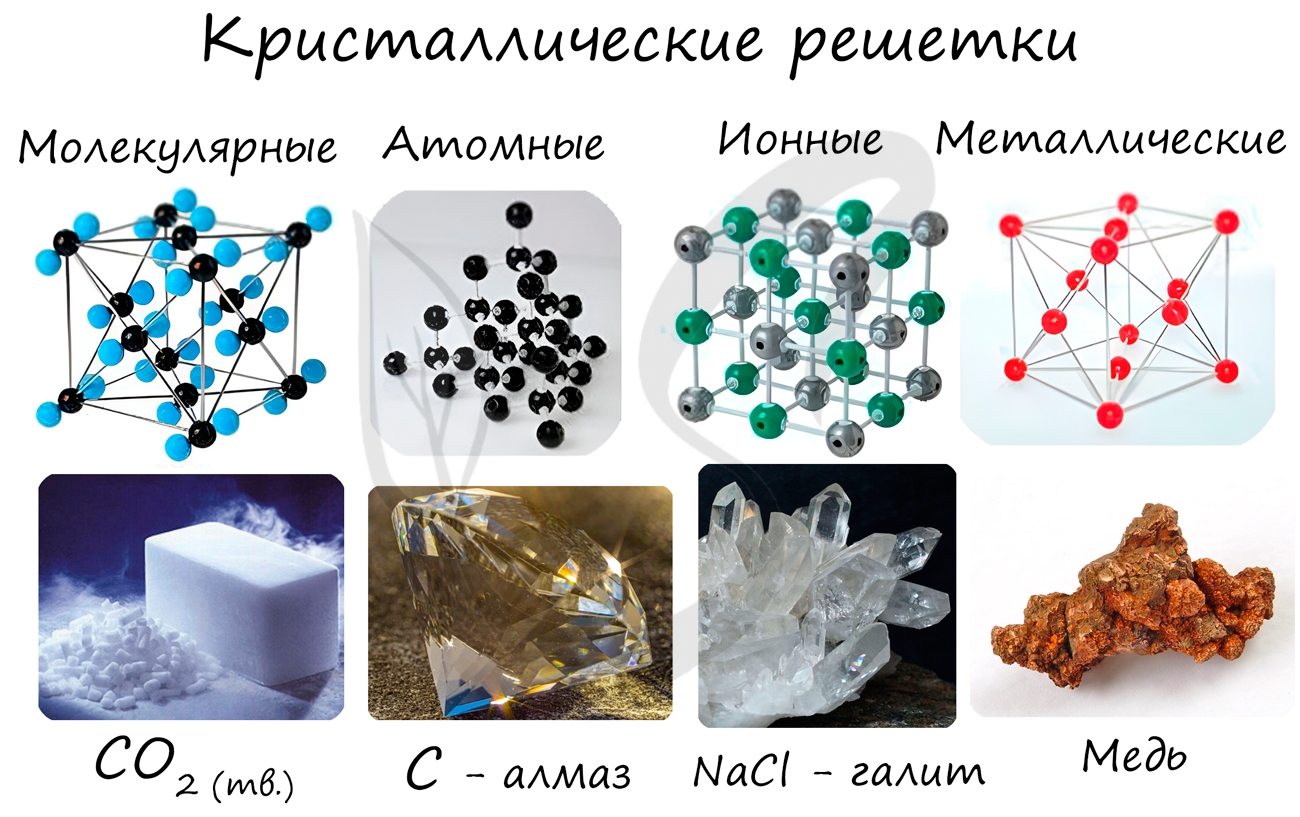
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
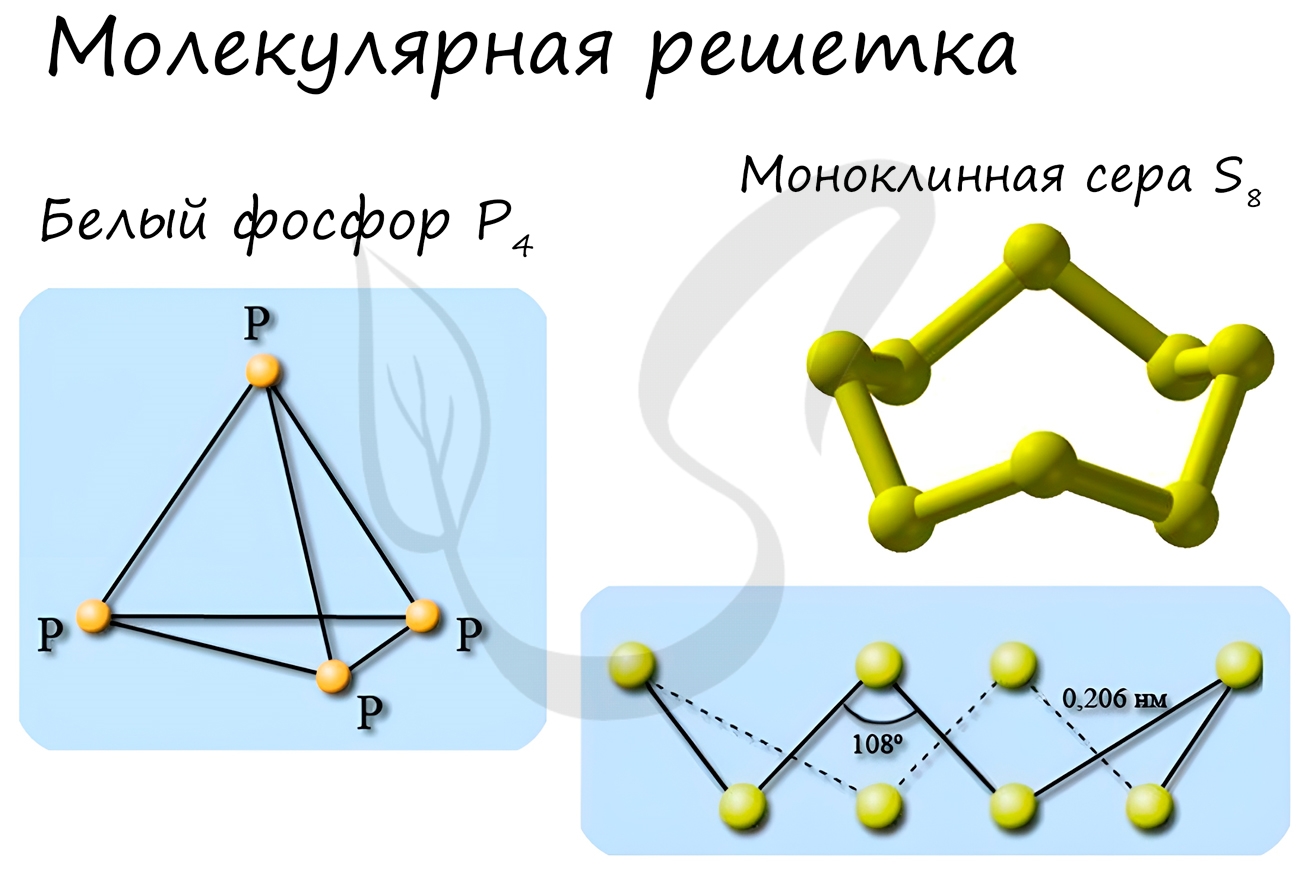
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

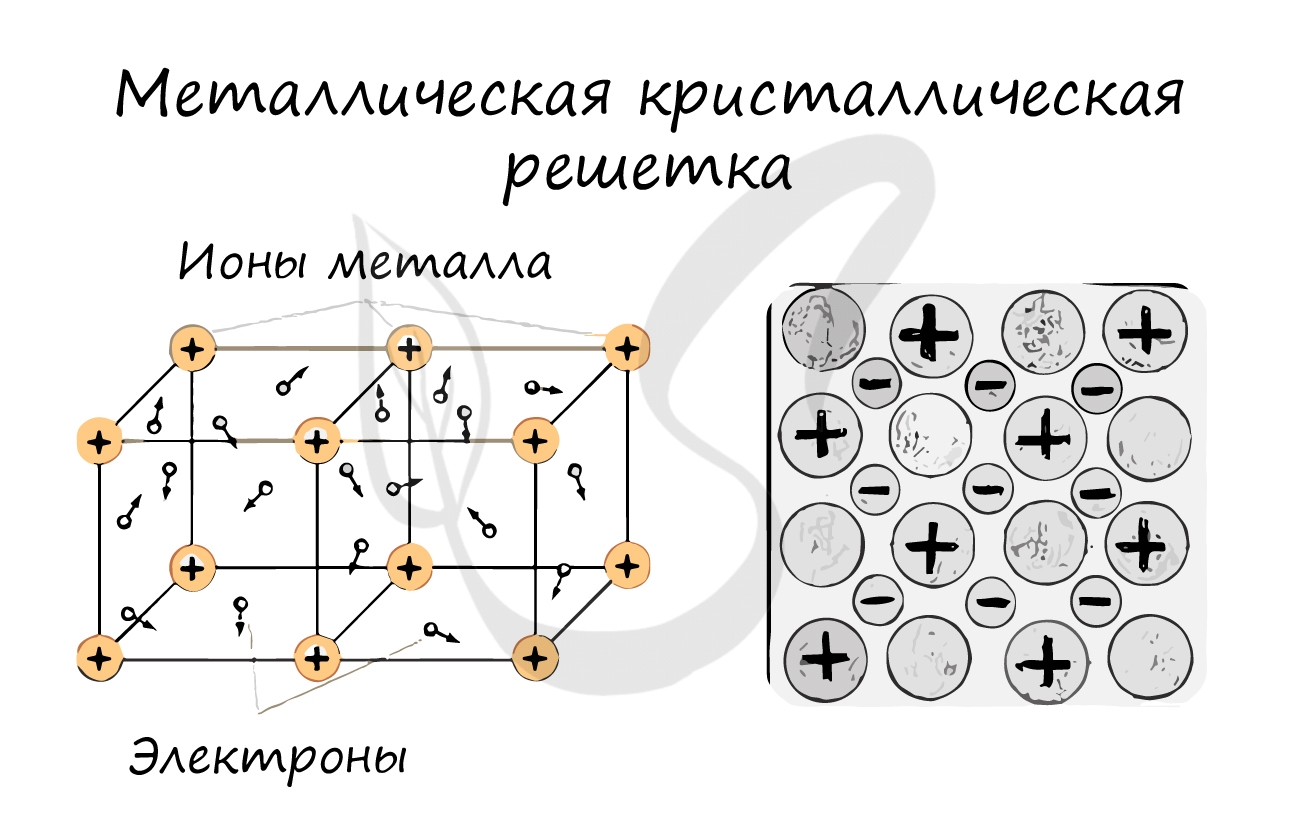
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ГРАФИТ
ГРАФИТ (нем. Graphit, от греч. grapho-пишу), аллотропная модификация углерода, наиб. устойчивая при обычных условиях. Графит-распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию графита. Различают месторождения кристаллич. графита, связанного с магматич. горными породами или кристаллич. сланцами, и скрытокристаллич. графита, образовавшегося при метаморфизме углей. В кристаллич. сланцах содержание графита составляет 3-20%, в магматич. горных породах 3-50%, в углях 60-85%.
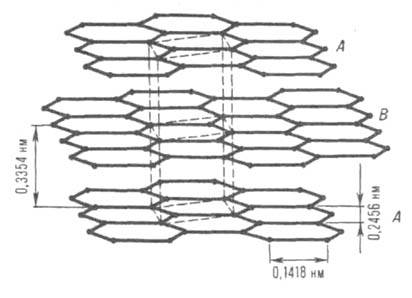
Кристаллическая структура. Кристаллич. решетка графита (рис. 1) гексагональная (а = 0,24612 нм, с = 0,67079 нм, z = 4, пространств. группа C6/mmc, теоретич. плотн. 2,267 г/см 3 ). Состоит из параллельных слоев (базисных плоскостей), образованных правильными шестиугольниками из атомов С. Углеродные атомы каждого слоя расположены против центров шестиугольников, находящихся в соседних слоях (нижнем и верхнем); положение слоев повторяется через один, а каждый слой сдвинут относительно другого в горизонтальном направлении на 0,1418 нм.
Рис. 1. Кристаллическая решетка графита (природного цейлонского). А, В углеродные слои; пунктирными линиями показана элементарная кристаллич. ячейка.
Известна также модификация с ромбоэдрич. решеткой (а = 0,3635 нм,Внутри слоя связи между атомами ковалентные, образованы sр 2 -гибридными орбиталями. Взаимод. между слоями осуществляются ван-дер-ваальсовыми силами. Для природного (цейлонского) графита межслоевое расстояние при нормальных условиях 0,3354 нм. Энергия связи между слоями гексагон. графита составляет 16,75 Дж/моль (15 °С), 15,1 Дж/моль (-134,15°С). Энергия связи С—С в слое 167,6 Дж/моль (1118°С).
В кристаллич. решетке графита могут наблюдаться вздутия, искривления углеродных сеток и дефекты тонкого строения. В результате коагуляции вакансий могут образоваться микрополости диам. до 3 мкм. Объединение отдельных участков этих дефектов приводит к возникновению краевых дислокаций, а также дислокац. петель величиной 0,1-1,0 мкм. Концентрация вакансий в графите увеличивается при его нагревании, напр. при 3650°С она достигает 0,5 атомных %. Дефекты могут возникать и при внедрении в решетку как углеродных атомов, так и гетероатомов (см. Графита соединения).
Свойства. Графит-жирное на ощупь в-во черного или серо-черного цвета с металлич. блеском. Его св-ва зависят от происхождения или способа получения. наиб. правильные кристаллы образует минерал цейлонских месторождений. Искусственно графит получают: нагреванием смеси кокса или каменного угля с пеком (т. наз. ачесоновский графит); термомех. обработкой смеси, содержащей кокс, пек, прир. графит и карбидообразующие элементы (рекристаллизованный графит); пиролизом газообразных углеводородов (пирографит). К разновидностям искусственно полученного графита относят также доменный графит (выделяется при медленном охлаждении больших масс чугуна) и карбидный графит (образуется при термич. разложении карбидов).
При атм. давлении выше 2000 °С графит возгоняется, в парах обнаружены молекулы, содержащие от одного до семи атомов С. При высоких давлениях и нагревании образуется алмаз (рис. 2). Тройная точка (графит-жидкость-пар): т-ра 4130 К, давл. 12 МПа. наиб. плотность (в зависимости от добавки 2,0-5,0 г/см 3 ) имеет рекристаллизованный графит. Ниже приводятся термодинамич. св-ва ачесоновского графита: С°p 8,54 Дж/(моль*К), ур-ние температурной зависимости: С o p = а + bТ- сТ 2 - dT 2 - еТ 3 (288^130 К), где а = 4,824, Ъ = 28,627*10 -3 , с = 3,250*10 5 , d = 13,812*10 -6 , e = 2,276* 10 -9 ; пл 24 Дж/(моль*К); 98 5,74 Дж/(моль*К). Для графита разл. происхожденияВысокая анизотропия св-в монокристаллов графита обусловлена строением его кристаллич. решетки. В направлении базисных плоскостей тепловое расширение графита до 427 °С отрицательно (т.е. графит сжимается), его абс. значение с повышением т-ры уменьшается. Выше 427 °С тепловое расширение становится положительным. Температурный коэф. линейного расширения равен -1,2*10 -6 К -1 (до -73 o С), 0 (427 °С), 0,7*10 -6 К -1 (выше 727°С). В направлении, перпендикулярном базисным плоскостям, тепловое расширение положительно, температурный коэф. линейного расширения практически не зависит от т-ры и превышает более чем в 20 раз среднее абс. значение этого коэф. для базисных плоскостей. Температурный коэф. линейного расширения поликристал-лич. графита очень быстро увеличивается в интервале —100-0 °С, затем рост его замедляется; для наиб. распространенных графитов эти коэф. одинаковы и равны 0,2*10 -8 К -1 в интервале 0-500°С и 0,4*10 -9 К" 1 выше 1000°С.
Для монокристаллов графита отношение значений теплопроводности в направлениях, параллельном и перпендикулярном базисным плоскостям (коэф. анизотропии k), может достигать 5 и более. Теплопроводность [Вт/(м*К)] в направлении базисных плоскостей для графитов: цейлонского 278,4 (k = 3,2), камберлендского 359,6 (k = 6), канадского 522,0 (k = 6), пирографита 475-2435 (k = 100-800). Наивысшей теплопроводностью (большей, чем у Си) обладает рекристаллизованный графит с добавками карбидов Ti и Zr. Теплопроводность искусственно полученного поликристаллич. графита сильно зависит от его плотности и составляет 92,22, 169,94 и 277,44 Вт/(м*К) при плотности соотв. 1,41, 1,65 и 1,73 г/см 3 . На кривой температурной зависимости теплопроводности имеется максимум, положение и величина к-рого зависят от размеров и степени совершенства кристаллов.
Электрич. проводимость монокристаллов графита в направлении, параллельном базисной плоскости ( принимает миним. значение в интервале 0-1000 °С, положение минимума смещается в область низких т-р тем больше, чем совершеннее кристаллич. структура. Наивысшую электрич. проводимость имеет рекристаллизованный графит.
Монокристаллы графита диамагнитны, магн. восприимчивость велика в направлении, перпендикулярном базисным плоскостям ( -22*10 -3 ), и незначительна в параллельном направлении ( -0,5*10 -3 ). Знак коэф. Холла меняется с положительного на отрицательный при 2100°С.
Прочностные св-ва графита изменяются с увеличением т-ры. Для большинства искусств. графитов увеличивается в 1,3-1,6 раза в интервале 2200-2300 °С; модули упругости и сдвига возрастают в 1,3-1,6 раза в интервале 1600-2200 °С. С повышением т-ры до 3000 °С и выше прочностные св-ва довольно резко снижаются и при 3200 °С приближаются к св-вам при 20 °С В интервале 20-2000 °С графит хрупок. В диапазоне 2200-2600 °С наблюдается большая остаточная деформация, достигающая 0,35-1,5% в зависимости от вида графита. Для искусственно полученного поликристаллич. графита 19,6-21,6 МПа,Хорошие антифрикционные св-ва графита обусловлены легкостью скольжения одного углеродного слоя относительно другого под действием малых сдвиговых напряжений в направлении базисных плоскостей. Коэф. трения по металлам (для рабочих скоростей до 10 м/с) составляют 0,03-0,05. Для пирографита под действием напряжений в направлении, перпендикулярном базисным плоскостям, он составляет 0,4-0,5; пирографит м. б. использован в кач-ве фрикционного материала.
После облучения графита нейтронами его физ. св-ва изменяются:Характерная особенность искусственно полученного графита-его пористость, оказывающая существенное влияние практически на все св-ва графита. Объем пор от 2-3% для пирографита до 80-85% для др. видов графитов. Для описания зависимости где Рi и Рoi—св-ва соотв. пористого и непористого графитов, -параметр для i-того св-ва.
Графит весьма инертен при нормальных условиях. Окисляется О2 воздуха до СО2 выше 400°С, СО2-выше 500 °С. Т-ра начала р-ций тем выше, чем совершеннее кристаллич. структура графита. Окисление ускоряется в присут. Fe, V, Na, Cu и др. металлов, замедляется в присут. С12, соед. фосфора и бора. С молекулярным азотом графит практически не реагирует, с атомарным при обычной т-ре образует цианоген C2N2, в присут. Н2 при 800°C-HCN. В условиях тлеющего разряда графит с N2 дает парацианоген (CN)X, где х 2, СО и N2, с Н2 при 300-1000 °С-СН4. Галогены внедряются в кристаллич. решетку графита, давая соед. включения (см. Графита соединения).
С большинством металлов и их оксидов, а также со мн. неметаллами графит дает карбиды. Со всеми щелочными металлами, нек-рыми галогенидами, оксифторидами, галогеноксидами, оксидами и сульфидами металлов образует соед. включения, с нитридами металлов выше 1000 °С- твердые р-ры нитридов и карбидов, с боридами и карбидами-эвтектич. смеси с т-рами плавления 1800-3200°С. Графит стоек к действию к-т, р-ров солей, расплавов фторидов, сульфидов, теллуридов, орг. соед., жидких углеводородов и др., реагирует с р-рами щелочей, жидкими окислителями и рядом хлор- и фторорг. соединений.
Наиб, химически и термически стоек пирографит. Он практически непроницаем для газов и жидкостей, при 600 °С его стойкость к окислению во мн. раз выше, чем у других графитов. В инертной среде пирографит работоспособен при 2000 °С в течение длительного времени.
Получение. Кристаллич. графит извлекают из руд методом флотации, руды скрытокристаллич. графит используют без обогащения.
Исходное сырье для получения графита-нефтяной или метал-лургич. кокс, антрацит и пек. Отдельные частицы исходных углеродных материалов в результате карбонизации при обжиге связываются в монолитное твердое тело, к-рое затем подвергают графитации (кристаллизации). По одному из методов кокс или антрацит измельчают и смешивают с пеком в определенных соотношениях, прессуют при давл. до 250 МПа, а затем подвергают обжигу при 1200°С и графитации при нагр. до 2600-3000 °С. Для уменьшения пористости полученный графит пропитывают синтетич. смолой или жидким пеком, после чего снова подвергают обжигу и графитации. В произ-ве графита повыш. плотности пропитку, обжиг и графитацию повторяют до пяти раз.
Из смеси, содержащей кокс, пек, прир. графит и до 20% тугоплавких карбидообразующих элементов (напр., Ti, Zr, Si, Nb, W, Та, Мо, В), получают рекристаллизованный графит. Исходную шихту нагревают в графитовых прессформах до т-ры, на 100-150 °С превышающей т-ру плавления эвтектич. смеси карбида с углеродом, под давл. 40-50 МПа в течение неск. десятков минут.
Пирографит получают пиролизом газообразных углеводородов с осаждением образовавшегося углерода из газовой фазы на подложку из графита. Осадки имеют кристаллич. структуру разл. степени совершенства - от турбостратной неупорядоченной (пироуглерод) до упорядоченной графитовой (пирографит).
Применение. Графит используют в металлургии для изготовления плавильных тиглей и лодочек, труб, испарителей, кристаллизаторов, футеровочных плит, чехлов для термопар, в кач-ве противопригарной "присыпки" и смазки литейных форм. Он также служит для изготовления электродов и нагревательных элементов электрич. печей, скользящих контактов для электрич. машин, анодов и сеток в ртутных выпрямителях, самосмазывающихся подшипников и колец электромашин (в виде смеси с Al, Mg и Pb под назв. "графаллой"), вкладышей для подшипников скольжения, втулок для поршневых штоков, уплотнительных колец для насосов и компрессоров, как смазка для нагретых частей машин и установок. Его используют в атомной технике в виде блоков, втулок, колец в реакторах, как замедлитель тепловых нейтронов и конструкц. материал (для этих целей применяют чистый графит с содержанием примесей не более 10 -2 % по массе), в ракетной технике - для изготовления сопел ракетных двигателей, деталей внеш. и внутр. теплозащиты и др., в хим. машиностроении - для изготовления теплообменников, трубопроводов, запорной арматуры, деталей центробежных насосов и др. для работы с активными средами. Графит используют также как наполнитель пластмасс (см. Графитопласты), компонент составов для изготовления стержней для карандашей, при получении алмазов. Пирографит наносится в виде покрытия на частицы ядерного топлива. См. также Угле графитовые материалы.
Наиб. кол-во прир. графита добывают в СССР, ЧССР, Южной Корее, Мексике, Австрии, ФРГ, лучшие сорта крупнокристаллич. графита-на Цейлоне и Мадагаскаре. Произ-во графита сосредоточено в промышленно развитых странах (Великобритания, СССР, США, Франция, ФРГ, Япония) и достигает сотен тыс. тонн в год.
===
Исп. литература для статьи «ГРАФИТ» : Веселовский В. С, Угольные и графитовые конструкционные материалы, М., 1966; Шулепов С. В., Физика углеграфитовых материалов, М., 1972; Рекристаллизованный графит, М., 1979; Костиков В. И., Варенков А. Н., Взаимодействие металлических расплавов с углеродными материалами, М., 1981.
Таблица типов кристаллических решёток: йода, алмаза, графита, натрия

Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Это интересно: анионы и катионы в химии, таблица растворимости.
Определение

Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
- атомную;
- ионную;
- молекулярную;
- металлическую.
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Атомный тип
В этом типе в узлах расположены атомы того или иного вещества, которые связаны ковалентными связями. Этот вид связи образован парой электронов двух соседних атомов. Благодаря этому они связываются равномерно и в строгом порядке.
Вещества с атомной кристаллической решёткой характеризуются следующими свойствами: прочность и большая температура плавления. Такой тип связи представлен у алмаза, кремния и бора.
Ионный тип
Противоположно заряженные ионы находятся на узлах, которые создают электромагнитное поле, характеризующее физические свойства вещества. К таковым будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Молекулярный тип
В узлах такого типа находятся ионы, связанные между собой ван-дер-ваальсовыми силами. Благодаря слабым межмолекулярным связям такие вещества, например, лёд, двуокись углерода и парафин, характеризуются пластичностью, электро- и теплопроводностью.
Металлический тип
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
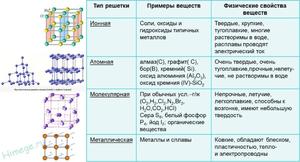
| Виды | Вещества | Свойства |
| Атомная | Алмаз, графит, кремний, бор | Твёрдые, тугоплавкие, не растворяются в воде |
| Молекулярная | Йод, сера, белый фосфор, органические вещества | Нетвёрдые, легко плавятся, летучие |
| Ионная | Соли, оксиды и гидроксиды тяжёлых металлов | Твёрдые, хрупкие, легкоплавкие, электропроводны |
| Металлическая | Металлы и сплавы | Блестящие, ковкие, тепло- и электропроводны. |
Различные вещества
- Алмаз. Минерал обладает высокой ценностью и после огранки используется в ювелирных украшениях. Так в чём же заключается секрет популярности этого камня? Атомы углерода составляют основу всей решётки. Между атомами минерала существует прочная ковалентная связь. Для кристаллической решётки алмаза характерно плотное содержание атомов в виде куба. Другими словами, узлами считаются атомы углерода, а своеобразными гранями куба являются прочные ковалентные связи. Такой минерал считается самым прочным на планете, и неизвестно, сколько таких своеобразных кубов включает в себя цельный алмаз.
- Графит. Углерод также может быть и в другой кристаллической модификации. Атомная решётка данного элемента включает в себя только атомы углерода, ей присуща слоистая структура. В графите каждый атом связан тремя атомами углерода. Из-за этого он обладает металлическим блеском, высокой теплопроводностью.
- Кристаллическая решётка йода имеет молекулярный тип. Атомы молекул соединяются ковалентными связями, но молекулы химического элемента имеют слабые силы притяжения. Это характеризует йод тем, что он имеет малую твёрдость, низкую температуру плавления.
- Натрий. Представитель металлической кристаллической решётки. Между катионами, расположенными в узлах решётки, двигаются электроны. Они, присоединяясь к катионам, нейтрализуют их заряд, в свою очередь, нейтральные атомы отпускают часть электронов, преобразуясь в катионы. Такой тип кристаллической решётки наделяет металл пластичностью, электро- и теплопроводностью.
- Сухой лёд. Или оксид углерода в затвердевшем виде. Имеет молекулярную кристаллическую решётку в форме куба. Молекулы удерживаются между собой слабыми связями. Диффузия читайте в нашей статье.

Графит — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Минерал широко распространен в природе. Обычно встречается в виде единичных чешуек, пластинок и кластеров, различающихся по размеру и содержанию графита. Есть месторождения кристаллического графита, связанные с магматическими породами или кристаллическими сланцами, а также скрытокристаллический графит, образовавшийся во время метаморфизма углей.
- Структура
- Имущество
- Морфология
- Источник
- Заявка
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Агат — цена и лечебно-магические свойства
Физические свойства и структура алмаза
СТРУКТУРА

Полиморфная (аллотропная) гексагональная кристаллическая модификация чистого углерода, наиболее устойчивая в условиях земной коры. Слои кристаллической решетки могут быть расположены по-разному, образуя множество политипов, с симметрией от гексагональной системы (гексагонально-дипирамидальная симметрия) до тригональной (wc ди-тригонально-скаленоэдрической). Кристаллическая решетка графита стратифицированного типа. В слоях атомы C находятся в узлах гексагональных ячеек слоя. Каждый атом C окружен тремя соседями на расстоянии 1,42Α
Существует две модификации графита: α-графит (гексагональный P63 / mmc) и β-графит (ромбоэдрический R (-3) m). Отличаются они упаковкой слоев. В α-графите половина атомов каждого слоя находится выше и ниже центров шестиугольника (набор… ABABAB…), а в β-графите каждый четвертый слой повторяет первый. Ромбоэдрический графит удобно изобразить в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как это метастабильная фаза. Однако в природных графитах содержание ромбоэдрической фазы может достигать 30%. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.
Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
Это интересно: анионы и катионы в химии, таблица растворимости.
СВОЙСТВА

Коэффициент теплопроводности графита от 278,4 до 2435 Вт / (м * К) зависит от марки графита, от направления относительно базисных плоскостей и от температуры.
Электропроводность монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярной — в сотни раз ниже. Минимальное значение проводимости наблюдается в диапазоне 300-1300 К, а положение минимума смещено в низкотемпературную область для идеальных кристаллических структур. Рекристаллизованный графит имеет самую высокую электропроводность.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение уменьшается с повышением температуры. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положительный, практически не зависит от температуры и более чем в 20 раз превышает абсолютное среднее значение для базальных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и высока в ортогональных базисных плоскостях. Коэффициент Холла изменяется с положительного на отрицательный при 2400 К.
Графит атомная кристаллическая решетка какая
В приведённой ниже таблице перечислены характерные свойства веществ с атомной и ионной кристаллическими решётками.
Характерные свойства веществ
— твёрдые при обычных условиях;
— в расплавах и растворах проводят электрический ток
| С атомной кристаллической решёткой | С ионной кристаллической решёткой |
Используя данную информацию, определите, какую кристаллическую решётку имеет:
1) хлорид кальция
Запишите ответ в отведённом месте:
1) Хлорид кальция имеет
Хлорид кальция — вещество с ионной химической связью, тугоплавкое (Т пл = 772 °C), проводит электрический ток — имеет ионную кристаллическую решётку.
Графит — вещество с ковалентной неполярной химической связью, нелетучее, твёрдое — имеет атомную кристаллическую решётку.
Ответ: Хлорид кальция — ионная кристаллическая решётка, графит — атомная кристаллическая решётка.
МОРФОЛОГИЯ

Хорошо сформированные кристаллы встречаются редко. Кристаллы пластинчатые, чешуйчатые, изогнутые, обычно несовершенной пластинчатой формы. Чаще всего это листья без кристаллографических очертаний и их агрегаты. Образует сплошные радиально-радиальные агрегаты скрытокристаллические, листовые или округлые, реже — сферулитовые агрегаты концентрически-зонального строения. В крупнокристаллических осадках часто наблюдается треугольная штриховка на плоскостях (0001).
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
ПРОИСХОЖДЕНИЕ

Он образуется при высоких температурах в вулканических и магматических породах, пегматитах и скарнах. Он встречается в кварцевых жилах с вольфрамитом и другими минералами в среднетемпературных гидротермальных полиметаллических месторождениях. Распространен в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные месторождения образуются в результате пиролиза угля под воздействием ловушек на угольных месторождениях (Тунгусский бассейн). Акцессорный минерал метеоритов. Попутные минералы: кварц, пирит, гранаты, шпинель.
Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
ПРИМЕНЕНИЕ

Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой термостойкости графита (в отсутствие кислорода), его химической стойкости к ряду расплавленных металлов. Он используется в электродах, в нагревательных элементах, благодаря своей высокой электропроводности и химической стойкости практически ко всем агрессивным водным растворам (намного выше, чем у драгоценных металлов). Для производства химически активных металлов электролизом расплавов, твердых смазок, комбинированных жидких и пастообразных смазок, пластиковых наполнителей.
это замедлитель нейтронов в ядерных реакторах, компонент композиции для изготовления стержней с черным графитом (в смеси с каолином). Он используется для получения синтетических алмазов в качестве эталона длины нанометрового диапазона для калибровки сканеров микроскопа с туннельным эффектом и атомно-силового микроскопа, для изготовления контактных щеток и токосъемников для различных электрических машин электромобили и мостовые краны с тележкой, мощные реостаты и другие устройства, где требуется надежный мобильный электрический контакт для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических кораблей.
| Молекулярная масса | 12,01 г / моль |
| Происхождение названия | от древнегреческого. — пиши, пиши |
| Статус IMA | действителен, впервые описан до 1959 г. (до IMA) |
Описание графита:
Графит широко распространен в природе как минерал. Он встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию.
Природный графит по своему химическому составу не отличается чистотой. В большом количестве (до 10-25%) в нем присутствует зола, состоящая из разных составляющих (Fe2O3, SiO2, Аl2O3, MgO, Р2О5, CuO, СаО и др.), газы (до 2%) и битумы, иногда вода.
Также графит получается искусственным путем различными способами. Например, нагреванием смеси кокса и пека до 2 800 °C.
ФИЗИЧЕСКИЕ СВОЙСТВА
| Минеральный цвет | железо черное превращается в стальную серую |
| Цвет линии | черный становится стальным серым |
| Прозрачность | непрозрачный |
| Светить | полуметаллический |
| Декольте | очень хорошо на |
| Твердость (шкала Мооса) | 1-2 |
| Расставаться | как слюда |
| Власть | гибкий |
| Плотность (измеренная) | 2,09 — 2,23 г / см3 |
| Радиоактивность (GRApi) | 0 |
Типы и марки графита:
В соответствии с ГОСТ 17022-81 «Графит. Типы, марки и общие технические требования» выделяют следующие минералогические типы графита:
Этим же ГОСТом предусмотрены следующие марки графита: ГСМ-1, ГСМ-2, ГАК-1, ГАК-2, ГАК-3, ГК-1, ГК-2, ГК-3, ГС-1, ГС-2, ГС-3, ГС-4, П, ЭУЗ-М, ЭУЗ-II, ЭУЗ-III, ЭУТ-I, ЭУТ-II, ЭУТ-III, ГТ-1, ГТ-2, ГТ-3, ГЭ-1, ГЭ-2, ГЭ-3, ГЭ-4, ГЛ-1, ГЛ-2, ГЛ-3, ЭУН, ГЛС-1, ГЛС-2, ГЛС-3, ГЛС-4.
Им соответствуют следующие виды использования (потребления) графита:
– графит специальный малозольный,
– графит кристаллический электроугольный,
– графит кристаллический литейный,
– графит скрытокристаллический электроугольный,
– графит скрытокристаллический литейный.
Лечебное влияние
Первыми оценили графит гомеопаты. Они установили, что минерал подходит для лечения кожных патологий (экземы, псориаз, лишай, другие).
Сегодня список расширен:
- Нарушение обмена веществ.
- Сбой в работе щитовидной железы.
- Заболевания дыхательных путей (ринит, бронхиальная астма).
- Проблемы ЖКТ (гастрит, язва желудка, 12-перстной кишки, колиты).
- Женские недуги (аменорея, хроническое воспаление яичников, мастопатия).
- Конъюнктивит, катаракта, ячмень.
Минерал «курирует» также эмоциональное здоровье. Его прописывают при утренней головной боли, неврастении, апатии, депрессии.
Кристаллическая решетка и структура графита
Графит (от др.-греч. γράφω — пишу) – это природный материал, относящийся к классу самородных элементов, аллотропная модификация углерода. Он имеет слоистую структуру. Каждый слой кристаллической решетки графита может по-разному располагаться по отношению друг к другу, образуя политипы.

Графит находит свое применение в производственной и промышленной деятельности. Графитовые изделия отличаются повышенными эксплуатационными характеристиками. Графит устойчив к химическим и природным воздействиям, он достаточно прочный, хорошо проводит электрический ток, отличается низкой твердостью, относительной мягкостью, после воздействия высоких температур затвердевает.
Плотность составляет 2.23 г/см 3 . Графит имеет металлический блеск и темно-серый цвет. Теплопроводность этого минерала достаточно большая, поэтому его используют для изготовления комплектующих деталей электрооборудования.
Различают месторождения кристаллического графита, связанного с магматическими горными породами или кристаллическими сланцами, и скрытокристаллического графита, образовавшегося при метаморфизме углей.
Структура графита

Гексагональная кристаллическая полиморфная (аллотропная) модификация чистого углерода, наиболее устойчивая в условиях земной коры.
Слои кристаллической решетки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный вид симметрии), до тригональной (дитригонально-скаленоэдрический в.с.). Кристаллическая решетка графита — слоистого типа.
В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1,42Α
Различают две модификации графита: α-графит (гексагональный P63/mmc) и β-графит (ромбоэдрический R(-3)m). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка …АВАВАВА…), а у β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как является метастабильной фазой. Однако, в природных графитах содержание ромбоэдрической фазы может достигать 30 %. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.

Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1 по шкале Мооса). Относительно мягкий. После воздействия высоких температур становится немного твёрже, и становится очень хрупким. Плотность 2,08—2,23 г/см³.
Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Теплопроводность графита от 278,4 до 2435 Вт/(м*К), зависит от марки графита, от направления относительно базисных плоскостей и от температуры.
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном — в сотни раз меньше.
Минимальное значение проводимости наблюдается в интервале 300—1300 К, причём положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным.
В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и велика в ортогональных базисным плоскостях. Коэффициента Холла меняется с положительного на отрицательный при 2400 К.

Хорошо образованные кристаллы редки. Кристаллы пластинчатые, чешуйчатые, кривогранные, обычно имеют пластинчатую несовершенную форму. Чаще бывает представлен листочками без кристаллографических очертаний и их агрегатами.
Образует сплошные скрытокристаллические, листоватые или округлые радиально-лучистые агрегаты, реже — сферолитовые агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто наблюдается треугольная штриховка на плоскостях (0001).

Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях.
Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). Акцессорный минерал метеоритов. Сопутствующие минералы: кварц, пирит, гранаты, шпинель.

Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов.
Применяется в электродах, нагревательных элементах — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
Для получения химически активных металлов методом электролиза расплавленных соединений, твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках, наполнитель пластмасс.
Является замедлителем нейтронов в ядерных реакторах, компонентом состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином).
Используется для получения синтетических алмазов, в качестве эталона длины нанометрового диапазона для калибровки сканеров сканирующего туннельного микроскопа и атомно-силового микроскопа, для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов.
А также прочих устройств, где требуется надёжный подвижный электрический контакт, для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических аппаратов.
Читайте также:
