Кристаллическая решетка щелочных металлов
Обновлено: 18.05.2024

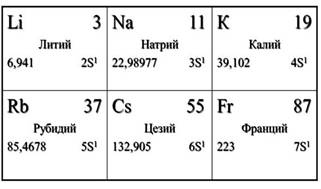
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
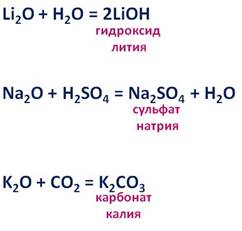
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
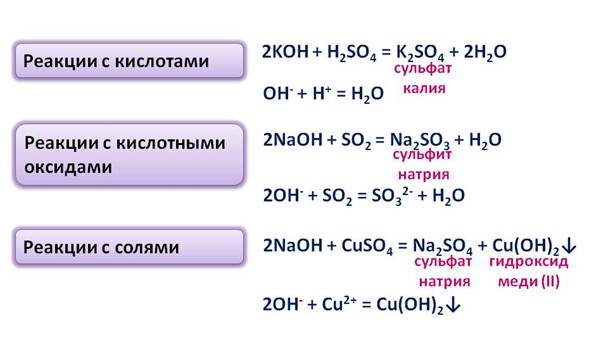
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Кристаллическая решетка щелочных металлов

Щелочные металлы. Элементы IA-группы
Ключевые слова конспекта: щелочные металлы, элементы IA-группы, литий, натрий, цезий, калий, рубидий, надпероксиды, пероксид натрия, щелочи, получение и применение щелочных металлов.
Щелочными металлами называют элементы IA-группы Периодической системы. Групповое название «щелочные» обусловлено тем, что растворимые в воде гидроксиды натрия и калия известны с древних времён, их называли щелочами. Важнейшие параметры этих элементов приведены в таблице.

Вы видите, как меняются свойства элементов в подгруппе: от лития к цезию радиусы атомов увеличиваются, значения энергии ионизации и электроотрицательности уменьшаются, металлические свойства усиливаются.
Электронная конфигурация валентного электронного слоя атомов щелочных металлов ns 1 , где n – номер валентного энергетического уровня. Щелочные металлы являются s-элементами.
В соединениях щелочных металлов преобладает ионный характер связи. В своих соединениях щелочные металлы могут быть только одновалентны. Во всех своих соединениях щелочные металлы имеют степень окисления +1.
Высшими оксидами являются соединения состава Ме2O, они имеют ярко выраженный основный характер. Высшие гидроксиды щелочных металлов МеОН – типичные основания, щёлочи. Водородные соединения щелочных металлов – твёрдые гидриды состава МеН.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
Щелочные металлы – вещества немолекулярного строения, их кристаллическая решётка металлическая.
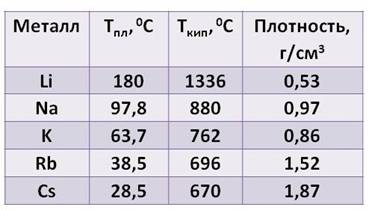
При обычных условиях щелочные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро тускнеют вследствие окисления), лёгкие (литий – самый лёгкий металл, его плотность составляет 0,53 г/см 3 ), легкоплавкие, мягкие (легко режутся ножом).
При внесении щелочных металлов или их соединений в бесцветное пламя оно приобретает характерную окраску:
Элемент
Окраска пламени
Li
Rb
Na
Cs
К
Щелочные металлы являются активными восстановителями. В атмосфере хлора и фтора они воспламеняются при обычных условиях.
Взаимодействие щелочных металлов с жидким бромом сопровождается взрывом.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде, но только при сгорании лития образуется оксид: При сгорании натрия обычно образуется пероксид (Na2O2):Пероксид натрия Na2O2 – кристаллы светло-жёлтого цвета – можно рассматривать как соль пероксида водорода H2O2.
При сгорании остальных щелочных металлов образуются надпероксиды (например, КO2). Получить оксиды Na2О, К2O, Rb2O, Cs2O можно восстановлением пероксидов и надпероксидов щелочными металлами, например, по реакции: КO2 + 3К = 2К2O
Щелочные металлы взаимодействуют с серой при нагревании.
Литий – единственный металл, который реагирует с азотом с образованием нитрида уже при комнатной температуре:Остальные щелочные металлы с азотом не реагируют (натрий реагирует с азотом при 100 °С, при электрическом разряде).
При нагревании щелочные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Щелочные металлы активно взаимодействуют с водой с образованием щёлочи и водорода. При этом кусочек лития или натрия с шипением «бегает» по поверхности воды, при взаимодействии калия происходит возгорание выделяющегося водорода (бледно-фиолетовое пламя), рубидий и цезий взаимодействуют со взрывом:
Щелочные металлы активно реагируют с разбавленными кислотами с образованием соли и водорода, но при этом параллельно протекают реакции щелочного металла с водой и образовавшейся щёлочи с кислотой.

Иначе протекают реакции с концентрированными растворами кислот или с самими кислотами – сильными окислителями, например с азотной и серной. В этих реакциях происходит восстановление азота в высшей степени окисления (в HNO3) или серы в высшей степени окисления (в H2SO4). Образуется соль, продукт восстановления азота или серы и вода:
Щелочные металлы активно взаимодействуют с растворами солей, но при этом происходит не замещение металла, входящего в состав соли, щелочным металлом, а прежде всего взаимодействие щелочного металла с водой раствора.
Натрий получают электролизом расплава поваренной соли (с добавками СаCl2 для понижения температуры плавления смеси):Щелочные металлы находят широкое применение в промышленности и в технике:
- литий – в литий-ионных аккумуляторах, в термоядерной энергетике для получения изотопа водорода – трития, а также в качестве теплоносителя в ядерных реакторах;
- натрий используют как теплоноситель в ядерных реакторах, для синтеза некоторых органических соединений (например, как катализатор в синтезе каучука, как активный восстановитель в других реакциях, часто в сплаве с калием), в металлотермии (натрийтермия);
- цезий легко теряет электроны даже под действием света, поэтому он применяется в фотоэлементах.
Наиболее распространёнными соединениями щелочных металлов являются (приведены исторические названия):
NaOH – едкий натр (каустическая сода),
NaCl – поваренная соль,
NaNO3 – чилийская селитра,
Na2SO4 • 10H2O – глауберова соль,
Na2CO3 • 10H2O – сода кристаллическая,
КОН – едкое кали,
КCl – хлорид калия, входит в состав калийной соли (NaCl • КCl + КCl),
KNO3 – индийская селитра,
К2СO3 – поташ.
Конспект урока по химии «Щелочные металлы. Элементы IA-группы». Выберите дальнейшее действие:
Кристаллическое строение металлов. Кристаллическая решетка металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Что такое щелочные металлы?
У щелочных металлов электронная конфигурация внешнего энергетического уровня : ns1, на внешнем энергетическом уровне находится 1 s-электрон.
Типичная степень окисления щелочных металлов в соединениях +1.
Располагаются сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1.
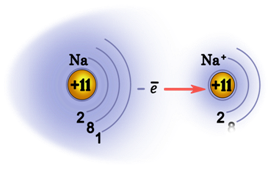
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства.
Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — самый низкий) и электроотрицательности (ЭО).
Однозарядные катионы
В большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.
Однако существуют и соединения, где щелочные металлы представлены анионами (см. Алкалиды).
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.

Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
атомные и физические свойства щелочных металлов
Радиоактивные изотопы: 40K, T1/2 = 1,277·109 лет; 87Rb, T1/2 = 4,75·1010 лет; 223Fr, T1/2 = 21,8 мин; 224Fr, T1/2 = 3,33 мин.
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Многие минералы содержат в своём составе щелочные металлы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl·KCl, карналлит KCl·MgCl2·6H2O, полигалит K2SO4·MgSO4·CaSO4·2H2O.
Химические свойства щелочных металлов Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
Признаки
Все 14 видов элементарных ячеек обладают общими свойствами:
- они являются простейшими повторяющимися структурами в кристалле;
- каждый центр решетки состоит из одной частицы, называемый узлом решетки;
- узлы ячейки соединяются между собой прямыми, которые формируют геометрию кристалла;
- противоположные грани параллельны;
- симметрия элементарной структуры соответствует симметрии всей кристаллической решетки.
При выборе структуры элементарной ячейки руководствуются некоторыми правилами. У нее должны быть:
- наименьший объем и площадь;
- наибольшее количество одинаковых ребер и углов между ними;
- прямые углы (по возможности);
- пространственная симметрия, отражающая симметрию всей кристаллической решетки.
Взаимодействие с кислородом
Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава: <\mathsf <4\ Li+\ O_\longrightarrow 2\ Li_O)) При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2: <\mathsf <2\ Na+\ O_\longrightarrow \ Na_O_ <2))>В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: <\mathsf
<\mathsf <2\ Na+2\ NaOH\longrightarrow 2\ Na_O+\ H_\uparrow )) <\mathsf <2\ Na+\ Na_O_\longrightarrow 2\ Na_O)) <\mathsf <3\ K+\ KO_\longrightarrow 2\ K_O)) Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О2− 2 и надпероксид-ион O− 2.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой увеличивается в ряду от Li до Cs:
Таблица формула
| Формула кислородного соединения | Цвет |
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
<\mathsf <\mathsf Четырнадцать вариантов строения решетки принято объединять в три основных типа. Они следующие: Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов: <\mathsf <2\ Na+\ H_<2>\longrightarrow 2\ NaH)) <\mathsf <2\ Na+\ Cl_<2>\longrightarrow 2\ NaCl)) <\mathsf <2\ K+\ S\longrightarrow \ K_<2>S)) <\mathsf <6\ Li+\ N_<2>\longrightarrow 2\ Li_N)) <\mathsf <2\ Li+2\ C\longrightarrow \ Li_<2>C_ <2))>При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) щелочные металлы реагируют с кислотами. Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах: <\mathsf <2\ Na+2\ NH_<3>\longrightarrow 2\ NaNH_+\ H_\uparrow )) При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака: <\mathsf <\mathsf <2\ Na+2\ CH_CH_OH\longrightarrow 2\ CH_CH_ONa+\ H_\uparrow )) <\mathsf <2\ Na+2\ CH_COOH\longrightarrow 2\ CH_COONa+\ H_\uparrow )) Качественное определение щелочных металлов Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет: Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы: <\mathsf <2\ LiCl\longrightarrow 2\ Li+\ Cl_<2>\uparrow )) катод: +e\longrightarrow <\mathsf <\mathsf <4\ NaOH\longrightarrow 4\ Na+2\ H_O+\ O_\uparrow )) катод: +e\longrightarrow <\mathsf <\mathsf <2\ MCl+\ Ca\longrightarrow 2\ M\uparrow +\ CaCl_<2))>Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка. Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из водных растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород. Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли: Сегодня основным добытчиком золота является государство, которое добывает металл промышленным методом. В России первый самородок, а в последствии и рудник был найден в 1745 году. Сегодня добычей золота в России занимаются 16 компаний. Добыча ведется на территории Чукотки, Магаданской области, в Амурской и Иркутской области, в Хабаровском и Красноярском крае, в Челябинске. Самыми крупными золотодобывающими странами являются Китай, Россия и Австралия. Так процесс золотодобычи сложный и дорогостоящий, специалисты постоянно работают над его удешевлением. Наиболее распространенный способ – закрытие нерентабельных мест добычи. За все время человечеством добыто около 170 тонн драгоценного металла. <\mathsf Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами: Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду: <\mathsf <2\ LiOH\longrightarrow \ Li_O+\ H_O)) Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола. Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26—30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой: <\mathsf <\mathsf <2\ NH_<4>Cl+\ Ca(OH)_\longrightarrow 2\ NH_\uparrow +\ CaCl_+2\ H_O)) Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение. При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия: <\mathsf <2\ NaHCO_\longrightarrow \ Na_CO_+\ CO_\uparrow +\ H_O)) Основной потребитель соды — стекольная промышленность. В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия: <\mathsf <2\ KOH+\ CO_\longrightarrow \ K_CO_+\ H_O)) Поташ используют в производстве стекла и жидкого мыла. Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO− 3. Все щелочные металлы проявляют высокую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями. Особенно опасны взаимодействия с водой, так как продуктами реакций являются едкие щёлочи, а также происходит огромное выделение энергии, сопровождаемое огненной вспышкой (в случае с калием) или взрывом (в случае с рубидием или цезием). Поэтому необходимо соблюдать правила безопасности при работе с ними. Работа должна проводиться исключительно в перчатках из латекса, также необходимо надевать защитные очки. В экспериментах используют только небольшие количества, манипуляции с которыми производят при помощи щипцов; в случае непрореагировавших остатков щелочных металлов (например, натрия или калия), применяют утилизацию в обезвоженном спирте. Рубидий и цезий ввиду чрезвычайно высокой химической активности (взрывоопасные) практически не применяют в опытах. Элементарная ячейка называется примитивной, если ее частицы находятся только в вершинах решетки и отсутствуют в других местах. Ее объем является минимальным по сравнению с другими типами. На практике она оказывается часто низкосимметричной (примером может служить ячейка Вигнера-Зейтца). У не примитивных ячеек атом в центре объема делит их на 2 или на 4 одинаковые части. В гранецентрированной структуре происходит разделение на 8 частей. В металлографии пользуются понятием элементарной, а не примитивной ячейки, так как симметрия первой позволяет более полноценно описать кристаллическую структуру материала. Данный видеофрагмент основывается на изучении щелочных металлов. Профессор Колбочкин рассказывает о строении и свойствах атомов элементов IA группы, физических и химических свойствах щелочных металлов, а также о соединениях этих металлов, об истории открытия лития, натрия и калия. Кроме соответствующих уравнений химических реакций, здесь есть пример решения задачи. Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге. Щелочные металлы Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного. Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом. Теперь рассмотрим строение и свойства атомов элементов I A группы. Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1. Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы. Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов. Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом. Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов. Из таблицы видно: · плотность их увеличивается от лития к цезию · температура плавления, в отличие от плотности, уменьшается от лития к цезию · температура кипения тоже уменьшается от лития к цезию. Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела. С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам. Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют. В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1. В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании. В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1. С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1. С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2. Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода. Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха. Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород. Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются. Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород. Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор. Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений. Познакомимся с некоторыми из них. Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами. Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия. Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1. Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе. Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты. Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами. Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода. В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода. В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия. Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия. Рассморим свойства и применения соединений щелочных металлов. Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами. Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла. Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой. Рассмотрим наиболее значимые соли. Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках. Питьевую соду – NaHCO3 используют в быту и пищевой промышленности, а также в медицине. Поташ, или карбонат калия – K2CO3 используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла. Кристаллогидрат сульфата натрия, или глауберова соль – Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства. Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли. Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион. Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия. В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны. Кроме этого, калий поддерживает работу сердечной мышцы. Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах. Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия? В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги. Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г. Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги. Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит: · к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне · отмиранию листьев растений · повышению восприимчивости к грибковых и бактериальным заболеваниям · снижению всхожести семян. Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия. Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый. Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет. Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет. Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне. Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь. Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1. Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами . Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве. Читайте также:Типы кристаллических решеток

Взаимодействие с другими веществами
Окраска пламени щелочными металлами и их соединениями
Щелочной металл Цвет пламени Li Карминно-красный Na Жёлтый K Фиолетовый Rb Буро-красный Cs Фиолетово-красный Получение щелочных металлов
Электролиз расплавов галогенидов
Соединения щелочных металлов
Гидроксиды
Добыча золота

Прежде щёлочь получали реакцией обмена:
Безопасность
Примитивная ячейка
Щелочные металлы


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Получите невероятные возможности



Конспект урока "Щелочные металлы"