Критическая температура металла это
Обновлено: 12.05.2024
Критические точки – это значения температуры, в результате которых меняются физические и химические свойства стального сплава.
Обозначаются такие показатели буквой А. В нижнем значении точки на графике на прямой PSK сталь имеет состояние «железо-углерод». Называют такую точку – А1, именно при этом значении аустенит превращается в перлит в процессе охлаждения материала, и перлит в аустенит при нагревании сплава. В верхней части диаграммы критическим значением является значение Аз. Для доэвтектоидных сплавов из стали Аз находится на прямой GS. При такой величине происходит выделение феррита во время процесса охлаждения железа и прекращение его растворения при нагревании. Точка Аз для заэвтектоидных стальных сплавов находится на прямой SE. При такой величине происходит выделение вторичного цементита в процессе охлаждения стального материала, и прекращается растворение при повышении температурного режима.
Обозначение критических точек при нагревании отличается от критических точек снижения температуры маленькой буквой «с» и буквой «r» соответственно, так как «с» означает «chauffage» (в переводе с французского – нагревание), а «r» - «refroidissement» (перевод – охлаждение). Также в аббревиатуре присутствует цифровое значение, характеризующее данные изменения.
Таким образом Ar1 обозначает точку, при которой аустенит превращается в перлит, а в точке Ac1 наоборот - перлит в аустенит. Величина Ar3 соответствует процессу выделения феррита в аустенит, а окончание растворения феррита в аустените – точка Ac3. Также Ar3 означает начало процесса выделения цементита из аустенита, а также точка Ac3 – конец растворения. Кроме того, при нагревании доэвтектоидного сплава выше значения линии GS (Точка А3) нередко обозначают, как точку A cm.
Аббревиатура Mn является точкой, при которой на графике начинается мартенситное превращение.
Изменение состояния стали в критических точках
Критические точки при термообработках, как правило, необходимы для определения температурных режимов требуемых для закалки стали.
Линия to tn это значения при нагреве от начального охлажденного состояния точки to до плавления в точке tn. Если из мягкого стального сплава, который находится в охлажденном состоянии при сгибании и разгибании не образует трещин, увеличим до значения температуры t1 и подвергнуть изгибу, то при таком температурном режиме он способен потерять вязкость и может поломаться. Такая температура является температурой синей побежалости (или Побежалости стали), равной примерно 375 0 С обозначается буквой К, такое состояние стали называется синеломкость. Если и далее продолжить подогрев, и температура при этом станет выше t1, то материал вновь станет вязким и гибким, и деталь будет постепенно удлиняться, а температура ее правильно повышаться. При дальнейшем нагревании не больше температуры t2, если быстро охладить материал, он совсем не примет закалки.
Как только температурный режим повысится до значения точки t2, сталь перестает удлиняться, температура не повышается и даже начинает постепенно понижаться. Если медленно охлаждать деталь из стали, которая была раскалена не выше температуры точки t2, брусок, в температурном режиме в точке t2, прекращает укорачиваться, а температура его не только не понижается, но, даже не смотря ни на что, начинает повышаться и сталь становится светлее. Такая критическая точка может меняться в зависимости от твёрдости стали. Температура критических точек при этом варьируется от 580 до 680 градусов, а называют такое явление рекалесценцией, само нагревом либо бликованием. В этих критических точках у стального сплава происходят химические изменения. При нагреве стального материала с карбидом в точке t2 происходит распад с выделением углерода, с растворением в железной массе. Если медленно охлаждать материал, то в t2 происходит соединение углерода и стали в карбид. При этом в первом случае происходят процессы, связанные с поглощением тепла, а во втором ее выделение.
Критическую точку t2 в семидесятых годах заметил ученый Д. К. Чернов, который предложил определять её значение в следующем виде: стальной материал при нагревании ниже данного значения, не способен закаливаться. Критические точки представляют собой температурные режимы, способные изменять фазовые состояния и структуру сплава путем нагревания или охлаждения детали. Если и дальше подогревать стальной материал, но не выше температурного значения t3, сталь, несмотря на то, что способна принимать закалку, не будет менять свою структуру при медленном или быстром понижении температурного режима, и останется такой же, что и была до нагревания. При повышении температуры до значений Чернова с температурой t3, происходит быстрая перегруппировка, так как охлажденный материал изменяет свое структурное состояние из крупного в мелкозернистое. Такая температура позволяет добиться того, что размягчённые зёрна стального сплава крепко соединяются и превращаются воскообразный материал с аморфным сложением, который при понижении температуры ниже значения t3 не меняется. Медленное охлаждение детали, нагретой выше температурного режима точки t3, вызывает вновь распадение стального материала на зёрна, а сама кристаллизация зависит от дальнейшего изменения температурного режима дальше от точки t3 справа и от временного промежутка, который прошел до её понижения до критического значения t3. Такой процесс кристаллизации можно прекратить путем быстрого охлаждения детали до температуры критических точек ниже t3, то есть до точек, где уже не происходит процесс кристаллизации. Таким образом, критические точки при значении t3 означают границу, при которой заканчивается процесс кристаллизация при охлаждении раскалённого стального сплава. Эта критическая точка имеет значение от 700 до 800 градусов цельсия, что зависит от состава стального сплава и от содержания частиц углерода.
Помимо всех перечисленных выше явлений, по новым результатам исследований Осмонда, в такой точке происходит превращение стали из одного состояния в другое.
Благодаря исследованиям в области плавления сплавов, было выявлено, что в незакаленном или хорошо отожжённом стальном сплаве, железный материал имеет мягкое состояние, в закаленном же — твёрдое. При нагреве незакаленного сплава, металл при значении t3 изменяет состояние, при этом происходит поглощение теплоты. Если медленно охлаждать раскаленную деталь до критических точек выше значения t3, в при таких величинах сплав изменяет свое состояние, выделяя тепло.
Такое изменение требует некоторого времени, при нехватке которого переходить в другое состояние или вовсе не имеет смысла, или же такой переход совершается не полностью. Таким образом, при быстром охлаждении сталь становится твердее, а при медленном стальной сплав становится мягким. Критические точки не бывают постоянными и зависят от величины твердости сплава. Стальной материал становится еще мягче при удалении от точки t0. При этом значение критических точек зависит от сорта стального материала, который преобразуется при температуре от 700 до 855 градусов цельсия.
Как правильно определить температурный режим необходимый для закалки?
Температуру при закалке доэвтектоидной стали, т.е. сплавов из стали с присутствием углерода меньше 0,8 процента, определяют по формуле А с3+30. 50C. Но бывают случаи, когда доэвтектоидная сталь закаливается при критических точках от точки А с1 до А с3. При этом сталь будет иметь структуру состоящую из нерастворённых мартенсита и феррита. Все это является процессом неполной закалки стали и фактически считается браком. В производстве такое явление используется для снижения коробления деталей либо для исключения образования трещин в высоколегированных видах стали.
Заэвтектоидный стальной сплав при закалке нагревается до температурных режимов критических точек А с1+30-50C. По окончании процесса закалки стальной материал будет иметь структуру из вторичного нерастворённого цементита и мартенсита. Такой процесс позволяет повысить твёрдость и износостойкость продукции из стали.
Критические точки сталей (точки Чернова)
Открытие Д. К. Черновым в 1886 г. критических точек стали послужило фундаментом для создания науки о металлах и построения диаграммы железоуглеродистых сплавов. Важнейшее значение работ Чернова – установление связи между обработкой стали, ее структурой и свойствами. Это обеспечило возможность назначения режимов термической обработки сталей.
Критические точки сталей обозначают буквой А с индексом, указывающему, какому процессу соответствует критическая точка: нагреву – индекс «с», охлаждению – «r». Кроме того, каждая точка имеет постоянный номер, который соответствует определенной температуре (линии диаграммы).

Затем сечение пересекает линию PSK, температура – 727°С, критическая точка Ас1 – превращение перлита в аустенит (начало перекристаллизации). Далее сечение пересекает линию МО, температура – 768°С, точка Ас2 – превращение железа-альфа в немагнитное бета-железо, сталь становится немагнитной. Дальнейшее повышение температуры приводит к пересечению линии GS – точка Ас3, сталь переходит в однофазное аустенитное состояние (конец перекристаллизации).
Температура точки Ас3 зависит от содержания углерода в стали, поскольку линия диаграммы GS наклонная.
При охлаждении номера точек не меняются. В точке Аr3 (линия GS) начнется перекристаллизация стали, в точке Аr2 (768°С) бета-железо переходит в магнитное альфа-железо, в точке Аr1 (727°С) аустенит переходит в перлит и заканчивается перекристаллизация стали, а в точке Ar0 цементит становится магнитным. Следовательно, доэвтектоидные стали имеют критические точки А0, А1, А2 и А3.
У заэвтектоидных сталей С > 0,8 % (сечение II на рис. 24). При температуре 210°С в точке Ас0 цементит теряет магнитные свойства. Дальнейший нагрев вызывает превращение перлита в аустенит в точке Ас1, температура – 727°С (начало перекристаллизации). Затем сечение пересекает линию диаграммы ES. На этой линии перекристаллизация заканчивается и происходит переход стали в однофазное аустенитное состояние. Точка на линии ES номера не имеет, она обозначается буквой m (Асm). Температура этой точки зависит от содержания углерода в стали. Следовательно, заэвтектоидные стали имеют три критические точки: А0, А1 и Аm.
Исходя из вышеизложенного, можно утверждать, что эвтектоидные стали (углерода 0,8 %) будут иметь две критические точки: А0 и А1 (см. рис. 24).
Как указывал Д. К. Чернов, важнейшими значениями температуры (критическими точками) стали будут А1, А3 и Аm. От температуры нагрева до указанных значений зависят фазовый состав, структура, а следовательно, и свойства стали.
Итак, при охлаждении на линии AC (см. рис. 22) из жидкого раствора начинают выделяться кристаллы твердого раствора углерода в гамма-железе – аустенита. По линии CD из жидкого раствора начинают выделяться кристаллы цементита первичного. Под этой линией в области CDF все сплавы будут двухфазными: жидкий раствор и кристаллы цементита первичного. В точке С диаграммы (1147°С), соответствующей концентрации 4,3 % углерода, где линии АС и CD пересекаются, происходит одновременная кристаллизация аустенита и цементита первичного с образованием мелкой смеси их кристаллов – эвтектики. Эвтектика в железоуглеродистых сплавах называется ледебуритом.
Точка С диаграммы – эвтектическая, а линия ECF, проходящая через эту точку, – эвтектическая прямая, и в каждой точке этой прямой сплавы заканчивают первичную кристаллизацию образованием эвтектики. Сплавы с содержанием углерода более 2,14 %, в которых при первичной кристаллизации образуется эвтектика (ледебурит), называют чугунами. Излом таких чугунов светлый, блестящий (белый излом), поэтому такие чугуны называют белыми. В белых чугунах весь углерод находится в химически связанном состоянии в виде цементита.
Чугуны, содержащие менее 4,3 % углерода, называются доэвтектическими, 4,3 % – эвтектическими, более 4,3 % – заэвтектическими.
Доэвтектические чугуны имеют в избытке гамма-железо, которое, растворяя углерод, образует аустенит (рис. 25, а). Поэтому в первую очередь в них образуются его кристаллы. Так будет до тех пор, пока жидкий сплав не приобретет эвтектический состав (4,3 % углерода); после этого он кристаллизуется на линии ЕС диаграммы состояния, образуя ледебурит. После окончания первичной кристаллизации эти сплавы состоят из кристаллов аустенита, окруженных эвтектикой, – ледебуритом.
У эвтектического чугуна, как у чистого металла кристаллизация начинается и заканчивается в точке С при постоянной и самой низкой для всех сплавов температуре – 1147°С. Его структура – мелкая смесь кристаллов аустенита и цементита – ледебурит.
Заэвтектические чугуны в избытке имеют углерод, который способствует образованию, в первую очередь, кристаллов цементита первичного. За счет выделения углерода состав жидкого сплава изменяется, и когда в нем останется 4,3 % углерода, он закончит кристаллизацию на линии СF при температуре 1147°C образованием ледебурита, структура его будет состоять из кристаллов цементита первичного и ледебурита (рис. 25, б).


Рис. 25. Микроструктура белых чугунов (´ 500):
а – доэвтектический; б – заэвтектический
При охлаждении белых чугунов после окончания процесса кристаллизации в них будут происходить структурные и фазовые изменения. В доэвтектических чугунах в интервале температур от 1147 до 727°C вследствие понижения растворимости углерода от 2,14 до 0,8 % из аустенита будет выделяться цементит вторичный. На линии PSK при температуре 727°C произойдет эвтектоидное превращение аустенита в перлит и ледебурит будет состоять из перлита и цементита. Следовательно, структура этих чугунов будет перлит, цементит вторичный и ледебурит (см. рис. 25, а).
Классификация и маркировка углеродистых сталей и чугунов
- по диаграмме состояний – доэвтектоидные, эвтектоидные и заэвтекто-идные;
- по структуре – феррит + перлит, перлит, перлит + цементит вторичный;
- по способу выплавки – выплавленные в конверторах (конверторные), мартеновских и электрических печах (мартеновские и электростали);
- по содержанию углерода – низкоуглеродистые (менее 0,3 %), среднеуглеродистые (0,3 – 0,7 %) и высокоуглеродистые (0,7 % и более);
- по степени раскисления и характеру затвердевания – спокойные (сп), полуспокойные (пс), кипящие (кп). Кипящие стали содержат минимальное количество кремния (не более 0,07 %), дешевы, хорошо поддаются холодной листовой штамповке, но по сравнению со спокойными имеют высокий порог хладноломкости, и их нельзя использовать для изготовления ответственных конструкций в условиях Сибири и Севера. Порог хладноломкости – отрицательная температура, при которой металл переходит в хрупкое состояние;
- по качеству – обыкновенного качества, качественные и высококачественные. Под качеством стали понимается совокупность свойств, определяемых металлургическим процессом ее производства. Основными показателями для их разделения служат нормы содержания вредных примесей – серы и фосфора;
- по назначению – конструкционные и инструментальные. Конструкционные стали предназначены для изготовления металлоконструкций, деталей машин и должны обладать высокой конструктивной прочностью (определенным комплексом механических свойств), иметь хорошие технологические свойства.
Обычно они содержат не более 0,6 – 0,7 % углерода и имеют ферритно-перлитную структуру, т. е. являются сталями доэвтектоидными. Инструментальные стали, содержащие не менее 0,7 % углерода, должны обладать высокой твердостью, прочностью и износостойкостью, предназначены для изготовления инструментов. Это стали эвтектоидные и заэвтектоидные, их структура – перлит или перлит и цементит вторичный.
ОПРЕДЕЛЕНИЕ КРИТИЧЕСКОЙ ТЕМПЕРАТУРЫ
Уравнение состояния Клапейрона - Менделеева достаточно хорошо описывает известные из опытов свойства газов. Однако, оно является приближённым и оказывается справедливым только при достаточно малых давлениях. Кроме того опыт показывает, что при определенных значениях давления и температуры газы конденсируется, т.е. приходят в жидкое состояние. Уравнение Клапейрона - Менделеева это явление не описывает. Изотерма для реального газа при этом имеет характерный вид (рис. 1).
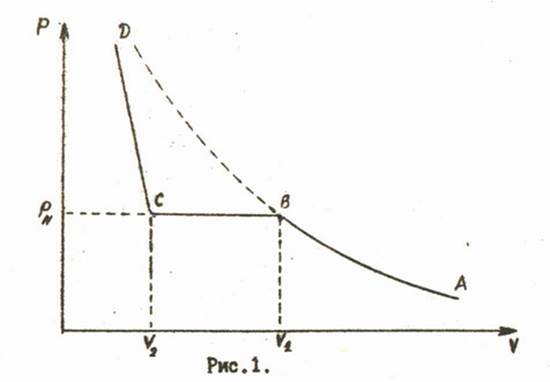
Рассмотрим процесс, соответствующий этому графику, проведённый в направлении ABCD. Часть изотермы AB описывает процесс сжатия газа до начала конденсации. Она достаточно хорошо может совпадать с изотермой, рассчитанной по уравнению Клапейрона-Менделеева (изображена пунктиром). Однако в процессе, проведённом с реальным веществом при определенном давлении начнётся конденсация (точка B на графике). Это давление называют давлением насыщенных паров или просто давлением насыщения .
Часть графика BC описывает двухфазное состояние вещества. При уменьшении объема от до все большая доля вещества переходит из парообразного состояния в жидкое. Точка C изображает состояние, когда всё вещество превратилось в жидкость. Наконец, CD описывает процесс сжатия жидкости, график идет почти параллельно вертикальной оси, отражая известный факт: жидкости имеют гораздо меньшую сжимаемость, чем газы.
Если проводить подобные изотермические процессы с одним и тем же количеством вещества при различных температурах, мы получим систему изотерм, изображенную на рис.2.
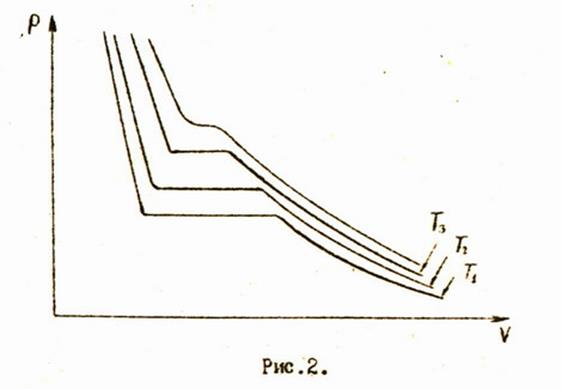
Кривые, соответствующие более высоким температурам, располагаются дальше от начала координат. С повышением температуры горизонтальные части изотерм, описывающие двухфазное состояние, уменьшаются и при некоторой температуре вырождаются в одну единственную точку. Эта температура называется критической.
При температуре выше критической нельзя получить вещество в двухфазном состоянии.
§ 2. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
Уравнение состояния идеального газа при больших плотностях не может дать хорошего совпадения с экспериментом, поскольку при eгo написании предполагалось, что молекулы не имеют размеров и не взаимодействуют между собой. Чтобы получить уравнение состояния, удовлетворительно описывающее свойства реальных газов, надо учесть размеры молекул или силы отталкивания, возникающие между молекулами, находящимися на малых расстояниях друг отдруга. Кроме того, надо учестьтакже и силы притяжения между молекулами.
Можно взять за основу уравнение состояния Клапейрона - Менделеева и внести в него соответствующие поправки. Учёт сил отталкивания или размеров молекул произведем, введя поправку к объёму в уравнении Клапейрона - Менделеева для одного киломоля газа
Из второго выражения видно, что при давление стремится к бесконечности, т.е. нельзя сжать вещество до объёма, равного нулю.
При сравнительно больших расстояниях междумолекулами существенную роль играют силы притяжения. Их можно учесть, введя соответствующую поправку к давлению в уравнении (2):
Эту поправку необходимо взять с отрицательным знаком, полагая, что притяжение молекул приводит к уменьшению давления на стенки содержащего данный газ сосуда. Уравнение (3) можно преобразовать так:
Это и есть уравнение состояния реальных газов, впервые полученное Ван-дер-Ваальсом. Можно записать его для произвольного количества вещества:
где относительная молекулярная масса.
Уравнение (4) можно представить в виде степенного ряда по объему:
При фиксированных давлении и температуре оно будет являться уравнении третьей степени относительно объема и должно иметь три корня. Наиболее интересные результаты получаются при анализе изотерм Ван-дер-Ваальса, одна на которых изображена, на рис.3.
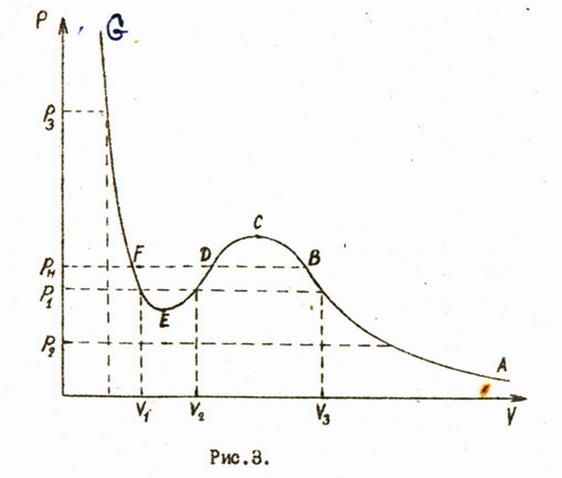
При фиксированной температуре каждому значению давление будут соответствовать три корня уравнении (6). Давлению соответствуют три вещественных корня , , . Давлениям и соответствуют один вещественный корень и два комплексно сопряжённых корня, которые физического смысла не имеют и в дальнейшем рассматриваться не будут.
Интересно сопоставить изотерму Ван-дер-Ваальса и опытную изотерму. На рис.3 горизонтальный участок опытной изотермы изображен прямой BF. Часть AB описывает газообразное состояние вещества и удовлетворительно совпадает с опытной изотермой. Часть FG описывает изотермическое сжатие жидкости. Таким образом, уравнение Ван-дер-Ваальса сравнительно неплохо описывает поведение вещества в газообразном и жидком состояниях при изотермическом процессе.
Существенно изотермы отличаются на участке BF . Однако ветви BC и EFимеют определённый физический смысл. Состояния вещества, изображаемые участком BC, могут быть экспериментально получены. Это - пересыщенный или переохлаждённый пар. Состояния вещества, соответствующие участку EFтакже наблюдаются на опыте. Жидкость в таких состояниях называется перегретой. Эти состояния называют метастабильными. Часть изотермы Ван-дер-Ваальса CDE в опытах никогда не наблюдается. Она описывает нестабильное состояние вещества.
§ 3. Критическая температура. Критическое состояние.
Построим семейство изотерм Ван-дер-Ваальса (рис.4). С увеличением температуры кривые будут располагаться далее от начала координаты и характер их будет меняться. Максимумы и минимумы будут сближаться как по оси абсцисс, так и по оси ординат, и при некоторой температуре сольются в одну точку, точку перегиба. При этой температуре и соответствующем данной точке давлении три вещественных корня становятся кратными. Различие между жидкостью и паром и граница раздела между ними исчезают. Такое состояние называют критическим, а температуру - критической температурой. Эта температура является характерным свойством каждого вещества.
Используя уравнение Ван-дер-Ваальса, можно выразить критические параметры , , через индивидуальные константы вещества и , а также через универсальную газовую постоянную .
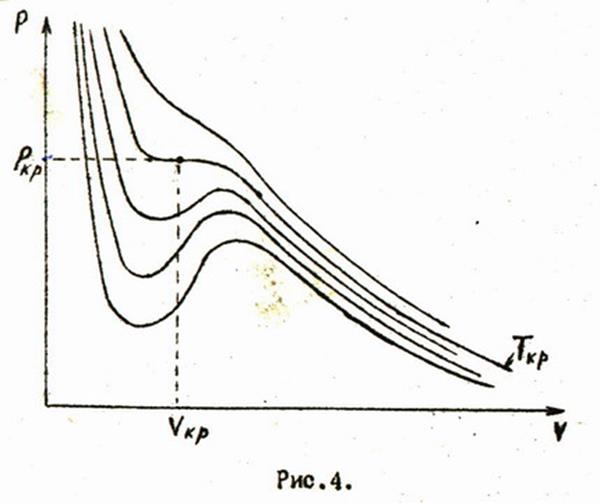
Один способ нахождения критических параметров основывается на том, что корни уравнения Ван-дер-Ваальса, написанного для критического состояния, являются кратными, т.е, уравнение можно представить так:
Сопоставим с уравнением (6)
Это равенство будет тождественно выполняться, если коэффициенты, при одинаковых степенях будут равны между собой:
Решая систему уравнений (8), получим выражения для критических параметров:
Эти же результаты можно получить другим путем. Как уже отмечалось, точка, изображающая критическое состояние, является точкой перегиба на графике изотермического процесса в координатах , . Используем уравнение (3), определяющее давление как функции объёма при фиксированной температуре. Из курса математического анализа известно, что в точке перегиба первая и вторая производные равны нулю:
Решая систему уравнений (3), (10), (11) относительно , , получим для них те же соотношения (9).
Определив экспериментально критические параметры, можно найти индивидуальные константы вещества и .
Таким образом, уравнение Ван-дер-Ваальса описывает свойства жидкостей и газов, предсказывает существование критического состояния. Однако, оно является менее универсальным, чем уравнение Клапейрона-Менделееве, так как в него входят две индивидуальные константы вещества и .
II. Описание УСТАНОВКИ.
Знание критических параметров , , представляет значительный научный и практический интерес. При температуре выше критической вещество может существовать только в газообразном состоянии. Скрытая теплота парообразования и коэффициент поверхностного натяжения при критической температуре обращаются в нуль.
Построив на основе экспериментальных данных систему изотерм (как показано не Рис2), можно определить критическую температуру и два других параметра. Этот метод был впервые применен Эндрюсом при определении критических параметров углекислого газ. При определении только критической температуры можно воспользоваться менее громоздким методом исчезновения мениска. Исследуемое вещество помещается в запаянную стеклянную ампулу и нагревается. Если количество жидкости в ампуле подобрано таким образом, что в процессе нагревания мениск практически остается на месте, то в определённый момент вещество достигнет критического состояния (мениск при этом исчезнет). При охлаждении он снова появится и вещество разделится на две фазы. Температура, при которой появляется и исчезает мениск и будет являться критической температурой.
Определение критической температуры производится на установке, схема которой изображена не рис.5.
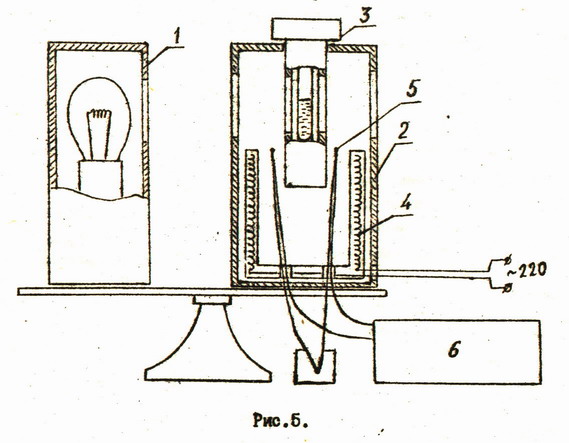
На общей подставке смонтированы осветитель 1 и термостат 2, в который помещается специальный микропресс 3 с исследуемы веществом. В нижней части корпуса осветителя имеется два тумблера: одним включается осветитель, другим нагреватели 4 термостате. Температура термостата контролируется с помощью двух хромель-копелевых термопар, включенных последовательно. Рабочие спаи термопар 5 помещаются в непосредственной близости к микропрессу. Термо-э.д.с. измеряется с помощью цифрового вольтметра 6.
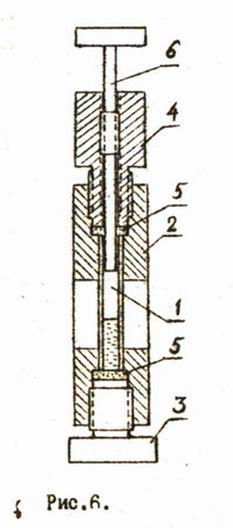
Устройство микропресса, совмещающего в себе конструктивно рабочую камеру и миниатюрный пресс, показано на рис.6. Рабочим объемом иикропресса является объём тонкой стеклянной трубки 1, которая помещается в корпус пресса 2. С обоих торцов стеклянная трубка герметически закрывается винтами 3 и 4 с фторопластовыми уплотнениями 5. Внутри винта 4 по резьбе может перемещаться поршень 6 и таким образом менять рабочий объём. Визуальное наблюдение за изменением состояния вещества производится через смотровые щели в корпусе пресса и в корпусе термостате.
III. ИЗМЕРЕНИИ. ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ.
В процессе выполнения лабораторной работы необходимо провести градуировку термопар и построение градировочной кривой. Для этого предварительно включить вольтметр, а затем, через 20-30 минут, включить нагреватели термостата. Вместо микропрес-са в термостат помещается ртутный термометр с пределами измерения от 0°С до 350°С. В процессе повышения температуры необходимо записывать показания вольтметра и термометра через Dt=20°С. Затем надо включить нагрев термостата и записать соответствующие показания при остывании. Окончательные результаты градуировки представить в виде графика: по вертикали откладываются показания вольтметра в милливольтах U, по горизонтали разность между температурой термостата и комнатной температурой. Необходимо брать именно разность температур, поскольку "холодные" спаи термопар находятся при комнатной температуре.
После проведения градуировки заполнить микропресс исследуемым веществом со стороны винта 3 с помощью шприца. Поршень при этом должен быть введён в стеклянную, трубку до соответствующей отметки, примерно на 3/4 длины. Далее необходимо винтом 3 с уплотнением закрыть пресс так, чтобы в стеклянную трубку не попал пузырёк воздуха. Винты 3 и 4 надо крепко закрутить. После этого поршень можно вывести из стеклянной трубки таким образом, чтобы образовавшаяся при этом газообразная фаза занимала примерно такой же объём, как и жидкая. Затем пресс помещают в термостат так, чтобы рукоятка поршня находилась сверху за пределами термостата и включают нагрев.
В процессе нагревания необходимо следить за положением менискаи, перемещая поршень, в ту или другую сторону, не давать ему уйти из поля зрения. При определенной температуре мениск должен исчезнуть. Это критическая температура. Вещество в критическим состоянии интенсивно рассеивает свет и становится мутно-белым, непрозрачным. В данной установке детали микропресса выходят за пределы термостата, через них происходит интенсивный теплоотвод, Поэтому температура в стеклянной трубке неоднородна, и критическое состояние может быть получено только в нижней части трубки. Это и наблюдается в эксперименте. В верхней части трубки при этом может наблюдаться граница раздела двух фаз.
В процессе работы необходимо измерить температуру, при которой в нижней части стеклянной трубку начнется интенсивное рассеяние света веществом. Затем нагреватели необходимо выключить и измерить температуру, при которой это рассеяние исчезнет. Подобные измерения провести несколько рез и в качестве критической температуры взять среднее значение.
| Вещество | Этиловый спирт | Диэтиловый эфир | Ацетон | Гексан | Изопропиловый спирт |
| Критическое давление атм. | 35,6 | 46,6 | 29,9 |
По результатам измерения критической температуры. и используя данные таблицы 1 для критического давления, рассчитать константы Ван-дер-Ваальса и для исследуемого вещества.
1) Для чего введены константы и в уравнение Ван-дер-Ваальса?
2) Сравнить систему реальных изотерм и систему изотерм Ван-дер-Ваальса.
3) Как меняется давление насыщения при изменении температуры?
4) Рассказать о двух методах вывода формул для критических параметров.
5) Написать приведенное уравнение Ван-дер-Ваальса.
6)
Сформулировать закон соответственных состояний.
В Металлообработке, что такое критическая температура?

А Вы знаете, что такое критическая температура в металлообработке?

В Металлообработке, что такое критическая температура?
Критическая температура в металлообработке?
Металлообработка часто фокусируется на преимуществах нагревательного материала до экстремальных температур для гибкости, но редко являются преимуществами экстремального охлаждения.
При охлаждении металла до очень низкой температуры, называемой его критической температурой, можно наблюдать электрический феномен, называемый сверхпроводимостью.
Этот метод является важным достижением в электромонтажных работах и используется с различными металлами, но алюминий и сталь обычно являются наиболее распространенными.
Критическая температура металла отличается от вещества к веществу и для целей проводимости может оказаться невозможной.
Как правило, металлы необходимо охлаждать до температуры около 0 градусов по Цельсию (минус 459 по Фаренгейту, минус -273 градуса Цельсия) с использованием жидкого азота до тех пор, пока не произойдет заметное изменение фазы. Это изменение связано с несуществующим электрическим сопротивлением, также называемым сверхпроводником. Это позволяет передавать энергию легче, чем через традиционную проводку.
Сверхпроводимость обычно является целью критического температурного процесса. Когда металл охлаждается до этой критической температуры, исследования показали, что он является лучшим проводником, чем провода при комнатной температуре. Нет электрического сопротивления, поэтому электроны могут свободно проходить через этот металл, в результате почти не теряется энергия за счет тепла. Сверхпроводниковые петли с использованием металлов, охлажденных до критической температуры, могут длиться несколько лет практически без ухудшения, по сравнению с традиционными системами, которые часто необходимо заменять из-за высокой температуры.

Художественная металлообработка позволяет сделать удивительные вещи из металла.
Алюминий считается отличным металлом для критической температурной сверхпроводимости. Его легкий вес и ковкость делают его основным выбором для проводов и других материалов, используемых при электропроводке. Алюминий часто используется в отраслях, требующих передачи большого количества энергии, например, электростанции или крупной фабрики.
Было обнаружено, что сталь и ее многочисленные сплавы представляют собой другой тип металла, который хорошо обрабатывает эту обработку. Критическая температура стали полезна больше, чем просто проводка электричества. Изотермический отжиг — это процесс, созданный для контроля скорости изменения температуры металла, также называемый температурным градиентом, который имеет конкретный кусок стали, охлажденный чуть выше критической температуры, затем опускается ниже этой точки и возвращается обратно. Закалка — это еще один процесс критической температуры стали, который не связан с сверхпроводимостью или жидким азотом, но вместо этого металл охлаждается до этой точки в воде, масле или рассоле, чтобы увеличить его содержание углерода.
Еще по теме:
Металлообработка и зубчатость Зубчатость - метод металлообработки, используемый для изменения зерна куска металла. Это метод…
Электронная обрабатывающая промышленность - это всемирная группа предприятий, занимающихся производством компьютеров, коммуникаций и других электронных…
Инновации Обработка порошков и сыпучих материалов Обработка порошков и сыпучих материалов является важным элементом многих…
Инженерно-технические компании выполняют задачи проектирования, монтажа и проверки коммуникационных сетей. В штатах таких организаций дипломированные…
Читайте также:
