Лабораторная работа химические свойства металлов
Обновлено: 17.05.2024
Тема урока: Химические свойства металлов.
Тип урока: практическая работа.
- закрепить на практике знания химических свойств металлов;
- продолжить формирование умений наблюдать за явлениями и делать выводы;
- продолжить формирование умений и навыков учащихся по использованию лабораторного оборудования для проведения эксперимента.
Методы и методические приемы: репродуктивный (повторение), наглядный, поисковый.
- лоток, пробирки, штатив для пробирок, щипцы, спиртовка, соляная кислота, серная кислота, цинк, сульфат меди(II), железо;
- методичка для выполнения опытов;
- творческое задание.
I. Организационный момент
II. Актуализация знаний (вводная часть)
Учитель: Мы изучаем тему «Металлы», познакомились с нахождением металлов в Периодической системе элементов Д.И.Менделеева, их физическими и химическими свойствами. Вспомните, какие химические свойства металлов нам известны?
Ученик: Взаимодействие с простыми веществами (кислородом, хлором, серой, азотом) и сложными веществами (водой, кислотами, солями).
Учитель: При изучении химических свойств металлов мы рассмотрели реакцию их взаимодействия с водой, а теперь вам предстоит познакомиться на практике еще с некоторыми свойствами металлов.
III. Практическая работа
Учитель: Итак, откройте тетради, запишите дату и приступайте к оформлению работы по заданному образцу.
На доске образец оформления работы (продублирован в рабочих картах):
Практическая работа № 1. Химические свойства металлов
Цель работы: на практике познакомиться с основными химическими свойствами металлов. Повторить навыки обращения с лабораторным оборудованием и реактивами.
Приборы и реактивы: (заполняется учащимися самостоятельно, исходя из предложенных материалов, согласно варианту).
Ход работы:
Общий вывод:
Учитель: Перед выполнением опытов, давайте повторим основные правила проведения эксперимента и техники безопасности.
Ученик: Действия производятся над лотком, на расстоянии вытянутой руки, на уровне глаз. Банки с реактивами берутся в руку этикеткой внутрь, реактив наливается 1–2 мл, но если перелили, то обратно в банку не возвращается.
Учитель: Приступаем к проведению опытов.
Учащиеся выполняют опыты по вариантам (1, 2) группами по 4 человека.
IV. Закрепление материала
Учитель: для проверки полученных вами знаний поработайте над творческим заданием – отгадайте по описанным свойствам о каком металле идет речь и ответьте на вопросы.
Конечно, мы металлы – дружная семья,
Но все же всех прекрасней – я.
Я красная, блестящая и очень работящая.
Ведь если нужно потрудиться, ток вам проводя,
Все тут же вспоминают про меня.
И если колокол звенит, под куполом паря,
Так это я звеню, всем музыку даря.
Доспехи в древности для рыцаря, коня
Ведь тоже делали при помощи меня.
А вот теперь в карман залезьте
И монетами звеня, вы дружно угадайте
Кто же я?
А заодно ответьте, правды не тая,
Вот почему же люди, красоту мою ценя
Посуду-то не делают, скажите из меня?
Ученик: Этот металл – медь. Медь не применяют для производства посуды, потому что изделия из меди в присутствии влаги покрываются темно-зеленой пленкой.
Прославился я твердостью и прочностью своей,
И потому-то мною исписал стекло злодей,
Но нет полезней нас с танталом для людей.
Когда хирург не смог собрать костей,
То обратился к помощи моей.
Так вот ответьте, почему же?
И имя постарайтесь отгадать к тому же.
Ученик: Этот металл – титан. Он применяется в хирургии для восполнения утраченных фрагментов костей, так как является устойчивым к окислительным процессам, происходящим в организме человека.
V. Рефлексия
Учитель: Что мы закрепили сегодня на уроке? Какие вопросы у вас остались неразрешенными?
Ученик: Мы повторили и закрепили на практике химические свойства металлов.
Учитель: Запишите в дневниках домашнее задание – стр. 34– 37, в. 1 , з.7 (стр. 37).
Рабочая карта
1. Оформление работы
Практическая работа № 1. Химические свойства металлов.
Приборы и реактивы:
2. Описание проведения опытов
Опыт 1. Поместите в пробирку кусочек цинка и добавьте 1–2 мл раствора серной кислоты.
Опыт 2. Зажмите щипцами медную проволоку и прокалите в пламени спиртовки до образования черного налета.
3. Творческое задание
Рабочая карта.
Лабораторная работа по химии на тему "Химические свойства металлов"

Работа поможет закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Описание разработки
Цель: закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Опыт 1. Сравнение химической активности металлов.
А). Возьмите две пробирки. В первую долейте 2 мл раствора соли цинка, во вторую пробирку 2 мл раствора соли меди (ΙΙ). В первую пробирку положите кусочек меди, во вторую – цинк.
Б). Возьмите две чистые пробирки. В первую налейте 2 мл раствора плюмбум нитрата, во вторую – столько же раствора купрум (ΙΙ) нитрата. В первую пробирку опусти кусочек меди, во вторую – кусочек свинца.
Опыт 2. Воздействия металлов с растворами кислот.
Возьмем три чистые пробирки. В первую пробирку опустим кусочек меди, во вторую – магния, в третью – цинка. В каждую пробирку нальем по 2-3 мл разбавленного раствора сульфатной кислоты.
Опыт3. Взаимодействие металлов с водой.
Возьмите три чистых пробирки. В первую опустите кусочек меди, во вторую – магния, в третью - цинка. В каждую из пробирок налейте по 2 мл воды.
Полную информацию смотрите в файле.
Содержимое разработки
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
ГОСУДАРСТВЕННОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ДОНЕЦКИЙ ПРОФЕССИОНАЛЬНО- ПЕДАГОГИЧЕСКИЙ КОЛЛЕДЖ
Дисциплина:ХИМИЯ
ЛАБОРАТОРНАЯ РАБОТА № 3
Тема. Химические свойства металлов.
Цель: закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Оборудование: штатив с пробирками.
Реактивы: раствор цинка хлорида, купрум сульфата, плюмбум хлорида, плюмбум нитрата, купрум нитрата, хлоридной кислоты, сульфатной кислоты, медь, цинк, свинец.
С правилами техники безопасности ознакомлен: ____________________
Опыт 1. Сравнение химической активности металлов.
Запишите химическую реакцию в молекулярной форме и ионной форме
Опыт 2. Воздействия металлов с растворами кислот.
Опыт3. Взаимодействие металлов с водой.
В тех пробирках, где не произошло никаких изменений, нагрейте.
Сделайте общий вывод:
Какие химические свойства металлов вы рассмотрели в ходе лабораторной работы?
Приведите в порядок своё рабочее место.

-82%
Лабораторная работа №7 Химические свойства металлов
Свободные металлы являются восстановителями. Их восстановительная способность меняется в широких пределах и служит мерой химической активности. За меру химической активности металла принимается его способность переходить в состояние положительно заряженного иона, теряя при этом электроны.
Русский ученый Н.Н.Бекетов расположил все металлы в порядке уменьшения их активности. Полученный ряд был назван «вытеснительным рядом», а теперь он известен как ряд активности металлов.
Li K Ba Ca Na Mg Be Al Zn Cr Fe Cd Bi Sn Pb H Cu Hg Ag
Металлы, расположенные в ряду активностей левее цинка, считаются активными металлами. Металлы, начиная с цинка, расположенные в ряду активностей до водорода, считаются металлами средней активности. Металлы стоящие после водорода, являются малоактивными.
Каждый металл вытесняет из растворов солей все металлы, которые следуют за ним в ряду активностей.
Взаимодействие металлов с водой, щелочами, кислотами.
Тем, что атомы свободных металлов легко отдают внешние электроны, объясняется такое свойство типичных металлов как способность реагировать с водой, щелочами, кислотами.
Взаимодействие металлов с водой.
Активные металлы разлагают воду с вытеснением водорода, при комнатной температуре:
2Na + 2H2O = 2NaOH + H2 2Na 0 – 2e 2 Na +
Менее активные металлы вступают в реакцию с водой при нагревании.
Взаимодействие металлов с щелочами
Со щелочами могут взаимодействовать металлы, имеющие амфотерные оксиды (Be,Zn. Al). В этом случае металлы образуют анионы своих кислот.
Be + 2KOH = K2BeO2 + H2 Be 0 – 2e Be 2+
Взаимодействие металлов с кислотами
С кислотами металлы реагируют различно в зависимости от активности металла и окислительных свойств кислоты.
1. В реакции с галогеноводородными кислотами (HCl,HBr), а также с разбавленной серной кислотой могут вступать только металлы, стоящие в ряду активности до водорода. В этом случае окислителем являются ионы Н + , которые вытесняются из кислоты металлом:
Fe + 2HCl = FeCl2 + H2 Fe 0 – 2e Be 2+
2. В концентрированном растворе H2SO4 окислителем выступают атомы серы со степенью окисления +6.
Металлы малой активности восстанавливают серную кислоту до диоксида серы SO2, среднеактивные металлы – атомарной серы, а более активные до H2S.
Пассивацией металла называется его энергичное окисление концентрированной кислотой, в результате чего поверхность металла покрывается плотной пленкой оксида, предохраняющей металл от дальнейшего окисления.
Концентрированная серная кислота пассивирует на холоде железо.
3. В растворе азотной кислоты любой концентрации окислителем являются атомы азота со степенью окисления +5. Продукты восстановления HNO3 металлом зависят от концентрации кислоты и активности металла.
Лабораторная работа 14 Химические свойства металлов
Цель работы: изучить химические свойства металлов научиться составлять уравнения реакций взаимодействия металлов с водой, кислотами, щелочами.
Задание: провести реакции взаимодействия металлов с водой, щелочами, разбавленными и концентрированными растворами серной и азотной кислот. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Металлы, имея низкие потенциалы ионизации, легко отдают валентные электроны и образуют положительно заряженные ионы:
Поэтому металлы в химических реакциях являются восстановителями и способны взаимодействовать с различными веществами − окислителями.
Рассмотрим некоторые типичные случаи такого взаимодействия.
1. Металлы высокой химической активности могут разлагать воду с вытеснением водорода при комнатных температурах:
2. С кислотами металлы реагируют различно в зависимости от активности самого металла и окислительных свойств кислоты:
– В разбавленной серной кислоте и в растворах галогеноводородов окислителем является ион H + , поэтому в них растворяются металлы, стоящие в ряду напряжений до водорода:
– Концентрированная серная кислота является окислителем за счет иона SO4 2− и может при нагревании окислять металлы, стоящие в ряду напряжений после водорода. Продукты ее восстановления могут быть различными в зависимости от активности металла. При взаимодействии с малоактивными металлами кислота восстанавливается до SO2.
При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород.
В этих реакциях часть молекул серной кислоты играют роль среды.
– Азотная кислота является сильнейшим окислителем за счет иона NO3 − . Продукты восстановления различны и зависят от концентрации кислоты и активности металла:
При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами выделяется NO. В случае более активных металлов выделяется N2O. Сильно разбавленная азотная кислота взаимодействует с активными металлами с образованием иона аммония, дающего с кислотой нитрат аммония.
3. Со щелочами реагируют металлы, дающие амфотерные гидроксиды, а также металлы, обладающие высокими степенями окисления в присутствии сильных окислителей:
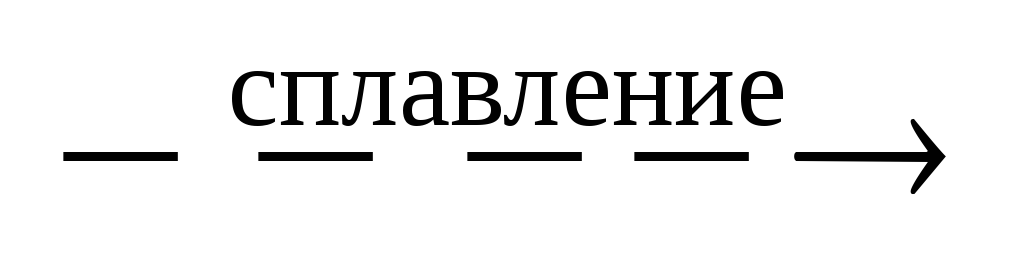
2Mo + 4KOH + 3O2 2K2MoO4 + 2H2O
Выполнение работы
Опыт 1. Взаимодействие металлов с водой
В кристаллизатор с водой добавить несколько капель фенолфталеина. Пинцетом достать кусочек натрия (или кальция) из склянки, где он хранится под слоем керосина, и высушить его фильтровальной бумагой. Ножом отрезать небольшую часть (размером со спичечную головку) и пинцетом перенести в кристаллизатор с водой. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнение реакции взаимодействия натрия с водой.
2. Сделать вывод, какие металлы взаимодействуют с водой.
Опыт 2. Действие разбавленной и концентрированной серной кислоты на металлы
В три пробирки налить по 2-3 мл разбавленной серной кислоты и опустить в одну из них кусочек железа, в другую – цинка, в третью – меди. Какие металлы реагируют с кислотами?
(Проводить под тягой!) В две пробирки налить по 2-3 мл концентрированной серной кислоты. В одну из них опустить кусочек цинка, в другую – кусочек меди. Обе пробирки слегка нагреть. Наблюдать выделение серы и по запаху определить выделяющийся газ в первой пробирке. Какой газ выделяется во второй пробирке?
1. Составить уравнения реакций взаимодействия металлов с разбавленной серной кислотой.
2. Сделать вывод, какие металлы взаимодействуют с разбавленной серной и соляной кислотами.
3. Составить уравнения реакций взаимодействия цинка и меди с концентрированной серной кислотой.
4. Сформулировать правило взаимодействия металлов с концентрированной H2SO4.
Опыт 3. Действие разбавленной и концентрированной азотной кислоты на металлы
(Проводить под тягой!) В две пробирки налить по 2-3 мл разбавленной азотной кислоты и опустить в одну из них кусочек цинка, в другую – кусочек меди. Слегка нагреть обе пробирки. Наблюдать выделение газа.
(Проводить под тягой!) В две пробирки налить по 2-3 мл концентрированной азотной кислоты и опустить в одну из них кусочек цинка, в другую – кусочек меди. Какой газ выделяется?
1. Составить уравнения реакций взаимодействия цинка и меди с разбавленной азотной кислотой.
2. Составить уравнения реакций взаимодействия цинка и меди с концентрированной азотной кислотой.
3. Сформулировать правило взаимодействия металлов с концентрированной и разбавленной HNO3.
Читайте также:
