Лабораторная работа химия металлов
Обновлено: 17.05.2024
Предлагаем студентам экспериментально изучить химические свойства ме-таллов разной активности и сделать вывод о связи между положением метал-ла в ряду и его реакционной способностью. По ходу выполнения опытов уча щиеся заполняют таблицу в тетрадях для практических работ.
| Вложение | Размер |
|---|---|
| lab_rab_no6resh.eksp_.zad_._po_teme_metally_variant1svoystva_me.docx | 31.06 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Лабораторная работа № 6
Тема: Общие свойства металлов.
Дидактическая цель: создать условия для применения студентами знаний и умений в знакомых и новых учебных ситуациях.
Образовательные цели : на практике познакомить учащихся с химическими свойствами металлов разной активности; установить связь между положени-ем металла в ряду активности и его химическими свойствами; повторить типы химических реакций.
Развивающие цели : развивать общеучебные умения и навыки (заполнение таблицы, грамотное проведение эксперимента, моделирование процесса, вы-деление главного), внимание, мышление (прогнозирование продуктов реак-ции); продолжить формирование умения записывать уравнения химических реакций.
Воспитательные : развивать навыки общения в группе
Основные правила безопасности при выполнении эксперимента
- Содержите свое рабочее место в чистоте и порядке, работайте внимательно и аккуратно.
- Соблюдайте тишину, не отвлекайте товарищей.
- Не пейте и не принимайте пищу в лаборатории.
- Приступайте к выполнению задания только тогда, когда четко уяснили цели, задачи и ход проведения эксперимента, строго следуйте всем ука-заниям преподавателя.
- Осмыслите основные этапы проведения опыта. Проверьте наличие не-обходимого оборудования и реактивов на рабочем месте перед началом работы.
- Сухие вещества берите шпатылем, жидкие реактивы набирайте пипет-кой; наливая жидкость из склянки, держите емкость этикеткой к ладони. Категорически запрещается брать реактивы руками.
- НЕ сливайте инее ссыпайте ошибочно взятый избыток какого-либо ре-актива в ту емкость, из которой он был взят.
- Не пробуйте вещества на вкус.
- При попадании на кожу кислот смойте их большим количеством воды и обработайте пораженное место нейтрализующим веществом (5%-10%
-ным раствором соды).
10. При попадании реактивов на одежду смойте их большим количеством воды и используйте нейтрализующее средство по указанию учителя для каждого конкретного случая.
11.После окончания работы сдайте рабочее место преподавателю или дежур- ному студенту.
Предлагаем студентам вопросы:
1.Что такое ряд активности?
2.По какому принципу металлы расположены в этом ряду?
3.Какие химические свойства характерны для металлов, стоящих в этом ряду активности до водорода и после него?
4.Какие признаки металлов вам известны?
5.Где находятся металлы в Периодической системе химических элементов Д.И. Менделеева?
6.Что такое химическая реакция?
7.Какие типы химических реакций вам известны?
Предлагаем студентам экспериментально изучить химические свойства ме-таллов разной активности и сделать вывод о связи между положением метал-ла в ряду и его реакционной способностью. По ходу выполнения опытов уча щиеся заполняют таблицу в тетрадях для практических работ.
Результаты изучения некоторых химических свойств металлов разной активности
Организуем в группах выполнение химического эксперимента. Предлагаем инструкцию.
Инструкция по выполнению работы
- В пробирку с порошкообразным железом аккуратно добавьте несколь-ко капель соляной кислоты. Наблюдайте происходящее явление и за-полните табдицу. Какой газ при этом выделился? О чем это свидетель-ствует?
- В пробирку аккуратно налейте несколько миллилитров раствора суль-фата меди (||), добавьте гранулу цинка, наблюдайте появление красного налета на поверхности цинка. Заполните таблицу.
- К медным стружкам аккуратно прилейте несколько капель соляной кислоты. Если признаки протекания реакции? Заполните таблицу.
- Наблюдайте опыт, демонстрируемый преподавателем: взаимодействие кусочка лития с водой. Обратите внимание на выделение газа. Заполните таблицу.
- Сделайте общий вывод.
Студенты в группах проводят опыты, иллюстрирующие свойства металлов: взаимодействие с кислотами и солями. При этом они применяют знания в знакомой ситуации (пункты 1,2 инструкции), в измененной (пункт3) и в новой (пункт 4,5). Заполняют таблицу и формулируют выводы.
Информация о домашнем задании и рефлексия
Закончить уравнения реакций, написать их в ионном виде:
Вопрос : как связано положение металла в ряду активности с его природой и химическими свойствами?
Оценка лабораторных работ производится по следующим критериям:
Оценка 5 ставится, если учащийся самостоятельно выполняет работу в полном объеме с соблюдением необходимой последовательности проведе-ния опытов, обеспечивающих получение правильных результатов и выводов; соблюдает требования правил безопасного труда; в отчете правильно и акку-ратно выполняет все записи, оформляет таблицу, делает выводы, отвечает на вопросы.
Оценка 4 ставится, если выполнены требования к оценке 5, но были допущены два-три ошибки в написании уравнений реакций.
Оценка 3 ставится, если студент правильно понимает химическую сущность рассматриваемых явлений и закономерностей, но в ответе имеются пробелы, не препятствующие дальнейшему усвоению материала. Работа выполнена не полностью.
Оценка 2 ставится, если студент не овладел основными знаниями и умениями в соответствии с требованиями программы и допустил много ошибок. Работа выполнена не полностью и объем выполненной части работы не позволяет сделать правильных выводов; если опыты, наблюдения производились неправильно.
Оценка 1 ставится, если учащимся совсем не выполнил работу.
Во всех случаях оценка снижается, если ученик не соблюдал требований правил безопасного труда.
Перечень ошибок
1. Незнание определений основных понятий, законов, правил, основных положений теории, формул, общепринятых символов обозначения химичес-ких знаков, физических величин, единиц их измерения.
2. Неумение выделять в ответе главное.
3. Неумение применять знания для написания уравнений реакций, решения задач и объяснения физических и химических явлений решения.
5. Неумение провести опыт, написать уравнения химических реакций. необходимые расчеты или использовать полученные данные для выводов.
6. Небрежное отношение к лабораторному оборудованию.
8. Нарушение требований правил безопасного труда при выполнении эксперимента.
1. Неточности формулировок, определении, понятий, законов, теорий, вызванные неполнотой охвата основных признаков определяемого понятия; ошибки, вызванные несоблюдением условий проведения опыта или измерений.
2. Ошибки в условных обозначениях.
3. Пропуск или неточное написание наименований единиц физических величин.
Лабораторная работа по химии на тему "Химические свойства металлов"

Работа поможет закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Описание разработки
Цель: закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Ход работы:
Опыт 1. Сравнение химической активности металлов.
А). Возьмите две пробирки. В первую долейте 2 мл раствора соли цинка, во вторую пробирку 2 мл раствора соли меди (ΙΙ). В первую пробирку положите кусочек меди, во вторую – цинк.
Б). Возьмите две чистые пробирки. В первую налейте 2 мл раствора плюмбум нитрата, во вторую – столько же раствора купрум (ΙΙ) нитрата. В первую пробирку опусти кусочек меди, во вторую – кусочек свинца.
Опыт 2. Воздействия металлов с растворами кислот.
Возьмем три чистые пробирки. В первую пробирку опустим кусочек меди, во вторую – магния, в третью – цинка. В каждую пробирку нальем по 2-3 мл разбавленного раствора сульфатной кислоты.
Опыт3. Взаимодействие металлов с водой.
Возьмите три чистых пробирки. В первую опустите кусочек меди, во вторую – магния, в третью - цинка. В каждую из пробирок налейте по 2 мл воды.
Полную информацию смотрите в файле.
Содержимое разработки
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
ГОСУДАРСТВЕННОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ДОНЕЦКИЙ ПРОФЕССИОНАЛЬНО- ПЕДАГОГИЧЕСКИЙ КОЛЛЕДЖ
Дисциплина:ХИМИЯ
ЛАБОРАТОРНАЯ РАБОТА № 3
Тема. Химические свойства металлов.
Цель: закрепить знания студентов о химических свойствах металлов, развивать познавательную активность, умение делать обоснованные выводы.
Оборудование: штатив с пробирками.
Реактивы: раствор цинка хлорида, купрум сульфата, плюмбум хлорида, плюмбум нитрата, купрум нитрата, хлоридной кислоты, сульфатной кислоты, медь, цинк, свинец.
С правилами техники безопасности ознакомлен: ____________________
Опыт 1. Сравнение химической активности металлов.
Запишите химическую реакцию в молекулярной форме и ионной форме
Опыт 2. Воздействия металлов с растворами кислот.
Опыт3. Взаимодействие металлов с водой.
В тех пробирках, где не произошло никаких изменений, нагрейте.
Сделайте общий вывод:
Какие химические свойства металлов вы рассмотрели в ходе лабораторной работы?
Приведите в порядок своё рабочее место.

-82%
Практическая работа по химии «Определение эквивалента металла»
В рамках профильного и углубленного изучения химии предлагаю рассмотреть закон эквивалентов и провести соответствующую лабораторную работу по определению эквивалента неизвестного металла.
Лабораторная (практическая) работа это важная часть процесса обучения, особенно в случае некоторых предметах, так как физика, химия, биология. Любая лабораторная работа проводиться в условиях лаборатории в виде опыта, на фоне которого ведется анализ в процессе определенного исследования. Проведение практических опытов позволяет наглядно объяснить материал. Доказано практикой, что проведение опытов существенно увеличивает интерес учащихся по отношении к процессу обучения.
Лабораторные занятия это практические занятия по предмету, и проводятся они после освоением теоретической части. Важно обладать теоретическими знаниями для того, чтобы начинать проводить лабораторную работу. Это позволит осуществить все правильно и не отвлекаться от процесса. Знание теории также позволит теоретическим знаниям подтверждаться и формулировать правильные выводы.
Польза лабораторных работ заключается в том, что школьники сами видят, как теория подтверждается на практике. Это может их заинтересовать и поддерживать желание учиться и приобретать знания самостоятельно, как того требует ФГОС.
Для успешного выполнения лабораторной работы необходимо:
- повторить материал по теме, чтобы убедиться в том, что вы обладаете достаточными теоретическими знаниями;
- убедиться в том, что есть все необходимое для проведения эксперимента;
- ознакомиться с методической частью проведения эксперимента;
- обязательно учитывать все правила инструкции по проведению лабораторных работ;
- использовать таблицы и схемы для составления отчета по лабораторной работе;
- можете использовать готовые лабораторные работы для того, чтобы научиться правильно, излагать выводы.
Очень важно соблюдать правила безопасности при проведении экспериментов, что позволит сохранить здоровье, а также целость и сохранность лабораторного оборудования. После проведения любых экспериментов необходимо привести в порядок рабочее место. При проведении уборки рабочего места также нужно следовать правилам ТБ.
В рамках профильного и углубленного изучения химии в 11 классе предлагаю рассмотреть закон эквивалентов и провести соответствующую лабораторную работу по определению эквивалента неизвестного металла.
Лабораторная работа
Определение молярной массы эквивалента металла
Цель работы: определение молярной массы эквивалента металла методом вытеснения водорода из кислоты.
Эквивалент – это реальная или условная частица вещества, которая равноценна (эквивалентна) одному иону водорода в данной кислотно - основной реакции или одному электрону в окислительно - восстановительной реакции.
Используется также другое определение эквивалента: эквивалентом вещества называется реальная или условная частица этого вещества, которая взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
Для определения молярных масс эквивалентов простых и сложных веществ удобно использовать понятие фактор эквивалентности (fэкв). Фактором эквивалентности для вещества называется число, показывающее, какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H + в реакциях обмена или одному электрону в окислительно - восстановительной реакции.
Весь материал – смотрите документ.
Рассохин Р.В, учитель химии ВКК, победитель конкурса лучших учителей ПНПО в 2014 г.
ПРАКТИЧЕСКАЯ (ЛАБОРАТОРНАЯ) РАБОТА ПО ХИМИИ В 11 КЛАССЕ (ПРОФИЛЬ)
«ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА МЕТАЛЛА»
Польза лабораторных работ заключается в том, что школьники сами видят, как теория подтверждается на практике. Это может их заинтересовать и поддерживать желание учиться и приобретать знания самостоятельно, как того требует ФГОС.
Для успешного выполнения лабораторной работы необходимо:
Лабораторная работа
Определение молярной массы эквивалента металла
Цель работы: определение молярной массы эквивалента металла методом вытеснения водорода из кислоты.
Эквивалент – это реальная или условная частица вещества, которая равноценна (эквивалентна) одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Используется также другое определение эквивалента: эквивалентом вещества называется реальная или условная частица этого вещества, которая взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
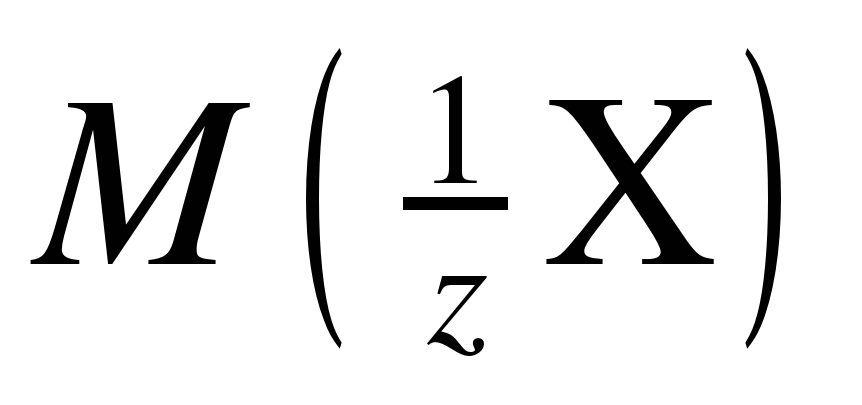
Для определения молярных масс эквивалентов простых и сложных веществ удобно использовать понятие фактор эквивалентности (fэкв). Фактором эквивалентности для вещества называется число, показывающее, какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода H + в реакциях обмена или одному электрону в окислительно-восстановительной реакции.
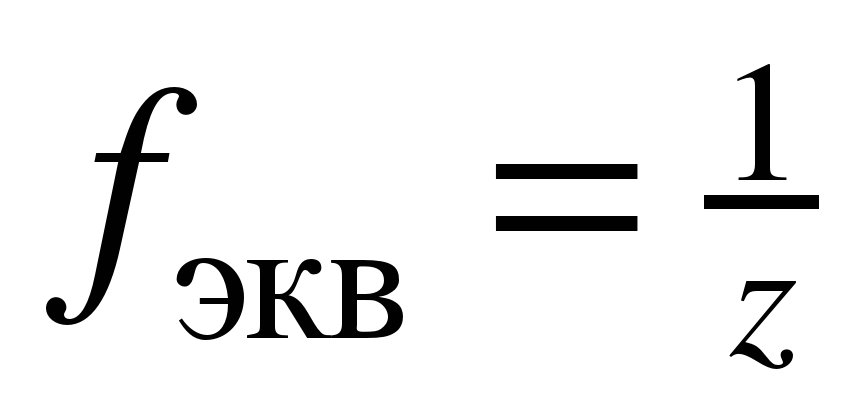
, (1)
где z – число эквивалентности.
Значение молярной массы эквивалента вещества можно рассчитать по формуле:
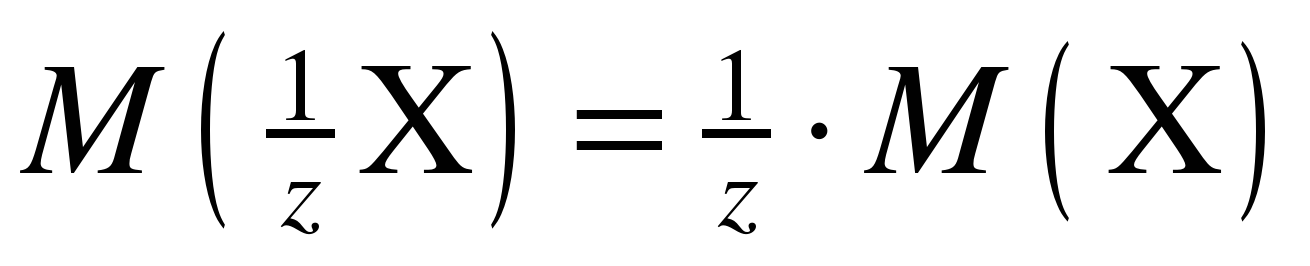
, (2)
Вычисление молярных масс эквивалентов проводятся с использованием следующих формул:
а) для простых веществ и элементов в соединениях
МЭ = М / В (В - валентность элемента)
б) для кислот или оснований МЭ = М / n (n - основность кислоты или кислотность основания, т.е. число ионов Н + или ОН - )
в) для оксидов и солей МЭ = М / p q ( p - число атомов металла; q - валентность металла).
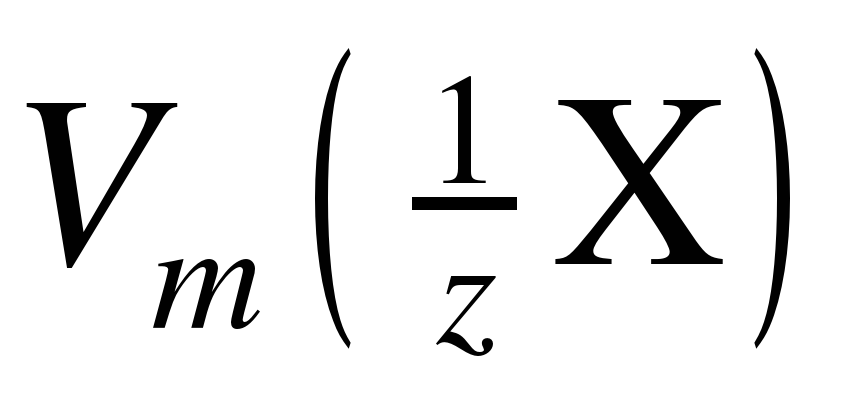
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента , который представляет собой объем одного моль эквивалентов газообразного вещества.
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г. Используя следствие из закона Авогадро, нетрудно рассчитать объем, занимаемый одним эквивалентом водорода. Аналогично рассчитаем эквивалентный объем для кислорода.
Эквивалентные объёмы водорода и кислорода, измеренные при н.у.:
Vэкв(Н2) = 22,4 : 2 = 11,2 л/моль,
Vэкв(О2) = 22,4 : 4 = 5,6 л/моль.
Введение в химию понятия эквивалент позволило сформулировать закон, называемый законом эквивалентов (Рихтер 18 век, в общей форме сформулирован У. Волластоном в 1807 г.): массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов. Закон эквивалентов можно записать в следующем виде:
или , (3)
где, m(X) и m(Y) – массы взаимодействующих веществ, и – молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием молярный объем эквивалента и следующей формулировкой закона эквивалентов: объемы реагирующих друг с другом веществ пропорциональны молярным объемам их эквивалентов:
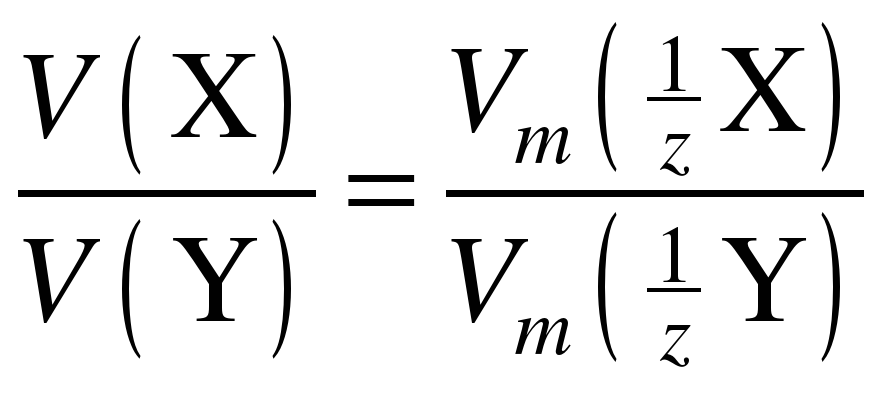
, (4)
где, V(X) и V(Y) – объемы реагирующих газообразных веществ, и – молярные объемы их эквивалентов.
Экспериментальное определение молярной массы эквивалента вещества выполняется прямым или косвенным способом. Прямое определение основано на точном измерении масс взаимодействующих веществ при известной молярной массе эквивалента одного из них.
Косвенное определение основано или на сравнении массовых долей элементов, входящих в полученное соединение, или на измерении массы или объема газообразных продуктов реакции. Например, молярную массу эквивалента активного металла определяют методом вытеснения водорода из кислоты, который основан на измерении объема водорода, выделившегося в условиях опыта. Взаимодействие металла с кислотой в общем виде можно представить уравнением:
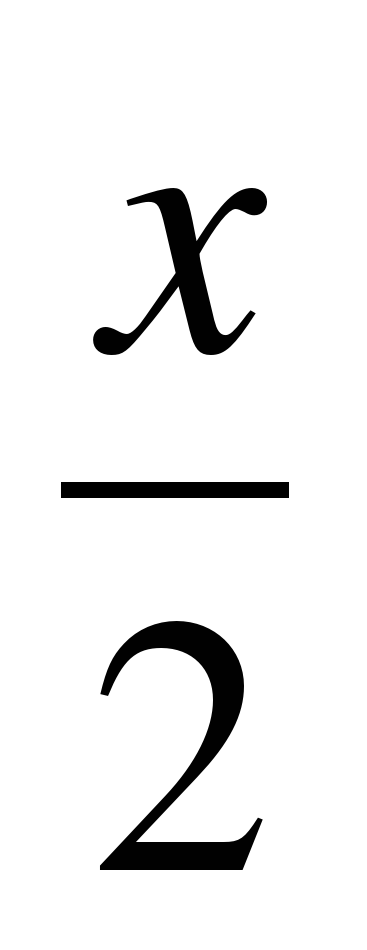
Me + xHAn = MeAnx + H2.
До проведения опыта должна быть известна масса металла, по окончании реакции измеряют объем выделившегося водорода и рассчитывают молярную массу эквивалента металла, используя закон эквивалентов.
Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из кислоты представлена на рис.1. Он состоит из двух бюреток, закрепленных в штативе и соединенных между собой резиновой трубкой. К одной из бюреток присоединена стеклянная трубка с резиновой пробкой. К ней подбирается и присоединяется пробирка, в которой осуществляется реакция.
Рис. 1. Прибор для определения молярной массы эквивалента металла:
1 – бюретка 1; 2 – бюретка 2; 3 – пробирка.
Выполнение работы
1. Получите прибор и заполните бюретки наполовину дистиллированной водой с помощью воронки и стаканчика (бюретки со штатива не снимать и не двигать!).
2. Проверьте прибор на герметичность, поскольку результат работы зависит от точности измерения объема выделяющегося газа. Для этого подберите пробирку к резиновой пробке на стеклянной трубке и плотно присоедините ее к ней (круговыми движениями!). Чтобы создать давление в приборе, бюретку 2 поднимите на 10-15 см выше бюретки 1 (с помощью зажима на штативе, а не на бюретке!). Закрепите бюретку в этом положении, запомните показания уровней воды в бюретках (они должны быть разные) и, если в течение нескольких минут разность уровней не изменяется, то прибор герметичен. Если же происходит выравнивание уровней жидкости в бюретках, то следует проверить все места соединений, плотнее присоединить пробирку или поменять прибор и еще раз провести проверку на герметичность.
3. Отсоедините пробирку и верните бюретки в исходное положение (с помощью зажима на штативе, а не на бюретке!).
4. Получите у преподавателя пакетик с неизвестным металлом, масса точно взвешенного металла (до четвертого знака!) указана на пакетике, запишите ее в лабораторную тетрадь.
5. Разверните пакетик над листом бумаги (аккуратно, чтобы не рассыпать металл!) и перенесите содержимое на кусочек папиросной бумаги, в которую заверните навеску металла.
6. В пробирку, снятую с прибора, залейте 10%-ный раствор соляной кислоты на 1/3 часть объема.
7. Пакетик с металлом смочите дистиллированной водой и прикрепите его к внутренней стенке пробирки (пакетик не должен касаться кислоты!).
8. Плотно прикрепите пробирку с кислотой и пакетиком к резиновой пробке на приборе и передвижением бюретки 2 установите в бюретках одинаковый уровень воды, после чего снимите показания V1(нач.) и V2(нач.) (отсчет производите по нижнему мениску воды с точностью до 0,1 мл!).
9. Встряхните пробирку, и металл попадет в кислоту. Тотчас начинается выделение водорода и вода вытесняется из бюретки 1 в бюретку 2. Когда весь металл растворится, прекратится повышение уровня воды в бюретке 2. После охлаждения прибора до комнатной температуры (через 10-15 мин.) следует снова установить одинаковый уровень воды в бюретках (чтобы привести газ к атмосферному давлению), поле чего снимите показания V1(конеч.) и V2(конеч.).
Экспериментальные данные
Масса металла m, г.
Показания до проведения реакции V1(нач.) и V2(нач.), мл.
Показания после проведения реакции V1(конеч.)и V2(конеч.), мл.
Объем выделившегося водорода V(H2) = Vконеч. – Vнач., мл.
Температура опыта t, о C и T, K.
Атмосферное давление P, мм рт. cт.
Парциальное давление водорода p(H2) = P – p(H2O).
Давление насыщенного пара воды p(H2O) находят по таблице 1.
Практическая работа №2 По теме: «Общие свойства металлов и их соединений».
методическая разработка по химии по теме
Практическая работа №2
По теме: «Общие свойства металлов и их соединений».
Цель работы: изучение химических свойств металлов и их соединений.
- Закрепить знания о химических свойствах металлов: взаимодействие металлов с растворами кислот и солей.
- Экспериментальным путем убедиться в различной химической активности металлов, доказать, что более активные металлы восстанавливают менее химически активные из водных растворов их солей.
- Изучить общие свойства амфотерных гидроксидов.
- Изучить общие свойства нерастворимых оснований.
- Отработать навыки экспериментальной работы согласно правилам техники безопасности.
Краткие теоретические сведения.
Металлы в периодической системе находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном уровне, как правило, не превышающее трёх. Атомы металлов легко отдают электроны и являются хорошими восстановителями.
Металлы по их активности расположены в ряд, называемый электрохимическим рядом напряжений металлов.
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Au
Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода, могут вытеснять его из растворов кислот, а всякий металл, стоящий ближе к началу ряда, может вытеснять (восстанавливать) последующие из растворов их солей.
1.Металлы, расположенные в начале ряда - от лития до магния –восстанавливают водород из воды с образованием щелочи:
2Na + 2HOH 2NaOH + H 2 ↑.
2. Металлы менее активные (от марганца до железа), восстанавливая из воды водород, образуют оксиды:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 ↑.
3.Металлы реагируют с кислотами. Взаимодействие металлов зависит от их активности (см. электрохимическим рядом напряжений металлов) и от концентрации кислоты:
а) кислоты HCl, H 3 PO 4 , H 2 SO 4(разб.) реагируют со всеми металлами (кроме Pb), которые стоят в ряду напряжений до водорода, при этом выделяется водород;
Zn + 2HCl ZnCl 2 + H 2 ↑.
б) концентрированная H 2 SO 4 при нагревании реагирует со всеми металлами (кроме Pt и Au), при этом водород не выделяется; с тяжелыми (плотность > 5 г/ см 3 ) металлами образует газ SO 2 (оксид серы (IV)); с более активными легкими (плотность 3 ) металлами выделяется H 2 S (сероводород):
Cu +2H 2 SO 4 (конц) CuSO 4 + 2H 2 O + SO 2 ↑.
в) концентрированная НNO 3 c щелочными и щелочноземельными металлами образует газ N 2 O – оксид азота (IV), с другими тяжелыми металлами – оксид азота (IV) NO 2 :
Ca + 10HNO 3(конц.) → Ca(NO 3 ) 2 + N 2 O + 5 H 2 O
Cu + 4HNO 3(конц.) → Cu(NO 3 ) 2 + NO 2 + 2 H 2 O
г) разбавленная НNO 3 взаимодействует c щелочными и щелоч-ноземельными металлами, а также с Zn, Fe, Sn, при этом выделяется газ NH 3 (аммиак) или образуется соль аммония (NH 3 + НNO 3 =NH 4 NO 3 ), при реакции с остальными металлами (плотность > 5 г/ см 3 ) образуется оксид азота (II) NO:
Ca + 10HNO 3(разб.) → 4Ca(NO 3 ) 2 + NH 4 NO 3 + 3 H 2 O
Cu + 4HNO 3(разб.) → 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
д) кислоты H 2 CO 3 ,H 2 SO 3 , CH 3 COOH – слабые, взаимодействуют с активными металлами:
2 CH 3 COOH + 2Na → 2CH 3 COONa + H 2
4. Каждый последующий металл может быть восстановлен из раствора соли предыдущим металлом: Fe + CuSO 4 FeSO 4 + Cu.
Переходные металлы расположены в Периодической системе с 4 по 7 период. Переходные металлы, символы которых расположены в самой таблице, называют d-элементами, а те элементы, символы которых расположены в нижней части Периодической системы, называют лантаноидами и актиноидами или f-элементами.
Амфотерные оксиды - оксиды переходных металлов.
1. Амфотерные оксиды не растворяются в воде.
2. Амфотерные оксиды, реагируя с основными и с кислотными оксидами, дают соли:
Al 2 O 3 + K 2 O 2KAlO 2 ,
Al 2 O 3 + 3SO 3 Al 2 (SO 4 ) 3 .
3. Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH K 2 ZnO 2 + H 2 O,
ZnO + H 2 SO 4 ZnSO 4 + H 2 O
4. Соответствующие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH) 2 Zn 2+ + 2OH - - как основание
H 2 ZnO 2 2H + + ZnO 2 2- - как кислота
Амфотерные гидроксиды - это такие гидроксиды, где растворенная в воде часть, диссоциирует на катионы водорода, металла и анионы гидроксида и кислотного остатка.
Zn(OH) 2 ⇆ Zn 2+ + 2OH - , H 2 ZnO 2 ⇆ 2H + + ZnO 2 2-
1.Взаимодействием переходных металлов (после удаления оксидной пленки) с водой:
2Al + 6H2O = 2Al(OH) 3 + 3H 2 ↑
2.Взаимодействие солей со щелочами:
ZnCl 2 + 2KOH Zn(OH) 2 + 2KCl
3. Взаимодействием солей с кислотами:
Na[Al(OH) 4 ] + HCl Al(OH) 3 + NaCl + H 2 O
1. Диссоциирует на ионы растворенная в воде часть амфотерного гидроксида: Zn(OH) 2 ⇆ Zn(OH) + + OH - ⇆ Zn 2+ + 2OH -
H 2 ZnO 2 ⇆ HZnO 2- + H + ⇆ZnO 2 2- + 2H +
2. Взаимодействие с кислотными оксидами, кислотами и кислыми солями:
2Cr(OH) 3 + 3SO 3 Cr 2 (SO 4 ) 3 + 3H 2 O
Al(OH) 3 + 3HBr AlBr 3 + 3H 2 O
Zn(OH) 2 + 2NaHSO 4 ZnSO 4 + Na 2 SO 4 + 2H 2 O
3. Взаимодействуют с основными оксидами, основаниями и основными солями:
Zn(OH) 2 + Li 2 O Li 2 ZnO 2 + H 2 O
Zn(OH) 2 + Ba(OH) 2 BaZnO 2 + 2H 2 O
4. Подвергаются разложению при нагревании:
2Al(OH) 3 Al 2 O 3 + 3H 2 O
Приборы и реактивы:
- штатив с пробирками, пипетка, держатель для пробирок, спиртовки, спички, стеклянная палочка.
- растворы: серной кислоты, гидроксида натрия; растворы солей: сульфат меди (II),хлорид цинка, сульфат алюминия, сульфат натрия; кусочки: цинка, меди.
Порядок выполнения работы.
Опыт № 1. Взаимодействие металлов с растворами кислот.
Ход работы: В три пробирки положить: в первую кусочек магния, во вторую – гранулу цинка, в третью – медь (кусочек проволоки). Прилить во все пробирки 1 мл раствора серной кислоты.
Записать наблюдения в таблицу «Оформление отчета». Сравнить скорость происходящих реакций. Почему в одной из пробирок реакция не идёт? Дать объяснение. Записать уравнения реакций в молекулярном и ионном видах.
Опыт № 2. Взаимодействие металлов с солями.
Ход работы: В одну пробирку положить одну гранулу цинка и прилить раствор медного купороса, во вторую – кусочек медной проволоки и прилить раствор сульфата натрия.
Записать наблюдения в таблицу «Оформление отчета». Составить схему электронного баланса в окислительно–восстановительных реакциях.
Опыт № 3. Получение гидроксида цинка и испытание его амфотерных свойств.
Ход работы: В две пробирки налить по 5-6 капель раствора соли цинка и очень аккуратно по каплям добавить в них раствор щелочи до появления осадка.
Затем в одну пробирку добавить 2-3 капли раствора серной кислоты.
В другую пробирку добавить избыточное количество щелочи (до растворения осадка).
Записать наблюдения в таблицу «Оформление отчета». Составить уравнения реакций в молекулярном и ионном виде.
Опыт № 4. Получение гидроксида меди и изучение его свойств
Ход работы: Из имеющихся реактивов получить гидроксид меди (II). Указать цвет осадка. Нагреть полученное вещество.
Записать наблюдения в таблицу «Оформление отчета». Что произойдет с осадком при нагревании?
Читайте также:
