Лантаноиды и актиноиды это металлы
Обновлено: 07.07.2024
Лантано́иды (лантани́ды) — семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы Менделеева за лантаном и сходных с ним по свойствам. Располагаются в отдельном ряду внизу Периодической системы химических элементов Д. И. Менделеева (в краткой и полудлинной формах таблицы). В атоме лантаноидов заполняется глубоко лежащий четвертый слой 4f 14 . Поэтому лантаноидов может быть только 14. Поскольку по мере увеличения заряда ядра структура двух внешних электронных оболочек не меняется, все лантаноиды имеют сходные химические свойства. [1]
Включают в себя: церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций. Вместе с лантаном, скандием и иттрием входят в состав редкоземельных элементов. Лантаноиды условно разделяются на 2 подгруппы: цериевую, включающую элементы от церия до европия, и иттриевую, включающую элементы от гадолиния до лютеция.
В природе лантаноиды сопутствуют друг другу. Выделение отдельных элементов является очень трудной задачей ввиду большого сходства их свойств. «Иттриевые земли» были открыты Ю. Гадолином еще в 1794 г. в минерале, найденном в Швеции (близ Иттербю) и названном гадолинитом. В 1803 г. М. Клапрот и одновременно Я. Берцелиус выделили новую, «цериевую землю». На протяжении последующих лет были открыты и выделены из иттриевых и цериевых земель все лантаноиды, кроме радиоактивного элемента № 61 (прометия), практически отсутствующего в природе. Элемент № 72, который к ним не относится, много лет безрезультатно искали среди лантаноидов. Однако Нильс Бор, исходя из разработанной схемы строения атома указал, что элемент № 72 — аналог циркония. Только после этого гафний был обнаружен в циркониевых рудах. Название, как и «актиноиды», было предложено в 1948 году профессором ЛГУ С. А. Щукаревым.
Все лантаноиды и лантан — металлы серебристо-белого цвета, пластичны и легко поддаются ковке, прокатке. Лантаноиды химически активны, они образуют прочные оксиды, галогениды, сульфиды, реагируют с водородом, углеродом, азотом, фосфором. Разлагают воду, растворяются в соляной, серной и азотной кислотах. В плавиковой и фосфорной кислотах лантаноиды устойчивы, так как покрываются защитными пленками малорастворимых солей. С рядом органических соединений лантаноиды образуют комплексные соединения. Важное значение для разделения лантаноидов имеют комплексы с лимонной и этилендиаминтетрауксусной кислотой. В промышленности лантаноиды и лантан получают восстановлением соответствующих галогенидов чистым кальцием или электролизом расплавов. Лантаноиды и лантан применяют как добавки к сталям, чугунам и другим сплавам для улучшения механической стойкости, коррозионной устойчивости и жаропрочности. Используют лантаноиды и лантан для получения специальных сортов стекла, в атомной технике. Соединения лантан, а также лантаноидов используют для изготовления лаков и красок, светящихся составов, в производстве кожи, в текстильной промышленности, в радиоэлектронике для изготовления катодов. Соединения лантаноидов применяются в лазерах.
Содержание
Мнемонические правила
Для того, чтобы запомнить порядок элементов, входящих в семейство лантаноидов, существует несколько мнемонических фраз на английском языке.
- Ladies can`t put nickels properly in slot machines. Every girl tries daily however every time you look.
- Last case pineapples not produces since Elizabeth got terrible dysentery having eaten two yellow lemones.
Первые буквы слов в этих фразах соответствуют химическим символам лантаноидов.
Лантаноиды и актиноиды: положение в периодической системе
Каждый из химических элементов, представленный в оболочках Земли: атмосфере, литосфере и гидросфере - может служить ярким примером, подтверждающим фундаментальное значение атомно-молекулярного учения и периодического закона. Они были сформулированы корифеями естествознания – русскими учеными М. В. Ломоносовым и Д. И. Менделеевым. Лантаноиды и актиноиды – это два семейства, которые содержат по 14 химических элементов, а также сами металлы – лантан и актиний. Их свойства - как физические, так и химические - будут рассмотрены нами в данной работе. Кроме этого, мы установим, как положение в периодической системе водорода, лантаноидов, актиноидов зависит от строения электронных орбиталей их атомов.
История открытия
В конце 18 столетия Ю. Гадолином было получено первое соединение из группы редкоземельных металлов – оксид иттрия. До начала 20 столетия благодаря исследованиям Г. Мозли в химии стало известно о существовании группы металлов. Они располагались в периодической системе между лантаном и гафнием. Еще один химический элемент – актиний, подобно лантану, образует семейство из 14 радиоактивных химических элементов, названных актиноидами. Их открытие в науке произошло, начиная с 1879 года до середины 20 века. Лантаноиды и актиноиды имеют достаточно много черт сходства как в физических, так и в химических свойствах. Это можно объяснить расположением электронов в атомах этих металлов, которые находятся на энергетических уровнях, а именно для лантаноидов это четвертый уровень f-подуровень, а для актиноидов - пятый уровень f-подуровень. Далее мы рассмотрим электронные оболочки атомов вышеназванных металлов более подробно.
Строение внутренних переходных элементов в свете атомно-молекулярного учения
Гениальное открытие строения химических веществ М. В. Ломоносова явилось основой для дальнейшего изучения электронных оболочек атомов. Резерфордовская модель строения элементарной частицы химического элемента, исследования М. Планка, Ф. Гунда позволили ученым-химикам найти правильное объяснение существующим закономерностям периодического изменения физических и химических свойств, которыми характеризуются лантаноиды и актиноиды. Нельзя обойти вниманием и важнейшую роль периодического закона Д. И. Менделеева в изучении строения атомов переходных элементов. Остановимся на этом вопросе более детально.
Место внутренних переходных элементов в периодической системе Д. И. Менделеева
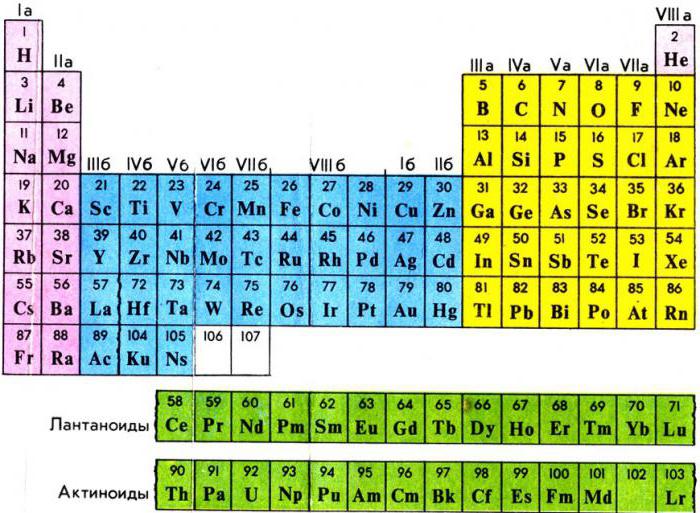
В третьей группе шестого – большего периода - за лантаном находится семейство металлов, расположенных от церия и до лютеция включительно. У атома лантана 4f-подуровень пустой, а у лютеция полностью наполнен 14-ю электронами. У элементов, расположенных между ними, идет постепенное заполнение f-орбиталей. В семействе актиноидов – от тория до лоуренсия - соблюдается тот же принцип накопления отрицательно заряженных частиц с единственным отличием: заполнение электронами происходит на 5f-подуровне. Строение же внешнего энергетического уровня и количество отрицательных частиц на нем (равное двум) у всех вышеперечисленных металлов одинаково. Данный факт отвечает на вопрос о том, почему лантаноиды и актиноиды, названные внутренними переходными элементами, имеют много черт сходства.

В некоторых источниках химической литературы представителей обоих семейств объединяют во вторые побочные подгруппы. В них содержится по два металла из каждого семейства. В короткой форме периодической системы химических элементов Д.И Менделеева представители этих семейств выделены из самой таблицы и расположены отдельными рядами. Поэтому положение лантаноидов и актиноидов в периодической системе отвечает общему плану строения атомов и периодичности заполнения электронами внутренних уровней, а присутствие одинаковых степеней окисления послужило причиной объединения внутренних переходных металлов в общие группы. В них химические элементы обладают признаками и свойствами, равнозначными лантану или актинию. Вот почему лантаноиды и актиноиды вынесены из таблицы химических элементов.
Как электронная конфигурация f-подуровня влияет на свойства металлов
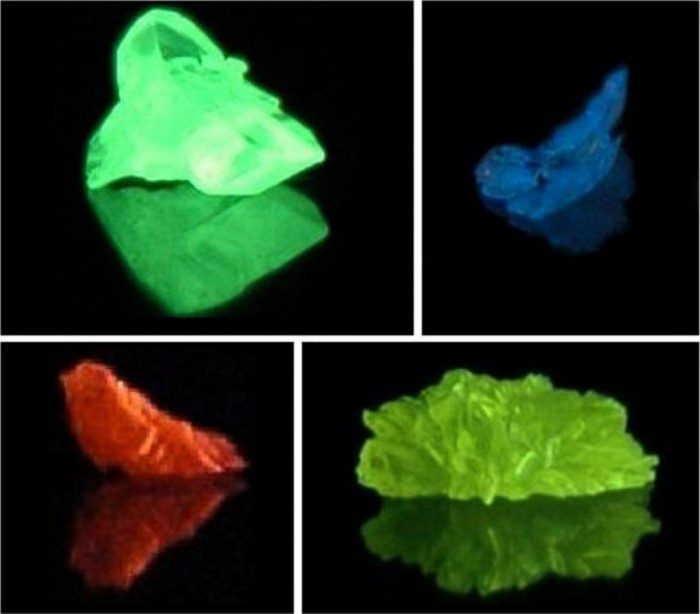
Как мы уже говорили ранее, положение лантаноидов и актиноидов в периодической системе напрямую определяет их физические и химические характеристики. Так, ионы церия, гадолиния и других элементов семейства лантаноидов имеют высокие магнитные моменты, что связано с особенностями строения f-подуровня. Это позволило использовать металлы в качестве легирующих добавок для получения полупроводников с магнитными свойствами. Сульфиды элементов семейства актиния (например, сульфид протактиния, тория) в составе своих молекул имеют смешанный тип химической связи: ионно-ковалентный или ковалентно-металлический. Эта особенность строения привела к появлению нового физико-химического свойства и послужила ответом на вопрос о том, почему лантаноиды и актиноиды обладают люминесцентными свойствами. Например, образец актиния серебристого цвета в темноте светится голубоватым свечением. Это объясняется действием на ионы металлов электрического тока, фотонов света, под влиянием которых происходит возбуждение атомов, а электроны в них «перескакивают» на более высокие энергетические уровни и затем возвращаются на свои стационарные орбиты. Именно по этой причине лантаноиды и актиноиды относятся к люминофорам.
Последствия уменьшения ионных радиусов атомов
У лантана и актиния, как и у элементов из их семейств, наблюдается монотонное снижение величины показателей радиусов ионов металлов. В химии в таких случаях принято говорить о лантаноидном и актиноидном сжатии. В химии установлена следующая закономерность: с увеличением заряда ядра атомов, в случае если элементы относятся к одному и тому же периоду, их радиусы уменьшаются. Объяснить это можно следующим образом: у таких металлов, как церий, празеодим, неодим, количество энергетических уровней в их атомах неизменно и равно шести. Однако заряды ядер соответственно увеличиваются на единицу и составляют +58, +59, +60. Это значит, что возрастает сила притяжения электронов внутренних оболочек к положительно заряженному ядру. Как следствие происходит уменьшение радиусов атомов. В ионных соединениях металлов с увеличением порядкового номера ионные радиусы также уменьшаются. Аналогичные изменения наблюдаются и у элементов семейства актиния. Вот почему лантаноиды и актиноиды называют близнецами. Уменьшение радиусов ионов приводит в первую очередь к ослаблению основных свойств гидроксидов Се(ОН)3, Pr(OH)3, а основание лютеция уже проявляет амфотерные свойства.
К неожиданным результатам приводит заполнение 4f-подуровня неспаренными электронами до половины орбиталей у атома европия. У него радиус атома не уменьшается, а, наоборот, увеличивается. У следующего за ним в ряду лантаноидов гадолиния на 5d-подуровне появляется один электрон 4f-подуровня аналогично Eu. Такое строение вызывает скачкообразное уменьшение радиуса атома гадолиния. Подобное явление наблюдается в паре иттербий – лютеций. У первого элемента радиус атома большой по причине полного заполнения 4f-подуровня, а у лютеция он скачкообразно уменьшается, так как на 5d-подуровне наблюдается появление электронов. У актиния и других радиоактивных элементов этого семейства радиусы их атомов и ионов изменяются не монотонно, а, так же как и у лантаноидов, скачкообразно. Таким образом, лантаноиды и актиноиды являются элементами, у которых свойства их соединений коррелятивно зависят от ионного радиуса и строения электронных оболочек атомов.
Валентные состояния
Лантаноиды и актиноиды являются элементами, чьи характеристики достаточно сходны. В частности, это касается их степеней окисления в ионах и валентности атомов. Например, торий и протактиний, проявляющие валентность, равную трём, в соединениях Th(OH)3, PaCl3, ThF3, Pa2(CO3)3. Все эти вещества являются нерастворимыми и имеют те же химические свойства, что и металлы из семейства лантана: церий, празеодим, неодим и т. д. Лантаноиды в этих соединениях также будут трехвалентными. Эти примеры еще раз доказывают нам правильность утверждения, что лантаноиды и актиноиды – близнецы. Они обладают сходными физическими и химическими свойствами. Это можно объяснить прежде всего строением электронных орбиталей у атомов обоих семейств внутренних переходных элементов.
Металлические свойства
Все представители обеих групп являются металлами, у которых достраиваются 4f-, 5f-, а также d-подуровни. Лантан и элементы его семейства называют редкоземельными. Их физические и химические характеристики настолько близки, что по отдельности в лабораторных условиях они разделяются с большим трудом. Проявляя чаще всего степень окисления +3, элементы ряда лантана имеют много сходных черт со щелочноземельными металлами (барием, кальцием, стронцием). Актиноиды также являются чрезвычайно активными металлами, к тому же еще и радиоактивными.
Особенности строения лантаноидов и актиноидов касаются и таких свойств, как, например, пирофорность в мелкодисперсном состоянии. Наблюдается также уменьшение размеров гранецентрированных кристаллических решеток металлов. Добавим, что все химические элементы обоих семейств – это металлы с серебристым блеском, из-за высокой реакционной способности быстро темнеющие на воздухе. Они покрываются пленкой соответствующего оксида, защищающей от дальнейшего окисления. Все элементы достаточно тугоплавки, за исключением нептуния и плутония, температура плавления которых значительно ниже 1000 °С.
Характерные химические реакции
Как было отмечено ранее, лантаноиды и актиноиды являются химически активными металлами. Так, лантан, церий и другие элементы семейства легко соединяются с простыми веществами – галогенами, а также с фосфором, углеродом. Лантаноиды могут также взаимодействовать как с монооксидом углерода, так и с углекислым газом. Они также способны разлагать воду. Кроме простых солей, например таких как SeCl3 или PrF3, они образуют двойные соли. В аналитической химии важное место занимают реакции металлов-лантаноидов с аминоуксусной и лимонной кислотами. Образующиеся в результате таких процессов комплексные соединения применяются для разделения смеси лантаноидов, например в рудах.

При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли. Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография.
У актиноидов можно выделить две группы элементов. Это берклий, фермий, менделевий, нобелий, лоуренсий и уран, нептуний, плутоний, омереций. Химические свойства первой из них подобны лантану и металлам из его семейства. Элементы второй группы обладают очень похожими химическими характеристиками (практически идентичны друг другу). Все актиноиды быстро взаимодействуют с неметаллами: серой, азотом, углеродом. С кислородсодержащими легандами они образуют комплексные соединения. Как видим, металлы обоих семейств близки между собой по химическому поведению. Вот почему лантаноиды и актиноиды часто называют металлами-близнецами.
Положение в периодической системе водорода, лантаноидов, актиноидов
Нужно учитывать тот факт, что водород является достаточно реакционноспособным веществом. Он проявляет себя в зависимости от условий химической реакции: как восстановителем, так и окислителем. Именно поэтому в периодической системе водород располагается одновременно в главных подгруппах сразу двух групп.

В первой водород играет роль восстановителя, как и щелочные металлы, расположенные здесь. Место водорода в 7-й группе наряду с элементами галогенами указывает на его восстановительную способность. В шестом периоде находится, как уже ранее было сказано, семейство лантаноидов, вынесенное в отдельный ряд для удобства и компактности таблицы. Седьмой период содержит группу радиоактивных элементов, по своим характеристикам подобным актинию. Актиноиды располагаются вне таблицы химических элементов Д.И Менделеева под рядом семейства лантана. Эти элементы наименее изучены, так как ядра их атомов очень неустойчивы по причине радиоактивности. Напомним, что лантаноиды и актиноиды относятся к элементам внутренним переходным, а их физико-химические характеристики очень близки между собой.
Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Где применяют внутренние переходные элементы
Спектр использования изучаемых нами металлов достаточно широк. Для семейства актиния – это, прежде всего, ядерное оружие и энергетика. Важное значение имеют актиноиды и в медицине, дефектоскопии, активационном анализе. Нельзя обойти вниманием применение лантаноидов и актиноидов в качестве источников захвата нейтронов в ядерных реакторах. Лантаноиды же применяют в качестве легирующих добавок к чугуну и стали, а также в производстве люминофоров.
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.

Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
Лантаноиды и актиноиды это металлы
Видео: Лантаноиды (часть 1) минералы, оксиды, хлориды. Химия – Просто
Основная разница - Лантаноиды против Актиноидов
Лантаноиды и актиноиды являются химическими элементами, которые присутствуют в рядах лантаноидов и актиноидов периодической таблицы соответственно. Эти элементы известны как элементы блока f. Это потому, что их валентные электроны находятся на орбите своих атомов. Все лантаноиды и актиноиды являются металлами. Их также называют внутренними переходными металлами. Это потому, что их внешние f-орбитали защищены другими орбиталями. Этим элементам даны названия как таковые, поскольку ряд актинидов начинается с химического вещества, называемого актинием, а ряд лантаноидов начинается с химического элемента, называемого лантаном. Основное различие между актинидами и лантаноидами заключается в том, что актиниды могут легко образовывать комплексы, тогда как лантаноиды не образуют комплексов легко.
Ключевые области покрыты
1. Что такое лантаноиды
- Определение, химические реакции и свойства
2. Что такое актиноиды
- определение, химические свойства
3. В чем разница между лантаноидами и актиноидами
- Сравнение основных различий
Ключевые слова: актиноиды, актиний, блочные элементы F, металлы внутреннего перехода, лантаноиды, лантаноиды, лантан
Что такое лантаноиды
Лантаноиды - это химические элементы, которые можно найти в серии лантаноидов блока f в периодической таблице элементов. Лантаноиды нерадиоактивны, за исключением прометия. Поскольку атомные номера лантаноидов находятся в диапазоне от 57 до 71, они также состоят из сравнительно больших атомов. Валентные электроны лантаноидов находятся на 4f орбитали. Их также называют Лантаноиды.
Лантаноиды являются металлами и имеют яркий и серебристый вид. Они очень мягкие и даже могут быть порезаны ножом. Элементы лантана, церия, празеодима, неодима и европия серии лантаноидов обладают высокой реакционной способностью по сравнению с другими элементами. Когда эти металлы подвергаются воздействию воздуха, они образуют покрытия из оксидов. По этой причине они запятнаны.
Лантаноиды быстро реагируют с горячей водой, но медленно с холодной водой. Когда эти металлы загрязнены другими металлами, такими как кальций, они быстро разъедают. Но когда лантаноиды загрязняются неметаллами, такими как азот и кислород, они становятся хрупкими. Эти загрязнения изменяют температуру кипения лантаноидов.
Лантаноиды быстро растворяются в кислотах. Они могут реагировать с кислородом и галогенидами, но медленно. Наиболее заметное состояние окисления лантаноидов - +3. Другие состояния окисления, которые показывают Лантаноиды, +2 и +4. Но они не могут иметь степень окисления +6. Следовательно, они не могут образовывать сложные молекулы. Лантаноиды не образуют оксокатионов, таких как оксиды и гидроксиды. Молекулы, образованные лантаноидами, являются менее основными.
Рисунок 1: нитраты лантаноидов
Почти все ионы, образованные лантаноидами, бесцветны. Лантаноиды являются электроположительными элементами. Поэтому они предпочитают формировать молекулы с электроотрицательными элементами. Тем не менее, изменения в химических и физических свойствах очень меньше на протяжении всей серии.
Что такое актиноиды
Актиноиды - это химические элементы, которые можно найти в серии актинидов блока f в периодической таблице элементов. Все актиноиды являются радиоактивными элементами из-за их нестабильной природы. У них нет стабильных изотопов. Эти элементы состоят из очень больших атомов. Актиноиды имеют свои валентные электроны на 5f орбитали. Серия актинидов состоит из химических элементов, имеющих атомные номера от 89 до 103.
Актиноиды высоко электроположительны. Это означает, что у них очень мало или нет сродства к электрону. Так как это очень реактивные элементы, они легко воспламеняются в воздухе. Хотя они и являются металлами, актиноиды очень мягкие. Некоторые из них можно даже порезать ножом.Все актиноиды являются парамагнитными (могут притягиваться внешним магнитным полем).
Рисунок 2: Актиниды
Наиболее распространенными и распространенными актиноидами на земле являются уран и торий. Они слабо радиоактивны и выделяют высокую энергию во время радиоактивного распада. Видное состояние окисления среди актиноидов +3. Кроме того, актиноиды показывают степени окисления, такие как +4, +5 и +6.
Актиноиды образуют основные оксиды и гидроксиды. Они обладают способностью образовывать комплексы с лигандами, такими как хлориды, сульфаты и т. Д. Большинство комплексов актиноидов являются красочными. Однако из-за радиоактивности и поведения тяжелых металлов актиноиды считаются токсичными соединениями.
Разница между лантаноидами и актиноидами
Определение
лантаноидов: Лантаноиды - это химические элементы, которые можно найти в серии лантаноидов блока f в периодической таблице элементов.
актиноидов: Актиноиды - это химические элементы, которые можно найти в серии актинидов блока f в периодической таблице элементов.
Ряды в периодической таблице
лантаноидов: Лантаноиды относятся к серии лантаноидов.
актиноидов: Актиноиды входят в серию актиноидов.
радиоактивность
лантаноидов: Лантаноиды являются нерадиоактивными элементами (кроме прометия).
актиноидов: Актиноиды являются радиоактивными элементами.
Валентные Электроны
лантаноидов: Лантаноиды имеют свои валентные электроны на 4f орбитали.
актиноидов: Актиноиды имеют свои валентные электроны на 5f орбитали.
Окислительные состояния
лантаноидов: Лантаноиды могут иметь максимум +4 степени окисления.
актиноидов: Актиноиды могут иметь максимум +6 степени окисления.
Атомные номера
лантаноидов: Лантаноиды включают элементы с атомными номерами в диапазоне от 57 до 71.
актиноидов: Актиноиды включают элементы с атомными номерами в диапазоне от 89 до 103.
Заключение
Лантаноиды и актиноиды являются f блочными элементами периодической таблицы. Они металлические, но очень мягкие. У них разные химические свойства. Основное различие между актиноидами и лантаноидами заключается в том, что актиниды могут легко образовывать комплексы, тогда как лантаноиды не образуют комплексов легко.
Ссылка:
1. Хельменстин, Энн Мари. «Получите факты о группе элементов актинидов». ThoughtCo,
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
.jpg)
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов

На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
.jpg)
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.

Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
.jpg)
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
.jpg)
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
.jpg)
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
.jpg)
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
.jpg)
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
.jpg)
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода

Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота

Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода

Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены

Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы

Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Попробовать бесплатно
Презентация по химии "Положение в ПСХЭ водорода,лантаноидов и актиноидов"(11 класс)

Лантаноиды и актиноиды.
История открытия
В конце 18 столетия Ю. Гадолином было получено первое соединение из группы редкоземельных металлов – оксид иттрия. До начала 20 столетия благодаря исследованиям
Г. Мозли в химии стало известно о существовании группы металлов. Они располагались в периодической системе между лантаном и гафнием. Еще один химический элемент – актиний, подобно лантану, образует семейство из 14 радиоактивных химических элементов, названных актиноидами. Их открытие в науке произошло, начиная с 1879 года до середины 20 века. Лантаноиды и актиноиды имеют достаточно много черт сходства как в физических, так и в химических свойствах.

Это можно объяснить расположением электронов в атомах этих металлов, которые находятся на энергетических уровнях, а именно для лантаноидов это четвертый уровень f-подуровень, а для актиноидов - пятый уровень f-подуровень.


Валентные состояния
Лантаноиды и актиноиды являются элементами, чьи характеристики достаточно сходны. В частности, это касается их степеней окисления в ионах и валентности атомов. Например, торий и протактиний, проявляющие валентность, равную трём, в соединениях Th(OH)3, PaCl3, ThF3, Pa2(CO3)3. Все эти вещества являются нерастворимыми и имеют те же химические свойства, что и металлы из семейства лантана: церий, празеодим, неодим и т. д. Лантаноиды в этих соединениях также будут трехвалентными. Эти примеры еще раз доказывают нам правильность утверждения, что лантаноиды и актиноиды – близнецы. Они обладают сходными физическими и химическими свойствами. Это можно объяснить, прежде всего, строением электронных орбиталей у атомов обоих семейств внутренних переходных элементов.

Металлические свойства
Все представители обеих групп являются металлами, у которых достраиваются 4f-, 5f-, а также d-подуровни. Лантан и элементы его семейства называют редкоземельными. Их физические и химические характеристики настолько близки, что по отдельности в лабораторных условиях они разделяются с большим трудом. Проявляя чаще всего степень окисления +3, элементы ряда лантана имеют много сходных черт со щелочноземельными металлами (барием, кальцием, стронцием). Актиноиды также являются чрезвычайно активными металлами, к тому же еще и радиоактивными. Наблюдается также уменьшение размеров гранецентрированных

Все химические элементы обоих семейств – это металлы с серебристым блеском, из-за высокой реакционной способности быстро темнеющие на воздухе. Они покрываются пленкой соответствующего оксида, защищающей от дальнейшего окисления. Все элементы достаточно тугоплавки, за исключением нептуния и плутония, температура плавления которых значительно ниже 1000°С.

При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли. Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции).


У актиноидов можно выделить две группы элементов. Это берклий, фермий, менделевий, нобелий, лоуренсий и уран, нептуний, плутоний, омереций. Химические свойства первой из них подобны лантану и металлам из его семейства. Элементы второй группы обладают очень похожими химическими характеристиками (практически идентичны друг другу). Все актиноиды быстро взаимодействуют с неметаллами: серой, азотом, углеродом. С кислородсодержащими легандами они образуют комплексные соединения. Как видим, металлы обоих семейств близки между собой по химическому поведению. Вот почему лантаноиды и актиноиды часто называют металлами-близнецами.


Актиноиды - простые вещества.
Химическая активность

Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Спектр использования изучаемых нами металлов достаточно широк. Для семейства актиния – это, прежде всего, ядерное оружие и энергетика.
Важное значение имеют актиноиды и в медицине, дефектоскопии, активационном анализе. Нельзя обойти вниманием применение лантаноидов и актиноидов в качестве источников захвата нейтронов в ядерных реакторах. Лантаноиды же применяют в качестве легирующих добавок к чугуну и стали, а также в производстве люминофоров.
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Читайте также:
