Лекарство от рака металл
Обновлено: 21.09.2024
Коллектив исследователей разработал методику лечения устойчивого к стандартной химиотерапии рака предстательной железы. Они предложили использовать «платиновый коктейль» — комбинацию из трех ранее известных препаратов на основе производных этого ценного металла. Результат оказался впечатляющим: в большинстве случаев врачам удавалось остановить распространение метастазов у пациентов с агрессивной онкологией. Однако такой метод высокотоксичен, предупреждают российские специалисты, поэтому он может применяться только для самых тяжелых больных, на которых уже не действуют другие способы лечения. По официальной статистике, рак простаты является самым часто встречающимся онкологическим заболеванием у мужчин в России.
Лечение — платина
Международная команда ученых, в состав которой вошли специалисты Дальневосточного федерального университета и Университетской клиники Гамбург-Эппендорф, доказала, что три ранее известных лекарственных препарата, если их применить в связке, превращаются в убойную комбинацию против устойчивого к стандартной химиотерапии кастрационно-резекционной (когда полностью удаляют половые органы) форме рака простаты. Они выяснили, что раковые клетки, устойчивые к химиотерапии стандартным препаратом доцетакселом (лекарство из игл тиса, которое широко применяют в химиотерапии), можно убить «тройным» ударом из цисплатина, ифосмамида, паклитаксела (таксола). Эти три препарата — производные платины. Все они давно известны онкологам, но никогда не применялись вместе.

Новый препарат будет эффективен для лечения форм заболевания, не поддающихся традиционной химиотерапии
При «платиновой» химиотерапии также используются препараты, в которых присутствует этот металл (цисплатин, фенантриплатин и другие). В этих средствах содержатся молекулы двухфазной платины. Лекарства действуют так же, как и многие другие: препятствуют делению опухолевых клеток, что приводит к их гибели и прекращению распространения линий метастазов в организме. Но бывает, что и это не помогает.
«Тройное» воздействие дает надежду пациентам старшего возраста при рецидивах опухолей, уже не поддающихся лечению. Как рассказал «Известиям» участник исследования, сотрудник лаборатории биологически активных веществ ДВФУ Сергей Дышловой, показано, что в лабораторных условиях эти лекарства очень хорошо воздействовали на клетки рака простаты, устойчивые к терапии доцетакселом.
— Рак принято лечить поэтапно: от более щадящих методов к более агрессивным. Но, как известно, болезнь способна вернуться, выработав устойчивость к предыдущему препарату и более не оставляя человеку надежды, — объяснил специалист. — Наше открытие дарит дополнительный шанс пациентам при рецидиве, когда опухоль заходит на второй или третий круг, получив «иммунитет» к стандартной терапии.
Последняя надежда
В то же время при воздействии на клеточные линии, чувствительные к доцетакселу, активность «трио» провоцирует антагонизм, когда нежелательных побочных эффектов может быть больше, чем лекарственных. Таким образом, новая комбинация потенциально станет терапией последней надежды, которая работает в тяжелых случаях и не нужна там, где действуют другие лекарства.
— Мы не разработали с нуля новый противораковый препарат, — подчеркнул Сергей Дышловой. — Важность нашего результата в том, что он прикладной: мы нащупали новую терапевтическую комбинацию на основе уже существующих средств. Возможно, это сократит время до применения комбинации в реальной клинической практике. Очень важно, что мы даем ранее неизлечимым пациентам надежду получить дополнительное время, продлить жизнь.
«Платиновый коктейль» уже испытали на первых 17 пациентах. Четверо выбыло из исследования из-за побочных эффектов, у всех остальных, кроме одного мужчины, удалось добиться значительного улучшения состояния.
На следующем этапе исследователи хотят узнать, способны ли раковые клетки со временем научиться сопротивляться новой терапевтической комбинации препаратов.
Принцип выбора
Комбинация ранее уже известных лекарственных препаратов иногда может оказывать усиленное действие, сравнимое с новым препаратом, подчеркивают специалисты ДВФУ. По их словам, это перспективное направление, преимущество которого в том, что лекарство не нужно разрабатывать с нуля, что очень дорого и долго. Это может помочь в борьбе с тяжелыми случаями раковых заболеваний, дать пациентам время до тех пор, пока не будет создано новое лекарство.
По словам директора Института персонализированной онкологии Сеченовского университета Марины Секачевой, рак предстательной железы занимает первое место по распространенности в РФ у мужчин. К сожалению, большая часть пациентов страдает метастатической или резистентной формой заболевания.
— За последние годы в терапии рака предстательной железы идет поступательное улучшение, что создает предпосылки для долгой жизни пациентов за счет поэтапной смены различных препаратов. Поэтому поиск новых комбинаций — актуальная задача, направленная на увеличение продолжительности жизни, — рассказала онколог.
Предложенный немецко-российской группой исследователей метод так называемой «спасительной терапии», или «терапии последней надежды», — ценный вклад в практическую онкологию, заметил в беседе с «Известиями» руководитель проекта по разработке инновационной технологии фотон-захватной терапии с применением золотых наночастиц Инженерно-физического института биомедицины НИЯУ МИФИ (вуз — участник проекта повышения конкурентоспособности образования «5-100») Алексей Липенгольц.
— На наш взгляд, данная терапия может рассматриваться скорее как сравнительно доступная бюджетная альтернатива другим методам лечения метастазов кастрационно-резистентного рака предстательной железы, — подчеркнул специалист. — На наш взгляд, для лечения метастазов этого типа рака более эффективными и безопасными (хотя и более сложными и дорогими в применении) являются методы ядерной медицины и лучевой терапии.
В каждом отдельном случае врачам стоит смотреть, какой вид терапии подойдет конкретному пациенту, поэтому новые методики лечения рака всегда остаются востребованными, отмечают эксперты.
По официальной статистике, рак простаты является самым часто встречающимся онкологическим заболеванием у мужчин в России. По словам урологов, к нему предрасположен каждый седьмой мужчина в нашей стране.
Лечение метастазов в костях
Кости являются третьим по частоте местом локализации метастазов при различных онкологических заболеваниях, уступая только печени и легким.
Обычно появление костных метастазов говорит о том, что рак находится в запущенной стадии. Радикальное лечение в такой ситуации, как правило, невозможно, терапия носит паллиативный характер.
Чаще всего в кости метастазирует рак простаты и молочной железы.
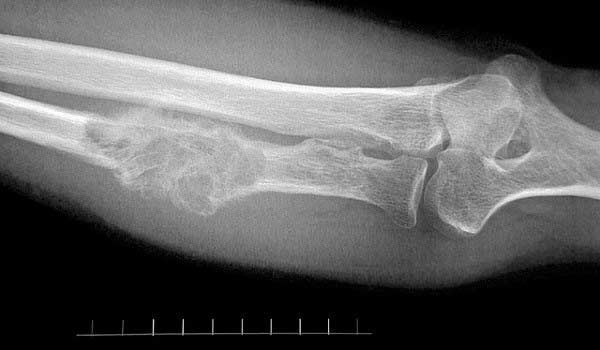
Вторичный рак костей намного более распространен по сравнению с первичными опухолями, особенно у взрослых. Кости и красный костный мозг имеют хорошее кровоснабжение, поэтому в них с легкостью проникают раковые клетки, присутствующие в кровотоке.
К каким проблемам приводят метастазы в костях
Костные метастазы приводят к мучительным болям и нарушению подвижности в суставах. Из-за ослабления костной ткани происходят патологические переломы. Чаще всего у таких больных ломается бедренная кость, очень распространены патологические переломы ребер и позвонков.
Многие злокачественные опухоли метастазируют в позвонки. При этом беспокоят сильные хронические боли в позвоночнике, которые усиливаются и не дают спать по ночам. Может возникнуть тяжелое осложнение — сдавление спинного мозга.
Из-за разрушения костной ткани в кровь поступает большое количество кальция, развивается гиперкальциемия. Она приводит к запорам, увеличению количества мочи, больной постоянно испытывает жажду, усталость. В тяжелых случаях развиваются сердечные аритмии, почечная недостаточность.
Сколько живут с костными метастазами?
Прогноз во многом зависит от того, в каком органе находится первичная опухоль, от ее гистологического типа. Медианная выживаемость при раке простаты с метастазами в костях с момента установления диагноза составляет 12–53 месяцев (в зависимости от степени злокачественности), при раке молочной железы — 19–25 месяцев, при раке щитовидной железы — 48 месяцев, при почечной карциноме — 12 месяцев, при раке мочевого пузыря — 6–9 месяцев, при раке легких — 6–7 месяцев, при меланоме — 6 месяцев.
Гиперкальциемия сильно ухудшает прогноз, у таких больных медианная выживаемость снижается до 10–12 недель.
Как диагностируют метастазы в костях?
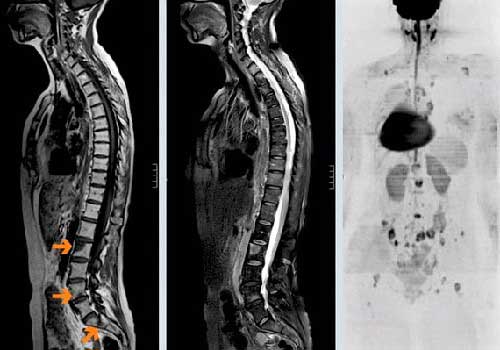
В некоторых случаях костные метастазы помогает выявить рентгенография. На снимках участки поражения выглядят как темные пятна, «дыры». Но на начальных стадиях рентгеновские снимки не очень информативны. Иногда костные метастазы обнаруживают с помощью компьютерной томографии.
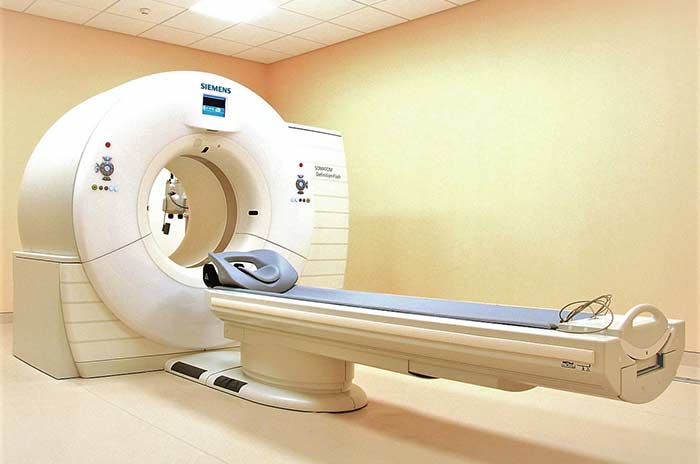
Наиболее информативный метод диагностики — ПЭТ-сканирование. Во время исследования в организм больного вводят радиофармпрепарат, который накапливается в опухолевой ткани и делает ее видимой на снимках, выполненных с помощью специального аппарата. Это помогает выявлять даже мелкие очаги, но иногда за рак по ошибке можно принять костные инфекции, артриты и перенесенные переломы.
МРТ полезна для выявления сдавления нервов и спинного мозга.
Анализы крови на уровень кальция и щелочной фосфатазы не могут быть основанием для диагностики костных метастазов, они применяются в комплексном обследовании, в сочетании с вышеперечисленными методами. Лабораторные анализы помогают выявить осложнение костных метастазов — гиперкальциемию.
Современные методы лечения
Многие пациенты, у которых диагностированы костные метастазы, отчаиваются и прекращают лечение, считая, что больше ничего нельзя сделать. Несмотря на то, что ремиссия, как правило, невозможна, больному все еще можно помочь. Доступны разные виды лечения, которые помогают:
Составляя программу лечения, врач учитывает симптомы, локализацию и характеристики первичной опухоли, локализацию и количество костных метастазов, наличие осложнений в виде патологических переломов и гиперкальциемии.

Противоопухолевые препараты при метастазах в костях
Назначая противоопухолевую терапию, врач в первую очередь ориентируется на первичную опухоль. Метастазы в костях состоят из клеток, характерных для органа, из которого распространился рак. В разных случаях будут эффективны те или иные виды препаратов:
- Химиопрепараты вводят внутривенно или принимают перорально. Лечение проводят циклами. После введения препаратов организму дают «передышку», затем цикл повторяют. Курс лечения состоит из нескольких циклов.
- Гормональные препараты эффективны при гормонально-позитивных опухолях, в первую очередь при раке предстательной и молочной железы. При раке молочной железы рост опухоли могут стимулировать эстрогены, при раке простаты — андрогены.
- Таргетные препараты блокируют определенные молекулы, которые способствуют росту, выживанию раковых клеток, формированию новых кровеносных сосудов. Для того чтобы правильно назначить таргетную терапию, врач должен знать молекулярно-генетические характеристики опухоли у конкретного пациента.
- Иммунопрепараты задействуют ресурсы иммунной системы, чтобы уничтожить раковые клетки. В настоящее время с успехом применяется современный класс иммунопрепаратов — ингибиторы контрольных точек.
Лечение проводят до тех пор, пока опухоль реагирует на него, и не возникают серьезные побочные эффекты. Если назначенные препараты перестали работать, врач подбирает другую комбинацию.
Радиофармпрепараты
Радиофармпрепараты — это радиоактивные вещества, которые после внутривенного введения достигают опухолевой ткани, накапливаются в ней и уничтожают раковые клетки. Это альтернатива традиционной лучевой терапии. Если у больного обнаружены множественные метастазы, нецелесообразно облучать каждую кость: это не очень эффективно и грозит серьезными побочными эффектами. Стоит отдать предпочтение радиофармпрепаратам: они распространяются с кровотоком по всему организму и достигают всех вторичных очагов.
В настоящее время в зарубежной литературе есть данные об успешном применении стронция-89 (Metastron), самария-153 (Quadramet), радия-223 (Xofigo). Доказано, что радиофармпрепараты эффективно помогают уменьшить боли в пораженных костях в течение нескольких месяцев. При необходимости процедуру можно повторить.
Лучше всего радиофармпрепараты работают при остеобластных метастазах, когда повышена активность остеобластов — клеток, образующих новую костную ткань.
Бисфосфонаты
Более безопасной альтернативой является деносумаб — этот препарат тоже подавляет активность остеокластов, но его механизм действия отличается от бисфосфонатов.
Лучевая терапия
- Можно провести 1–2 процедуры, во время которых на кость дают большие дозы излучения. Это удобно для пациента, так как сокращается количество поездок в клинику.
- Другая схема предусматривает проведение 5–10 сеансов меньшими дозами. При этом суммарная доза получится несколько больше, чем в первом случае, у таких пациентов реже рецидивируют боли и возникает необходимость в повторном лечении.

Радиочастотная аблация
Если в кости обнаружено 1–2 метастаза, можно провести радиочастотную аблацию. Процедура болезненная, поэтому ее выполняют под общей анестезией. В опухоль под контролем КТ вводят иглу и подают на нее ток высокой частоты. Это приводит к разрушению опухолевой ткани.
Применение костного цемента
Иногда для того чтобы уменьшить боль и укрепить костную ткань, в кость вводят специальный цемент. Его применяют при метастазах в позвонках и других частях скелета. Введение костного цемента может дополнять другие виды лечения.
Хирургические вмешательства при метастазах в костях
Препараты железа в лечении анемии у онкологических больных
Рассмотрена проблема анемии у онкологических больных. Одной из причин развития анемии является дефицит железа. Абсолютная или функциональная нехватка железа снижает эффективность применения рекомбинантного эритропоэтина, используемого для лечения анемии индуцированной химиотерапией. Многочисленные исследования показали, что внутривенные формы железа по сравнению с пероральными более эффективно восполняют дефицит железа необходимый для оптимального эритропоэза. Современные американские и европейские рекомендации (ESMO, NCCN) по лечению анемии у онкологических больных включают обязательное использование внутривенных форм железа.
Ключевые слова: анемия, химиотерапия, железодефицитная анемия, эритропоэз.
Iron preparations in the treatment of anemia in cancer patients
S.V. MOISEYEV
N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences
The paper considers the problem of anemia in cancer patients. Iron deficiency is one of the causes of anemia. Absolute or functional iron deficiency lowers the efficacy of recombinant erythropoietin used to treat anemia with induced chemotherapy. Numerous trials have shown that intravenous versus oral iron preparations are more effective in compensating for the lack of iron indispensable for optimal erythropoiesis. Today’s American and European guidelines (ESMO, NCCN) for the treatment of anemia in cancer patients include the compulsory use of intravenous iron formulations.
Key words: anemia, chemotherapy, iron-deficiency anemia, erythropoiesis.
В течение многих лет единственным методом лечения тяжелого анемического синдрома в онкологии была гемотрансфузия (ГТ), а точнее переливание донорской эритроцитарной массы. ГТ и сейчас используется при необходимости быстрого повышения уровня гемоглобина, хотя обладает множеством побочных эффектов и, по данным американских авторов, существенно увеличивает риск тромбоэмболии и смерти [3].
Создание и внедрение в практику лечения онкологических больных рекомбинантных человеческих эритропоэтинов (ЭПО) значительно снизило количество ГТ и обусловленных ими осложнений. При этом отмечено положительное влияние ЭПО на качество жизни пациентов [4]. Однако, являясь единственным патогенетическим методом лечения анемии, ЭПО не всегда позволяют достичь желаемого результата. Одной из причин этого может быть дефицит железа.
Спорные вопросы, касающиеся использования ЭПО у онкологических больных, достаточно подробно освещены в ряде отечественных публикаций [5, 6]. Целью данного обзора является оценка роли дефицита железа и препаратов для его коррекции в лечении анемии у онкологических больных.
Железо является функциональным компонентом большого числа ферментов, играющих важную роль в основных метаболических процессах. По мнению M. Aapro и соавт. [7], дефицит железа у онкологических больных составляет 30-60%.
Гепсидин - гормон синтезируемый печенью, открыт и описан A. Krause и соавт. [11] как LEAP - liver expressed antimicrobial peptide. Установлено, что гиперпродукция интерлейкина-6 способствует повышенному синтезу гепсидина. Циркулируя в плазме, гепсидин взаимодействует с транспортным белком ферропортином, подавляет всасывание железа в кишечнике, высвобождение его и макрофагов из депо, что приводит к дефициту железа в костном мозге и развитию анемии [12]. При том, что количество железа в организме может быть достаточным и даже повышенным, возникает так называемый функциональный дефицит железа (ФДЖ) [13, 14].
В онкологии лечение анемии при абсолютном дефиците начинают с применения препаратов железа. При функциональном дефиците железа их сочетают со стимуляторами эритропоэза. При уровне ферритина >800 мг/мл и насыщении трансферрина - 20% препараты железа не вводятся.
В клинической практике для внутривенного введения используются следующие препараты: карбоксимальтозат железа (феринжект), сахарат железа (венофер), глюконат железа (ферлицит), декстран железа (феррумлек, космофер). Все они представляют собой сферические железо-углеводные коллоидные комплексы, включающие железо-(111)-оксигидроксидное ядро, сходное по структуре с ферритином, которое покрыто углеводной оболочкой. Оболочка придает комплексу стабильность и замедляет выделение железа. Эффективность и переносимость внутривенных препаратов зависят от состава оболочки, молекулярной массы и стабильности комплекса. Глюконаты имеют низкую молекулярную массу, менее стабильны и быстрее высвобождают железо: период полувыведения (Т½) - 1 ч. Декстраны имеют большую молекулярную массу, более стабильны - Т½ - 30-60 ч, но наиболее часто дают аллергические реакции, включая анафилактический шок. Сахараты имеют Т½ - 5,3 ч, значительно реже дают аллергические реакции.
Карбоксимальтозат железа (феринжект) характеризуется медленным физиологическим высвобождением железа из стабильного комплекса с углеводом, что определяет его низкую токсичность. Феринжект после внутривенного ведения захватывается ретикулоэндотелиальной системой и распределяется на железо и карбоксимальтозу. После однократного внутривенного введения препарата в дозах от 100 до 1000 мг максимальная его концентрация в сыворотке (37-333 мкг/мл) достигается через 15 мин - 1,21 ч. Время полувыведения составляет 7-12 ч, среднее время удержания в организме 11-12 ч. Препарат практически не выделяется почками. Феринжект вводится внутривенно струйно в максимальной дозе 200 мг не более 3 раз в неделю или в дозе 1000 мг внутривенно капельно 15 мин не чаще 1 раза в неделю. Препарат хорошо переносится и не требует проведения тест-дозы, возможность возникновения аллергических реакций минимальна [16].
Таким образом, больные со злокачественными опухолями часто страдают анемией, которая может быть железодефицитной. Для лечения этих состояний используют средства, стимулирующие эритропоэз и гемотрансфузии. Одновременно необходимо возмещение дефицита железа.
Впервые эффективность комбинации ЭПО с препаратами железа была выявлена в нефрологии, причем было установлено преимущество именно внутривенных форм железа по сравнению с пероральными. В последнее десятилетие проведен ряд исследований по оценке такого лечения у онкологических больных с анемией, индуцированной химиотерапией. Результаты некоторых из них представлены ниже.
В исследовании М. Auerbach и соавт. [17] 157 пациентов, получавших эритропоэтин альфа еженедельно в течение 6 нед, были рандомизированы на три группы: 1-я - дополнительно вводился декстран железа внутривенно струйно или капельно; 2-я - получала препарат железа внутрь, 3-я - была контрольной. Все пациенты имели исходный уровень НЬ < 105 г/л и низкое насыщение трансферрина < 19%. При оценке через 6 нед лечения в контрольной группе средний уровень НЬ < 105 г/л (анемия сохраняется), во 2-й группе НЬ - 112 г/л, целевой уровень не достигнут, существенной разницы с контролем нет. В 1-й группе достигнут максимальный уровень гемоглобина - 119-122 г/л, отличий при струйном и капельном введении нет. Дополнительно оценивали частоту гематологического ответа - процент больных, достигших уровень НЬ >120 г/л или имевших увеличение НЬ > 20 г/л. Гематологический ответ достоверно превышал показатели 2-й группы и контроля: 68, 36 и 25% соответственно (р<0,01).
В исследовании D. Henry и соавт. [18] 187 пациентов получали лечение эритропоэтином альфа 1 раз в неделю в течение 12 нед. Из них 129 были рандомизированы на три группы: 1-я - получала дополнительно глюконат железа внутривенно; 2-я - сульфат железа внутрь; 3-я - была контрольной. Включались больные с исходным уровнем НЬ < 110 г/л и насыщением трансферрина < 15%. При оценке через 8 нед лечения прирост уровня НЬ в 1-й группе составил 24 г/л, а во 2-й и 3-й - 16-15 г/л. Гематологический ответ в 1-й группе составил 73%, во 2-й и 3-й группе соответственно 45 и 41%. Разница статистически достоверна как между 1-й и 2-й группами (р=0,009), так и между 1-й и контролем (р=0,0044).
В 2008 г. L. Bastit и соавт. [19] опубликовали результаты крупного (n=396) открытого рандомизированного исследования III фазы. Пациенты с исходным уровнем НЬ < 105 г/л и насыщением трансферрина >15% получали лечение дарбэпоэтином альфа по 500 мкг 1 раз в 3 нед в течение 16 нед. Сравнивались две группы: исследовательская - дополнительно внутривенно 1 раз в неделю вводился сахарат железа; контрольная - железо вводилось перорально или не вводилось. Частота гематологического ответа в исследовательской группе составила 86%, а в контрольной - 73%. Дополнительно оценивалась потребность в заместительных гемотрансфузиях, которая в группе комбинированного лечения достоверно различалась с контролем (9% против 20% соответственно, р=0,005).
В исследовании P. Pedrazzoli и соавт. [20] 149 больным дарбэпоэтин вводился по 150 мкг 1 раз в неделю с внутривенным железом или без него. Авторы показали достоверное преимущество комбинированного лечения с включением внутривенного железа. Интересные данные получили М. Hedenus и соавт. [21], оценившие не только гематологический ответ, но и количество израсходованного ЭПО. Было установлено, что комбинированное применение ЭПО с внутривенным железом в среднем на 25% снижает расход ЭПО по сравнению с контролем.
В литературе имеются публикации, указывающие на возможность достижения целевого уровня гемоглобина и снижения потребности в гемотрансфузиях у онкологических больных с анемией, при использовании только внутривенных форм железа. В 2010 г. Р. Dangsuvan и соавт. [22] опубликовали результаты локального исследования (n=44), в котором сравнивался сахарат железа и пероральные препараты у пациенток с анемией на фоне химиотерапии без дополнительного введения ЭПО. Потребность в заместительных гемотрансфузиях в группе внутривенного сахарата железа составила 22,7%, с пероральным препаратом железа - 63,6%. Опубликованы данные, показавшие эффективность внутривенных препаратов железа для лечения анемии у онкологических больных без применения средств, стимулирующих эритропоэз. В 2010 г. Т. Steinmetz и соавт. [23] опубликовали результаты исследования по оценке эффективности и переносимости карбоксимальтозата железа у онкологических больных с анемией и абсолютным или функциональным дефицитом железа. Оценка эффективности проведена у 420 пациентов, которые были рандомизированы в группу внутривенного железа без средств стимулирующих эритропоэз (n=347), и группу, получавших этот же препарат в комбинации со стимуляторами эритропоэза (n=73). Через 5 нед лечения гемоглобин в обеих группах повысился до 11-12 г/л. Нежелательные явления (в основном тошнота и диарея), возможно, связанные с карбоксимальтозатом железа, составили 2,3%. Препарат в обоих случаях эффективно повышал и стабилизировал уровень гемоглобина у онкологических больных [23].
Заключение
Анемия часто встречается у больных со злокачественными новообразованиями и связана как с основным заболеванием, так и с его лечением: цитотоксическая и лучевая терапия оказывают прямое подавляющее действие на кроветворение. Анемия при злокачественных опухолях по патогенезу ассоциируется с анемией при хронических заболеваниях и нередко сочетается с дефицитом железа - функциональным или абсолютным. Результаты международных исследований показали необходимость использования внутривенных форм железа с гемостимулирующей терапией ЭПО для лечения анемии, возникшей на фоне химиотерапии. Одновременно существуют указания на эффективность внутривенного железа в монотерапии при функциональном его дефиците. Это явилось основанием для включения в международные рекомендации (NCCN, ESMO) по проведению гемостимулирующей терапии у онкологических больных внутривенных форм железа [15, 24]. При отсутствии дефицита железа (ферритин >800 нг/мл и насыщение трансферрина > 20%) вводить его не рекомендуется, как и пациентам с признаками активной инфекции [15]. Целевой уровень гемоглобина при лечении анемии не должен превышать 12,0 г/дл (120 г/л), его достижение сопровождается улучшением качества жизни пациентов и, возможно, результатов противоопухолевого лечения и выживаемости. Надеемся, что дальнейшее проведение хорошо спланированных международных исследований позволит ответить на многие вопросы, еще существующие в этой проблеме.
Недавно в клинической практике появился новый препарат для внутривенного введения - железа карбоксимальтозат (феринжект), показавший высокую эффективность как в комбинации с ЭПО, так и в монорежиме. Феринжект не требует проведения тест-дозы, обладает хорошей переносимостью и минимальным риском развития аллергических реакций.
Лекарственные средства для лечения рака молочной железы
Т.М. ЛИТВИНОВА,
АССИСТЕНТ КАФЕДРЫ
Несмотря на значительные достижения последней четверти века в понимании этиологии и клиники рака молочной железы, а также кардинальные изменения в подходах к лечению, проблема борьбы с ним продолжает оставаться серьезной. Основные научные исследования направлены на изыскание путей снижения смертности при данной патологии с помощью ранней диагностики и адекватного локального лечения, в том числе химио- и гормонотерапии. Для их реализации, с учетом индивидуальных особенностей как течения заболевания, так и организма больной, требуется широкий ассортимент противоопухолевых средств.
В связи с этим представляет интерес анализ целевого сегмента фармацевтического рынка России, в частности лекарственных средств, предназначенных для лечения рака молочной железы, в 1997-2000 годах. Исходные данные получены в ходе контент-анализа информационных источников: "Государственный реестр лекарственных средств", "Регистр лекарственных средств России", "Справочник Видаль. Лекарственные препараты в России". Отбор лекарственных средств (ЛС) базировался на предварительном изучении основных методов современной лекарственной терапии этого заболевания, а также на указаниях в инструкциях к ЛС.
ПРЕДЛОЖЕНИЯ ЛС, ПРИМЕНЯЕМЫХ ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, НА РОССИЙСКОМ ФАРМАЦЕВТИЧЕСКОМ РЫНКЕ В 1997-2000 ГОДАХ
Оставшиеся менее 22% в структуре ассортимента составляют следующие группы препаратов: андрогены - 4,4%, другие противоопухолевые средства - 4,0%, гормоны и родственные средства - 3,3%, гормональные противозачаточные средства системного действия - 2,8%. Иммуностимуляторы и анаболические стероидные средства в структуре занимают по 1,6%; на долю противоопухолевых средств и эстрогенов приходится 1,1% и 0,6% соответственно. Субстанции карубицина (противоопухолевый антибиотик) и фотретамина (фосфорорганическое соединение) не имеют пока группы АТС, но отнесены к противоопухолевым средствам. Такие ЛС, как пентоксил, леакадин и ликопид, также пока не отнесены в определенные группы.
Большую часть (57,8%) в структуре занимают лекарственные формы для инъекций (водные, спиртовые и масляные растворы), что обусловлено спецификой лечения на этапе химио- и гормонотерапии. Примерно третья часть (34,4%) приходится на твердые лекарственные формы. Жидкие формы для внутреннего применения и дозированные аэрозоли представлены в общей структуре ассортимента незначительно - 6,7% и 1,1% соответственно.
Доминирующая доля в ассортименте лекарственных средств для лечения рака молочной железы приходится на зарубежные препараты - 85,0% (153). В то же время рейтинг 27 стран-производителей ЛС для лечения рака молочной железы и зарегистрировавших их в России показал, что первое место по числу препаратов на рынке занимает Россия - 27 препаратов (15,0%). Германия и Индия предлагают меньший ассортимент - 20 (11,0%) и 15 (8,3%) препаратов соответственно. Остальные страны-производители зарегистрировали на российском фармацевтическом рынке от 1 до 11 препаратов.
Особенности ассортимента отдельных групп
1. Алкилирующие средства
Алкилирующие средства применяются для лечения рака молочной железы главным образом в качестве компонента комбинированной химиотерапии. Их действие основано на переносе алкильных групп на различные компоненты клетки, что сопровождается цитотоксическими эффектами. Наиболее важным действием является алкилирование ДНК, которое приводит к гибели пораженной клетки. Побочным эффектом данной группы ЛС являются угнетение функции костного мозга и сопутствующие лейко- и тромбоцитопения, которые исчезают при прекращении приема препаратов.
На российском фармацевтическом рынке эта группа ЛС представлена 11 препаратами пяти действующих веществ, объединенных в три подгруппы: аналоги азотистого иприта, этиленамина и нитрозомочевины. Подгруппа аналогов азотистого иприта включает 8 ЛС, 5 из которых содержат одно действующее вещество - циклофосфамид (ледоксина, циклофосфамид-тева, циклофосфан, цитоксан, эндоксан). Лейкеран и хлор-бутил разработаны на основе хлорамбуцила. Алкеран содержит мелфалан.
2. Антиметаболиты
Метаболизм опухолевых клеток имеет некоторые отличия по сравнению с нормальными клетками, поэтому пораженные клетки более восприимчивы к некоторым антиметаболитам и структурным аналогам. Для многих ЛС это был целенаправленный синтез на основе знаний о клеточных процессах, хотя некоторые из них первоначально были открыты как антибиотики.
Антиметаболиты представлены аналогами фолиевой кислоты и пиримидина. В группе 26 препаратов четырех действующих веществ, причем 15 из них (58%) - это синонимы метотрексата, являющегося антагонистом фолиевой кислоты. Синонимов флуороурацила (подгруппа аналогов пиримидина) всего 7; 3 - у действующего вещества тегафур. Гемцитабин производится под одним торговым названием. На отечественном рынке эти противоопухолевые средства представляют 16 стран-производителей, среди которых и Россия. Практически все ЛС этой группы выпускаются в форме раствора для инъекций и в таблетках, за исключением флуороурацила, который применяется в стационарных условиях только парентерально.
3. Алкалоиды растительного происхождения и другие природные вещества
Препараты этой группы вызывают остановку митотического цикла пораженных клеток. Однако нейротоксический эффект, как побочное действие препаратов, ограничивает их применение только короткими курсами.
4. Цитотоксичные антибиотики и родственные субстанции
Скрининг продуктов жизнедеятельности микроорганизмов привел к открытию нескольких ингибиторов роста, которые оказались эффективными для химиотерапии рака молочной железы. Цитотоксичные антибиотики связываются с ДНК посредством встраивания между специфическими основаниями и блокируют синтез новых ДНК, влияя на репликацию. К наиболее эффективным из них относятся антрациклиновые антибиотики, выделенные из почвенного гриба. ЛС данной группы применяются в основном в комбинации с другими препаратами, например, с производными нитрозомочевины и циклофосфамидом, с которыми они действуют как синергисты, вызывая более продолжительную ремиссию, чем при монотерапии. При таком методе лечения уменьшаются некоторые токсические эффекты, которые возможны при назначении больших доз доксорубицина.
5. Другие противоопухолевые средства
Среди других противоопухолевых средств в классификации АТС выделяют только одну подгруппу, применяемую для лечения рака молочной железы. В нее вошли препараты карбоплатина, относящегося к соединениям платины. Активным действием препаратов обладает неорганический металлосодержащий комплекс, который, по-видимому, является синергистом других противоопухолевых средств.
6. Гормоны и родственные средства
В настоящее время известно, что нарушение гормонального фона у женщин может приводить к развитию рака молочной железы. Рак, возникший в этой ткани, может быть подавлен или стимулирован соответствующим изменением гормонального баланса. Поэтому важной является разработка паллиативной терапии половыми гормонами.
На фармацевтическом рынке России предлагается 4 препарата двух действующих веществ, относящихся к эстрогенам (фосфэстрол и этинилэстрадиол), и 2 ЛС, являющихся синонимами гозерелина, отнесенных к группе аналогов гонадотропных рилизинг-гормонов. Эстрогены, применяемые для лечения рака молочной железы, появились в арсенале онкологов в семидесятых годах, в основном это отечественные препараты. Великобритания в 1993 г. и Индонезия в 1995 г. зарегистрировали на российском рынке препарат золадекс - синтетический пептидный аналог естественного гонадотропин-рилизинг гормона. Индекс обновления изучаемой группы незначителен и составляет всего 0,2.
7. Антагонисты гормонов и родственные средства
Антагонисты гормонов систематизированы в 2 подгруппы: антиэстрогены и ингибиторы ферментов. Эта группа по количеству достаточно велика: 31 препарат на основе пяти действующих веществ. К антиэстрогенам относятся 26 ЛС, содержащих 2 действующих вещества (тамоксифен и торемифен), причем 25 являются синонимами тамоксифена. Долгое время "золотым стандартом" гормонотерапии рака молочной железы, особенно у женщин старше 45 лет, был антиэстроген тамоксифен, конкурирующий с эндогенными эстрогенами за связывание с рецепторами эстрогена. Поиски более эффективных средств привели к созданию ряда новых препаратов (торимифен). Наибольший интерес представляет группа ингибиторов ферментов (аромаз). После наступления менопаузы эстрогены образуются в основном за счет периферической ароматизации андрогенов. Аромаза, присутствующая в жировой ткани печени, молочной железе и ее опухолевой ткани, превращает андрогены в эстрогены. Ингибиторы аромазы тормозят этот процесс.
Первым нестероидным ингибитором аромазы стал аминоглютетемид, позднее были созданы анастрозол и летрозол. По количеству ЛС подгруппа незначительна: 5 торговых названий трех действующих веществ. В целом препараты группы антагонистов гормонов появились в арсенале врачей-маммологов с 1992 года, причем 96,8% всех предложений на фармацевтическом рынке составляют препараты зарубежного производства. Выпускаются они только в виде таблетированных лекарственных форм.
8. Иммуностимуляторы
9-12. Половые гормоны и модуляторы функции половых органов
13. Анаболические стероидные средства
14. Фитопрепараты
По современным представлениям эффективность фитотерапевтических средств, используемых для лечения рака молочной железы, зависит от содержания действующих веществ (аминокислоты, микроэлементы, птерины, свободные фенолы, полисахариды, стерины, лигнин).
Ассортимент фитопрепаратов в настоящее время составляет 10 торговых названий, причем четыре ЛС содержат комплекс веществ из эхинацеи (иммунал, эхинабене, эхинацея Гексал, эхинацея ликвидум). Препараты бефунгин и березовый гриб чага получены из грибных наростов, образуемых на березах фитогенным паразитом. Французский препарат эндотелон разработан на основе экстракта виноградных косточек. Действие препаратов, в состав которых входит эхинацея, обусловлено компонентами полисахаридной природы. Эти ЛС способствуют повышению активности неспецифических факторов защиты организма и оказывают иммуностимулирующее действие. Они предлагаются зарубежными производителями с 1993 года. Выпускаются в виде капель и сока - раствора для внутреннего применения.
15. Противоопухолевые средства
Указание на фармакотерапевтическое действие противоопухолевых средств субстанций карубицина и фотретамина послужило аргументом для их объединения в группу. Карубицин (карминомицина гидрохлорид) представляет собой противоопухолевый антибиотик, производимый в России с 1979 года в форме порошка для инъекций. Фотрин содержит действующее вещество фотретамин, которое является синтетическим фосфорорганическим соединением, выпускается отечественным производителем также с 1979 года в виде порошка для инъекций.
16. Препараты, не отнесенные к группам
Ликопид представляет собой структурный фрагмент клеточной стенки бактерий. Оказывает иммунокорригирующее и противовоспалительное действие. Выпускается отечественным производителем в таблетках с 1995 года.
Таким образом, фармацевтический рынок противоопухолевых средств, применяемых для лечения рака молочной железы, характеризуется разнообразием препаратов отечественного и импортного производства. Их ассортимент позволяет врачам-онкологам подбирать больным индивидуальные схемы и методы лечения. В настоящее время за рубежом ведутся исследования в области поиска альтернативных методов лечения раковых заболеваний. К ним относится стимулирование защитных сил организма за счет применения модификаторов биологических реакций. Среди таких средств выделяется класс противоопухолевых сахаридов. Так, например, в Японии и США проходят клинические испытания b-1,3-связанных глюканов, фруктаны, глюкоманнаны. Специалистами Университета г. Киото (Япония) изучаются проблемы клинического использования систем доставки лекарственного вещества с помощью макромолекулярных носителей при терапевтическом лечении злокачественных опухолей. Ряд противораковых институтов разрабатывает другие соединения с противораковой активностью, клиническое изучение которых планируется в ближайшее время или уже проводится.
В связи с этим можно прогнозировать дальнейшее расширение ассортимента лекарственных средств для лечения рака молочной железы на мировом фармацевтическом рынке, а следовательно, ожидается увеличение целевого сегмента предложений на рынке России.
Литература
1. Гольберт 3.В., Островцев Л.Д, Сорокин Э.С. О раннем и "скрытом" раке молочной железы. // Вопросы онкологии. 1981, N 10, с. 34-39
2. Горбунова B.A. Рак молочной железы: проблемы гормонотерапии. // Новый медицинский журнал. 1998, N2, с. 7-11
3. Варпаховская И. Противоопухолевые препараты. // Remedium. 1998, N1, c. 38 - 41
4. Возный Э. Рак молочной железы. // Фармацевтический вестник. 1998, N19, с. 10-11
5. Семиглазов В.Ф., Веснин А.Г., Моисеенко М.В. Минимальный рак молочной железы. СПб., Гиппократ, 1992, с 240
6. Холин А.В. Диагностика рака молочной железы: перспективы. // Маммология. 1996, N4, с. 33-35
7. Deutsche Apotheker Zeitung. 1991, N 25, 1305-1308
Читайте также:
