Магний это активный металл
Обновлено: 18.05.2024
МА́ГНИЙ (лат. Magnesium), Mg (читается «магний»), химический элемент IIА группы третьего периода периодической системы Менделеева (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ МЕНДЕЛЕЕВА) , атомный номер 12, атомная масса 24,305. Природный магний состоит из трех стабильных нуклидов (см. НУКЛИД) : 24 Mg (78,60% по массе), 25 Mg (10,11%) и 26 Mg (11,29%). Электронная конфигурация нейтрального атома 1s 2 2s 2 p 6 3s 2 , согласно которой магний в стабильных соединениях двухвалентен (степень окисления +2). Простое вещество магний — легкий, серебристо-белый блестящий металл.
История открытия
Соединения магния были известны человеку с давних пор. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита (см. МАГНЕЗИТ) . Металлический магний впервые получил в 1808 английский химик Г. Дэви (см. ДЭВИ Гемфри) . Как и в случае других активных металлов — натрия, калия, кальция, для получения металлического магния Дэви использовал электролиз. Электролизу он подвергал увлажненную смесь белой магнезии (в ее состав, судя по всему, входили оксид магния MgO и гидроксид магния Mg(OH)2) и оксида ртути HgO. В результате Дэви получил амальгаму — сплав нового металла со ртутью. После отгонки ртути остался порошок нового металла, который Дэви назвал магнием.
Магний, полученный Дэви, был довольно грязным, чистый металлический магний получен впервые в 1828 французским химиком А. Бюсси.
Нахождение в природе
Магний — один из десяти наиболее распространенных элементов земной коры. В ней содержится 2,35% магния по массе. Из-за высокой химической активности в свободном виде магний не встречается, а входит в состав множества минералов — силикатов, алюмосиликатов, карбонатов, хлоридов, сульфатов и др. Так, магний содержат широко распространенные силикаты оливин (см. ОЛИВИН) (Mg,Fe)2[SiO4] и серпентин (см. СЕРПЕНТИН) Mg6(OH)8[Si4O10]. Важное практическое значение имеют такие магнийсодержащие минералы, как асбест (см. АСБЕСТ (минерал)) , магнезит (см. МАГНЕЗИТ) , доломит (см. ДОЛОМИТ) MgCO3·CaCO3, бишофит (см. БИШОФИТ) MgCl2·6H2O, карналлит (см. КАРНАЛЛИТ) KCl·MgCl2·6H2O, эпсомит (см. ЭПСОМИТ) MgSO4·7H2O, каинит (см. КАИНИТ) KCl·MgSO4·3H2O, астраханит Na2SO4·MgSO4·4H2O и др. Магний содержится в морской воде (4% Mg в сухом остатке), в природных рассолах, во многих подземных водах.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2, натрия NaCl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много — около 0,1% примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния, или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999% и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс:
MgO + C = Mg + CO
или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + 2CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
Физические и химические свойства
Металлический магний обладает гексагональной кристаллической решеткой. Температура плавления 650°C, температура кипения 1105°C, плотность 1,74 г/см 3 (магний — очень легкий металл, легче только кальций и щелочные металлы (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ) ). Стандартный электродный потенциал магния Mg/Mg 2+ –2,37В. В ряду стандартных потенциалов он расположен за натрием перед алюминием.
Поверхность магния покрыта плотной пленкой оксида MgO, при обычных условиях надежно защищающей металл от дальнейшего разрушения. Только при нагревании металла до температуры выше примерно 600°C он загорается на воздухе. Горит магний с испусканием яркого света, по спектральному составу близкого к солнечному. Поэтому раньше фотографы при недостаточной освещенности проводили съемку в свете горящей ленты магния. При горении магния на воздухе образуется рыхлый белый порошок оксида магния MgO:
2Mg + O2 = 2MgO.
Одновременно с оксидом образуется и нитрид магния Mg3N2:
3Mg + N2 = Mg3N2.
C холодной водой магний не реагирует (или, точнее, реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие, причем образуется рыхлый белый осадок гидроксида магния Mg(OH)2:
Mg + 2H2O = Mg(OH)2 + H2.
Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C.
Способность магния гореть как в воде, так и в атмосфере углекислого газа существенно усложняет тушение пожаров, при которых горят конструкции из магния или его сплавов. (см. МАГНИЯ ОКСИД)
Оксид магния (см. МАГНИЯ ОКСИД) MgO представляет собой белый рыхлый порошок, не реагирующий с водой. Раньше его называли жженой магнезией или просто магнезией. Этот оксид обладает основными свойствами, он реагирует с различными кислотами, например:
MgO + 2HNO3 = Mg(NO3)2 + H2O.
Отвечающее этому оксиду основание Mg(OH)2 — средней силы, но в воде практически нерастворимо. Его можно получить, например, добавляя щелочь к раствору какой-либо соли магния:
2NaOH + MgSO4 = Mg(OH)2 + Na2SO4.
Так как оксид магния MgO при взаимодействии с водой щелочей не образует, а основание магния Mg(OH)2 щелочными свойствами не обладает, магний, в отличие от своих «согруппников» — кальция, стронция и бария, не относится к числу щелочноземельных металлов.
Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом:
Mg + Br2 = MgBr2.
При нагревании магний вступает во взаимодействие с серой, давая сульфид магния:
Mg + S = MgS.
Если в инертной атмосфере прокаливать смесь магния и кокса, то образуется карбид магния состава Mg2C3 (следует отметить, что ближайший сосед магния по группе — кальций — в аналогичных условиях образует карбид состава СаС2). При разложении карбида магния водой образуется гомолог ацетилена — пропин С3Н4:
Mg2C3 + 4Н2О = 2Mg(OH)2 + С3Н4.
Поэтому Mg2C3 можно назвать пропиленидом магния.
В поведении магния есть черты сходства с поведением щелочного металла лития (см. ЛИТИЙ) (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния:
3Mg + N2= Mg3N2.
Как и нитрид лития, нитрид магния легко разлагается водой:
Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NН3.
Сходство с литием проявляется у магния и в том, что его карбонат MgCO3 и фосфат Mg3(PO4)2 в воде плохо растворимы, как и соответствующие соли лития.
С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды (см. ЖЕСТКОСТЬ ВОДЫ) . Как и в случае гидрокарбоната кальция (см. ст. Кальций (см. КАЛЬЦИЙ) ), жесткость, вызванная гидрокарбонатом магния Mg(HCO3)2, — временная. При кипячении гидрокарбонат магния Mg(HCO3)2 разлагается и в осадок выпадает его основной карбонат — гидроксокарбонат магния (MgOH)2CO3:
2Mg(HCO3)2 = (MgOH)2CO3 + 3CO2 + Н2О.
Практическое применение до сих пор имеет перхлорат магния Mg(ClO4)2, энергично взаимодействующий с парами воды, хорошо осушающий воздух или другой газ, проходящий через его слой. При этом образуется прочный кристаллогидрат Mg(ClO4)2·6Н2О. Это вещество можно вновь обезводить, нагревая в вакууме при температуре около 300°C. За свойства осушителя перхлорат магния получил название «ангидрон».
Большое значение в органической химии имеют магнийорганические соединения (см. МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ) , содержащие связь Mg—C. Особенно важную роль среди них играет так называемый реактив Гриньяра — соединения магния общей формулы RMgHal, где R — органический радикал, а Hal = Cl, Br или I. Эти соединения образуются в эфирных растворах при взаимодействии магния и соответствующего органического галоида RHal и используются для самых разнообразных синтезов.
Применение
Основная часть добываемого магния используется для получения различных легких магниевых сплавов. В состав этих сплавов, кроме магния, входят, как правило, алюминий, цинк, цирконий. Такие сплавы достаточно прочны и находят применение в самолетостроении, приборостроении и для других целей.
Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например:
2Mg + TiO2 = 2MgO + Ti.
2Mg + UF4 = 2MgF2 + U.
Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат.
Биологическая роль магния
Магний — биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ) , постоянно присутствующий в тканях всех организмов. Он входит в состав молекулы зеленого пигмента растений — хлорофилла (см. ХЛОРОФИЛЛ) , участвует в минеральном обмене, активирует ферментные процессы в организме, повышает засухоустойчивость растений. С участием ионов Mg + осуществляется биолюминесценция (см. БИОЛЮМИНЕСЦЕНЦИЯ) и ряд других биологических процессов. Широкое практическое применение находят магниевые удобрения — доломитовая мука, жженая магнезия и др.
В организм животных и человека магний поступает с пищей. Суточная потребность человека в магнии — 0,3—0,5 г. В организме среднего человека (масса тела 70 кг) содержится около 19 г магния. Нарушения обмена магния приводят к различным заболеваниям. В медицине применяют препараты магния — его сульфат, карбонат, жженую магнезию.
Энциклопедический словарь . 2009 .
Полезное
Смотреть что такое "магний" в других словарях:
МАГНИЙ — (ново лат. magnium, от лат. magnesia). Серебристый металл, составляющий основание магнезии. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МАГНИЙ блестящий металл серебристо белого цвета, горит очень ярким белым… … Словарь иностранных слов русского языка
МАГНИЙ — (символ Mg), металлический элемент серебристо белого цвета, один из ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. Восьмой по распространенности элемент земной коры. Впервые был выделен в 1808 г. Хэмфри ДЭВИ. Необходим в питании человека и животных. Магний всегда… … Научно-технический энциклопедический словарь
МАГНИЙ — МАГНИЙ, см. магнезия. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
МАГНИЙ — (лат. Magnesium) Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305. Название от новолатинского magnesia магнезия. Серебристый металл, очень легкий и прочный; плотность 1,74 г/см³, tпл 650 .С. На… … Большой Энциклопедический словарь
Магний — Mg (лат. Magnesium * a. magnesium; н. Magnesium; ф. magnesium; и. magnesio), хим. элемент II группы периодич. системы Менделеева, ат. н. 12, ат. м. 24,312. Природный M. состоит из смеси стабильных изотопов 24Mg (78,6%), 25Mg (10,11%) и… … Геологическая энциклопедия
МАГНИЙ — МАГНИЙ, магния, мн. нет, муж. (ново лат. magnium) (хим.). Мягкий серебристо белый металл, горящий белым ослепительным пламенем. Группа снята вечером при вспышке магния. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МАГНИЙ — МАГНИЙ, я, муж. Химический элемент, мягкий лёгкий серебристо белый металл, горящий ярким белым светом. | прил. магниевый, ая, ое. Магниевая вспышка. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
МАГНИЙ — (лат. Magnesium), Mg, хим. элемент II группы периодич. системы элементов; ат. номер 12, ат. масса 24,305. Природный М. содержит 3 стабильных изотопа: 24Mg (78,99%), 25Mg (10,00%) и 26Mg (11,01%). Электронная конфигурация внеш. оболочки 3s2.… … Физическая энциклопедия
МАГНИЙ — серебристо белого цвета легкий металл (уд. вес 1,74), близкий по свойствам к алюминию. Темп pa плавления 650°; сопротивление на разрыв 12 кг/мм2; горит ярким пламенем. В промышленности находит все более широкое распространение при изготовлении… … Технический железнодорожный словарь
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
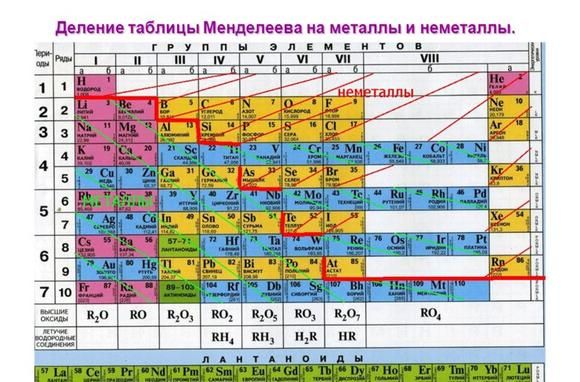
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Магний и его реакции.
В этом видео мы вам расскажем про очень интересный металл - магний.
Этот металл один из самых легких и химически активных,
Магний активно горит на воздухе, излучая большое количество света и ультрафиолета. Температура горения магния в воздухе более 2000С.
Магний это самый активный металл который можно держать в руке не получая при этом химического ожога. Мы отломали магниевые ленты что бы показать насколько горит ярко магний в солнечный день.
Чем потушить магний.
Из-за высокой активности, большое количество горящего магния нельзя тушить обычными средствами пожаротушения, песком, водой, и огнетушитилями.
Мы вам хотим показать реакцию горения смеси магния и песка. Строек поблизости нет, и единственный доступный песок был в песочнике.
Просеяв песок мы добавили крупный порошок магния.
Магний прекрасно горит в смеси с песком. В процессе горения выделяется очень много тепла, и образуется чистый кремний. Так получают кремний.
Магний активно реагирует с серой. В ходе реакции образуется сульфид магния.
Мы взяли использованный отечественный магниевый анод от водонагревателя или бойлера,. напилили с него металлический порошок и подожгли в пламени горелки.
Для сравнения взяли китайский слиток магния с алиэкспресса, и тоже напилили с него порошок.
Оказалось что магний из Китая лучше отечественного, порошок магний при горении дает большие огненные вспышки.
Всем спасибо за просмотр, Если вам понравилось наше видео поставьте плюсик,

1.3K пост 11.3K подписчиков
Правила сообщества
Старайтесь выбирать качественный контент и не ставьте теги моё на копипасты
Посты с просьбой решения домашнего задания переносятся в общую ленту
1. Оскорблять пользователей.
2. Постить материал далеко не по теме и непотребный контент (в остальном грамотно используйте теги)
3. Рекламировать сомнительные сайты и услуги коммерческого характера
Чем потушить магний - так и не сказали.
Странно, реакция магния с серой медленно протекает, мыж в своё время так бомбочки делали,бабахало здоровски).

Ответ на пост «Да, я был тупой. но секундное просветление уберегло»
Мужчина - случайно выживший мальчик (с)
А меня не уберегло. К химии пришёл через пиротехнику: "Взрывается, горит, ууу, круто!" В универ поступил - очень жалел по первости, что в городской библиотеке не выдают справочники по взрывному делу без справки из деканата (наивный был, молодой). А потом появился интернет и я нашёл в сети способ синтеза дома перекиси ацетона, "кисы".
Тут надо уточнить: эта хрень очень подлая. Во-первых, сварить очень легко, но вне лаборатории и без чёткого контроля условий получения выделяется смесь пероксидов разной структуры, которая особенно нестабильна и может детонировать от косого взгляда, особенно если не пластифицирована и плохо промыта. Во-вторых, взрывается достаточно сильно, чтобы даже в небольшом количестве при удаче оторвать что-нибудь выступающее.
Ну и вот, я сварил порцию, промыл, высушил - пока всё нормально. А потом. не придумал ничего лучше, чем засыпать немного в колпачок от медицинской иголки. А фитиль, прям как автор поста, сделал, забив растолчённые спичечные головки в стержень шариковой ручки. Дальше - больше: я поджигаю эту хреновину и бросаю (точнее, пытаюсь выбросить) в форточку. До сих пор не знаю, чем тогда думал - ведь знал уже, что горит такой "запал" очень быстро, но тут будто помутнение какое нашло.
Бум. Нет, БУУУУУМ. Стою. В ушах звенит, ничего не слышу, левой руке, которой бросал, будто бы немного горячо. Опускаю глаза, а там с подушечек трёх пальцев, большого, указательного и среднего, свисает лоскутами кожа. На пол капает красным, стены, шторы и подоконник тоже слегка обрызганы, прилипли какие-то клочки. В голове одна мысль: - Всё, теперь из комнаты, наверное, выгонят. Кое-как перемотался, пошёл в травму - благо, недалеко было. Врачу сказал, мол, в руке прошлогодняя петарда взорвалась. Пальцы обработали, лоскуты кожи примерно приложили на место и примотали, с тем и ушёл.
В итоге заплатил за важный урок малой кровью. Очень повезло: осколки колпачка только порезали пальцы, но не попали в глаза. Комнату вымыл, хозяйке сказал, что в коридоре краской накапал. На перевязку не пошёл, сам размотал (не делайте так!), но зажило успешно. Опять же, не доходит через голову - дойдёт через жопу: мозги встали на место и больше пиротехникой я не баловался. Спустя 16 лет только на одном пальце видны шрамы. Ну и увлечения с тех пор радикально переосмыслил. А то были прецеденты. Парня со старших курсов отчислили, например, когда он взорвал дома батарею азидом свинца - будто ему оторванного при этом пальца было мало.
Напоминанием осталась небольшая шишечка под кожей: врач не заметил, что кусочек пластика остался в ране, и так он и зарос. Сейчас, если немного надавить, чувствую, как это ядрышко перекатывается под пальцем, но снаружи и не видно. Знакомый говорил, возьми, мол, бритву, да вырежи сам. Ну да его слушать - себе дороже, он себе и больной зуб выдёргивал пассатижами перед зеркалом.
Магний: свойства и возможности самого активного конструкционного металла

Описаны основные физические и химические свойства магния. Рассмотрены способы получения магния из различных минералов и его применения в технике, металлургии и медицине.
Ключевые слова : магний, применения магния, свойства магния, оксид магния, гидроксид магния.
Физические и химические свойства
Магний (Mg) — 12-й элемент периодический системы Д. И. Менделеева. Лёгкий, ковкий щелочноземельный металл серебристо-белого цвета. Шестой элемент по содержанию в земной коре после кислорода, кремния, алюминия железа и кальция. В природе встречается в виде трёх стабильных изотопов:
Длина стороны основания шестиугольной призмы, нм
Высота шестиугольной призмы, нм
Плотность при 20°C, кг/м 3
Плотность при 700°C, кг/м 3
Температурный коэффициент линейного расширения,
Удельное электрическое сопротивление при 20°C,
Температура плавления, °C
Температура кипения, °C
Конфигурация невозбуждённого атома:
. Валентными являются электроны на внешнем электронном уровне (
), которые можно легко оторвать, в результате чего во всех стабильных соединениях Mg имеет валентность Ⅱ.
Магний — сильный восстановитель, при нагревании он способен вытеснять ряд элементов из их оксидов. В ряду активности металлов он стоит левее алюминия, а его потенциал
. Однако потенциал зависит как от значения pH (в щелочной среде потенциал равен
), так и от состава раствора, в котором находится металл: при одном и том же pH в растворе сульфата потенциал менее положителен, чем в растворе хлорида.
При комнатной температуре магний стабилен из-за образования на его поверхности оксидной плёнки
. Но при увеличении температуры его активность возрастает, и при 600–650°C магний, окружённый воздухом, воспламеняется, выделяя большое количества тепла, а также мощное ультрафиолетовое излучение.
Магний образует один основный оксид
— белый порошок, почти нерастворимый в воде. Является тугоплавким соединением (
), а на его активность влияет степень прокалки.
Оксид магния редко встречается в природе в виде минерала периклаз. В основном его получают двумя способами:
- Обжиг карбоната магния(магнезит) в специальных печах (“сухой” способ производства) позволяет в зависимости от условий получать различные виды оксида магния:
- Сначала получение осадка гидроксида магния, взаимодействием сильной щёлочи и раствора бишофита (
легко растворяется в кислотах:
Также реагирует с кислотными оксидами и амфотерными оксидами, образуя двойные соли:
Являясь основным оксидом,
реагирует с водой, образуя гидроксид магния. С холодной водой реакция будет идти очень медленно, но с подогретой или с водяным паром она ускорится:
— практически нерастворимое в воде аморфное вещество белого цвета. Поглощает углекислый газ и воду из воздуха. Является слабым основанием, поэтому термически неустойчив и при температуре выше 350°C разлагается на
и воду. Эта реакция показана в “мокром” способе получения оксида.
встречается в виде минерала брусит или его волокнистой разновидности минерала немалит. Искусственно его чаще всего получают взаимодействием сильной щёлочи и бишофита.
Гидроксид магния проявляет амфотерный характер, то есть взаимодействует как с кислотами, образуя соль и воду, так и со щелочами (но только при нагревании и с сильно концентрированной щёлочью), образуя комплексные соединения:
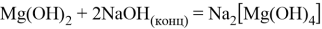
Также реагирует с кислотными оксидами, образуя соль и воду:
При длительном контакте с воздухом
подвергается “старению”, которое вызывает уменьшение дисперсности, то есть укрупнение частиц, что приводит к уменьшению удельной поверхности осадков.
— одно из важнейших соединений магния. Имеет белую окраску. Встречается в природе в виде минерала бишофит, из которого в основном получают магний.
Соединения магния образуют кристаллогидраты с переменным количеством молекул воды:
Магний, как очень активные металл, неустойчив к влаге. При наличии аэрации на его поверхности будет образовываться слой гидроксида:
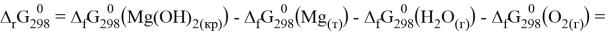
Как видно из термодинамических расчётов данная реакция протекает при стандартных условиях. Если аэрация отсутствует, то в ходе реакции также образуется гидроксид магния, но ещё выделяется водород:
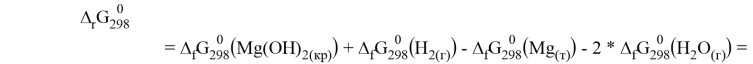
Без аэрации реакция может протекать при стандартных условиях, но медленно, поэтому для увеличения скорости температуру, при которой протекает реакция, надо повысить.
При нахождении магния во влажном воздухе имеет место электрохимическая коррозия. Это происходит из-за того, что на поверхности металла образуется тонкая плёнка воды, в которой растворены присутствующие в воздухе газы и другие вещества. Поэтому атмосферная коррозия магния усиливается по мере увеличения влажности и загрязнённости воздуха, особенно если в воздухе присутствуют хлориды, так как Cl является сильным катализатором коррозии.
Магний реагирует с кислотами неокислителями и кислотами окислителями:
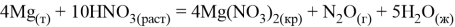
Эти реакции обусловлены его химической активностью: в кислых средах потенциал равен
, из-за чего он вытесняет ион водорода.
Магний не реагирует со щелочами при стандартных условиях, что объясняется образованием пассивирующего слоя на поверхности металла, но при увеличении температуры выше 70°C реакция возможна.
Добыча и получение магния
Магний — один из самых распространённых элементов в земной коре. Он содержится в составе многих минералов: из известных науке 1500 минералов он содержится в 200. Некоторые из них находятся рядом с залежами каменной соли под слоями различных пород, другие же образуют огромные массивы и даже горные хребты. Кроме минералов и горных пород хлорид магния содержится в водах океана, солёных озёрах и минеральных источниках (запасы неисчерпаемы —
Минералы, использующиеся в качестве сырья для добычи магния
% содержания магния или оксида
Ежегодная добыча магния составляет около миллиона тонн. Основные месторождения находятся в Китае, России и США. В то время как на Китай приходится 80 % от мировой добычи магния, на Россию 15 %, на США 5 %, а остальные страны добывают незначительное количество.
Впервые магний был получен восстановлением расплавленного хлорида магния калием:
Хлориды растворяются в воде и поэтому удаётся выделить чистый металл. Сейчас химический способ получения не используется, так как требует использования дорогостоящих восстановителей (калий и натрий), а создать непрерывный технологический процесс не удалось.
В 1830 г. Майкл Фарадей получил магний, пропуская электрический ток через расплав его хлорида. В 1852 г. этот метод был детально исследован и усовершенствован Р. Бунзеном. С помощью электролизера ему удавалось всего за короткое время получать несколько граммов металла.
Технология электролитического получения магния значительно усовершенствована в наши дни, но основные её принципы не претерпели сильных изменений.
Второй способ промышленного получения магния сейчас — термический. Он основан на восстановлении оксида магния углеродистыми и металлическими восстановителями. Впервые этот способ начали использовать в промышленности в 30-х годах XX века. Термических способов несколько:
а. Pidgeon-процесс: разработан в 40-х годах Ллойдом Пидженом в Канадском исследовательском центре. Суть процесса в восстановлении обожжённого доломита ферросилицием:
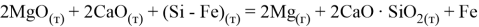
В 60-х годах интерес к данному способу у западных производителей значительно упал из-за высокой трудоёмкости и малой производительности, но получил второе рождение в Китае в конце 70-х годов прошлого века.
б. Процесс Magnetherm: был создан в 1960-х годах в французской фирме Pechiney Electrometallurgie и позволил существенно улучшить технологию силикотермического производства магния. Основное отличие новой технологии заключается в том, что восстановление оксида магния происходит в шлаковом расплаве. В процессе плавления периодически удаляется шлак без нарушения вакуума, что сильно повышает производительность термической установки.
Преимущество термического способа заключается в том, что он позволяет получать более чистый металл.
Применение магния
в конструкционных материалах
Главное преимущество магния — его лёгкость. В чистом виде он обладает невысокой прочностью, но введение в него небольшого числа других элементов сильно улучшает его свойства, как конструкционного металла, при этом не сильно увеличивая вес.
На основе этих свойств в Германии в 1909 году был создан сплав “электрон” (Al — 6 %, Zn — 1 %, Mn — 0,5 %, остальное Mg). Он, как и другие сплавы на основе магния, использовался в авиастроении в середине прошлого века. Но в ходе эксплуатации был выявлен недостаток таких сплавов: при повышении температуры сильно менялись их механические свойства, поэтому они были признаны непригодными. После множества проведённых исследований были открыты новые сплавы, лучше отвечающие поставленным требованиям.
Ещё один недостаток использования магния в качестве конструкционного материала — его высокая химическая активность, увеличивающейся с увеличением температуры, из-за которой он подвержен коррозии. С этим можно бороться, добавляя некоторые примеси. Не все элементы подойдут на эту роль. Так Fe, Ni, Cu, Pb будут только усиливать коррозию, но Mn, Zr, Zn, Ti улучшат коррозионную стойкость. Например, при добавлении менее процента титана к магниевому сплаву коррозионная стойкость увеличивается в 3 раза.
Одним из важнейших созданных сплавов стал “мангалий” (Mg — 5–30 %, остальное Al). Он сплав твёрже и прочнее алюминия, но легче обрабатывается и полируется.
Удельная вибрационная прочность магниевых деталей почти в 100 раз больше, чем у алюминиевых сплавов, и в 20 раз больше, чем у легированной стали. Также магниевые сплавы обладают лучшей удельной жёсткостью и поэтому применяются для изготовления деталей, подвергающимся изгибающим нагрузкам.
Современные сплавы, в которых содержится магний как основной или добавочный компонент, используются в автомобилестроении, корпусах телефонов, фотоаппаратов и видеокамер, ноутбуков, в деталях электроприборов и многих других областях техники.
В металлургии магний используют в процессах металлотермического получения трудновосстанавливаемых и редких металлов (Ті, Be, Zr, Hf, U). Процессы протекают при высокой температуре, когда взаимодействующие компоненты находятся в жидком состоянии. Магниетермия является основным способом получения титановой губки:
Технология получения металлических циркония и гафния во многом схожа с металлургией титана и основана на магниетермическом восстановлении хлоридов.
В черной металлургии магний нашел широкое применение при раскислении и десульфуризации чугуна и стали, что связано с большой химической активностью расплавленного магния по отношению к кислороду и сере.
В России около 80 % от всего используемого магния идёт на получение трудновосстанавливаемых и редких металлов.
В протекторной защите
Электрохимическая защита металлов от коррозии при помощи протекторов основана на значительной разности потенциалов металлов. Так как основная масса металлических конструкций в мире делается из чугуна и стали, в качестве протектора должны использоваться металлы с более отрицательным, чем у железа, электродным потенциалом. Один из них — магний. Его разница потенциалов с железом максимальная, что позволяет использовать этот металл в меньших количествах, чем другие: средний расход магниевых протекторов при защите от коррозии стальных конструкций и сооружений составляет
Широко применяется протекторная защита магнием паровых котлов, конденсаторов и трубчатых холодильников, резервуаров питьевой воды и ряда бытовых приборов, подземных трубопроводов, внутренней поверхности балластных танков наливных судов, морских буев и наружной облицовки. Также возможна катодная или протекторная защита железа магнием в среде расплавленных хлоридов.
Магний необходим для работы сердца, нервной системы, мышц и жизнедеятельности клеток. Если человек потребляет мало свежих овощей, зелени, фруктов или имеет вредные привычки, может развиться дефицит этого вещества. Тогда врачом назначается препарат с содержанием оксида магния, чтобы повысить содержание магния в организме.
Также в медицине применяется и гидроксид магния. В основном он используется в двух целях:
а. Лекарство для нейтрализации кислоты в желудке. Если человек болеет гастритом, в его желудке образуется избыток соляной кислоты. При принятии человека лекарства, содержащего гидроксид магния, он вступает в реакцию нейтрализации с кислотой, тем самым уменьшая её количество:
б. После реакции с кислотой хлорид магния, переходя в кишечник, оказывает послабляющий эффект, действуя как солевое слабительное.
В качестве альтернативного источника энергии
При сжигании магния в воздухе выделяется большое количество энергии —
, что в 4–5 раз больше, чем количество теплоты, которую нужно сообщить магнию для нагревания до температуры горения. Из-за этого магний используют во взрывчатых веществах и твердом ракетном топливе.
Также благодаря этому свойству некоторые учёные видят в магнии альтернативный источник энергии, так как кроме выделения тепла горение магния даёт в качестве отходов оксид, который можно перерабатывать обратно в магний в условиях чрезвычайно высокой температуры и в вакууме или отчищать и использовать в медицине.
Данное применение не распространено из-за высокой стоимости на магний, затрат энергии на нагрев, а также разницы в цене между чистым магнием и его оксидом (в России магний стоит 200 тыс., а оксид 100 тыс.). Всё это приводит к тому, что использовать магний в качестве промышленного источника энергии пока невыгодно.
- Металлургия магния: учебное пособие /В. А. Лебедев, В. И. Седых. Екатеринбург: УГТУ-УПИ, 2010. 174 с.
- Магний /М. А. Эйдезон. М.: «Металлургия», 1969. 352 с.
- Магниды / Г. В. Самсонов, В. П. Перминов. Киев: “Наукова думка”, 1971. — 313 с.
- Гидрокиси металлов / В. П. Чалый. Киев: “Наукова думка”, 1972. — 163 с.
- Перспективы использование магния в качестве возобновляемого источника энергии / Р. К. Костанян, Г. Г. Карамян, П. И. Ивашкин, М. М. Калугин, Г. А. Мартоян. М.: Российская академия наук, 2017. — 28 с.
Основные термины (генерируются автоматически): магний, гидроксид магния, Россия, вид минерала, Китай, минерал, оксид, реакция, сплав, увеличение температуры.
МАГНИЙ
МАГНИЙ
Mg (magnesium),
химический элемент IIA подгруппы периодической системы элементов - семейства щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra). Открыт английским химиком Х.Дэви в 1808. Магний - один из наиболее легких металлов; недостаток его прочности устраняется в сплавах небольшими добавками других металлов. Сплавы магния широко применяют в ракетной технике, самолетостроении, электронной технике, авто-, мото- и приборостроении, для изготовления ручного инструмента, спортивного снаряжения.
См. также СПЛАВЫ. Магний - один из самых распространенных металлов, составляющий 2,09% (масс.) земной коры. Он встречается во многих соединениях - в виде силикатов (тальк 3MgO*4SiO2*H2O, серпентин Mg6[[Si4O10]](OH)8, асбест CaOЧ3MgOЧ4SiO2, оливин (MgFe)2*SiO4, морская пенка, или сепиолит, H4Mg2Si3O10), карбонатов (магнезит MgCO3, доломит MgCO3. CaCO3), хлоридов (карналлит KCl*MgCl2*6H2O, бишофит MgCl2*6H2O), гидроксида (брусит MgO*H2O). Хлорид и сульфат магния присутствуют в минеральных водах, соляных озерах и морской воде. Обширные кристаллические отложения этих солей остаются после испарения воды на суше после отступившего моря; примером служат отложения хлоридов магния в Верхнекамском месторождении. Отложения карналлита в Штасфурте (Германия) являются всемирно известными источниками калия и магния. В малых концентрациях магний рассеян в природе. Почти всякая почва и все растительные и животные ткани, как известно, содержат магний, который, очевидно, играет существенную роль в образовании хлорофилла зеленых растений. СВОЙСТВА МАГНИЯ
Атомный номер 12 Атомная масса 24,305 Изотопы
Температура плавления, ° С 650 Температура кипения, ° С 1107 Плотность, г/см3 1,738 Твердость (по Моосу) 2,0 Содержание в земной коре, % (масс.) 2,09 Степени окисления +2
Свойства. В подгруппе щелочноземельных металлов магний расположен между бериллием и кальцием, имеет степень окисления +2 и по свойствам близок к бериллию. Это блестящий белый металл, очень легкий, достаточно мягкий, ковкий и пластичный. По теплопроводности и электрической проводимости он лишь немного уступает Al. Магний - активный металл, его порошок или тонкая лента при нагревании возгораются, образуя ослепительно белое пламя; продуктами взаимодействия являются оксид MgO в смеси с нитридом MgN2. В сухой атмосфере при обычных условиях стабилен, так как быстро покрывается тонкой защитной оксидной пленкой; компактный металл можно обрабатывать в кузнечном горне. При нагревании соединяется с серой, азотом, галогенами и другими неметаллами. Холодная вода слабо действует на металл, с горячей он медленно реагирует с образованием малорастворимого гидроксида магния, а из паров воды выделяет водород. Mg растворяется в большинстве разбавленных кислот с выделением водорода, но HF слабо действует на Mg (пассивирует его) благодаря образованию на поверхности металла плотной, прочной и нерастворимой пленки фторида. Щелочи на магний не действуют. В сплавах с небольшим количеством других металлов приобретает твердость, прочность, повышается его коррозионная стойкость (особенно в сплавах с марганцем) при малой плотности. Но все же во влажной атмосфере и воде, особенно морской, коррозийонная стойкость сплавов магния относительно невелика. Наиболее ценные мягкие сплавы магния - электроны: Mg - Al - Zn (Al 3-10%, Zn 0,2-3%), Mg - Mn и Mg - Zn - Zr. Mg получают в основном электролизом из расплава MgCl2 при 700° С, а также металлотермическим восстановлением обожженных магнезита, доломита.
См. также МАГНИЕВАЯ ПРОМЫШЛЕННОСТЬ. Чистый магний используется в металлургии для получения некоторых металлов (например, титана), для раскисления и обессеривания в процессе производства сталей и сплавов цветных металлов, в составе реактива Гриньяра в органическом синтезе, в пиротехнике для изготовления осветительных и зажигательных ракет на основе смесей порошка Mg с окислителями.
Соединения. Магний как активный металл образует различные соединения - карбонат, оксид, сульфат и хлорид и другие.
Карбонат. MgCO3 (средняя соль) является основой минерала магнезита. При добавлении его к раствору солей магния образуется основной карбонат магния Mg2(OH)2CO3Ч3H2O. В медицине это препарат белой магнезии - слабительное и антацид; в промышленности в смеси с 15% асбестового волокна служит теплоизолятором, применяется для огнезащиты, для очистки жидкостей; используется также в производстве зубного порошка, пудры, других солей магния, минеральной воды, пигментов, бумаги и резиновых изделий. Основной карбонат хорошо растворим в воде, насыщенной CO2; он образует гидрокарбонат магния Mg(HCO3)2, вызывающий жесткость воды. Оксид MgO (жженая магнезия) - белый рыхлый легкий порошок; его получают прокаливанием среднего или основного карбоната при 700° С. При смешении легкого оксида с раствором хлорида магния образуется прочный магнезиальный цемент, используемый как штукатурка, побелка и для отделки полов. Карбонат, прокаленный выше 1400° C, образует оксид в 3,5 раза плотнее предыдущего MgO, так называемый тяжелый, обожженный до спекания, оксид магния, не содержащий CO2 и не реагирующий с водой. Он имеет температуру плавления 2800° C и в виде магнезиального кирпича является наиболее тугоплавким огнеупорным материалом для металлургических печей, тиглей, труб. Сульфат MgSO4.H2O (минерал кизерит) и MgSO4.7H2O (английская соль) встречаются в водах минеральных источников, но получают их кристаллизацией из раствора магнезита в разбавленной серной кислоте. Кристаллы сульфата бесцветны, выветриваются, хорошо растворяются в воде, имеют горько-соленый вкус. Сульфат магния находит широкое применение в медицинской практике как слабительное и местное обезболивающее, при лечении уремии, столбняка, артритов, ожогов, рожистых воспалений и многих других заболеваний. Его применяют в производстве огнеупоров, удобрений, взрывчатых веществ, минеральных вод, для крашения, печатания, весового анализа. Хлорид кристаллизуется из водных растворов при комнатной температуре в виде кристаллогидрата MgCl2Ч6H2O. При нагревании гидрат выделяет хлороводородную (соляную) кислоту, поэтому морскую воду нельзя использовать в паровых котлах. В реакции с MgO хлорид образует устойчивую основную соль Mg2OCl2. Эта реакция лежит в основе получения магнезиального цемента (сорель-цемента), используемого в качестве заменителя кафеля. Хлорид магния часто присутствует в поваренной соли, и его гигроскопичность может вызывать "твердение" соли в сырую погоду. Хлорид применяют также в производстве огнеупоров, для дезинфекции, пропитки хлопчатобумажных тканей, при изготовлении пергамента и искусственной кожи.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Тихонов В.Н. Аналитическая химия магния. М., 1973 Иванов А.И. и др. Производство магния. М., 1979
Читайте также:
