Массовая доля металла это
Обновлено: 20.09.2024
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок». Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
Раствор — однородная смесь различных веществ в жидком виде.
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике « Химия . 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников

Электронная форма учебника (ЭФУ) Химия. 8 класс включена в состав учебно-методического комплекта (УМК) по предмету Химия 8 класса Габриелян О. С. Химия. 8 класс соответствует требованиям Федерального государственного образовательного стандарта. ЭФУ рекомендована Министерством образования и науки Российской Федерации.
Итак, с теорией разобрались. Переходим к практике.
Дано: Директор школы подозревает, что один из его поваров нечист на руку и ворует сахарозу, которая предназначена для школьных завтраков. Вы работаете экспертами-криминалистами в лаборатории и для исследования вам доставили три стакана с растворами, выданными школьникам в три разных дня.
В первый день школьникам на завтрак выдали 200 г 10% раствора сахарозы, во второй день 200 г 8% раствора, а в третий 200 г 5%. Нужно рассчитать , сколько граммов сахарозы содержится в каждом растворе, и какой из поваров ворует больше всех.
1. Сначала определяем растворитель и растворенное вещество.
В нашем случае это вода и сахароза соответственно.
2. Используя формулу (2) составляем уравнение для первого раствора.
ω (сахарозы)= m (сахарозы)/m (р-ра)*100%
х=20 (г) — сахарозы содержится в первом стакане.
3. Аналогично находим содержание сахарозы в остальных стаканах.
Ответ : В первом растворе содержится 20 граммов сахарозы, во втором 16 граммов, а в третьем всего 10 граммов. Учитывая это, можно предположить, что третий повар ворует больше всех. А вот словить его за руку – задача специалистов другого профиля.
Читайте ещё:
На ферме по выращиванию крокодилов опытным путем установили, что лучше всего крокодилы развиваются в 7% растворе NaСl. Работник фермы оставил на подоконнике склянку со 100 граммами 2% раствора и склянку с 200 граммами 4% раствора. Уборщице тете Мане нужна была пустая склянка, чтобы полить цветы, и она слила растворы в одну емкость. Необходимо определить, сколько граммов NaСl нужно добавить к полученному раствору, чтобы получить 7% раствор.
Задачу лучше решать с помощью таблицы.
| 2% р-р | 4% р-р | х%р-р | 7%р-р |
| m (в-ва) | | | |
| m (р-ра) | | ||
| ω (в-ва) | | |
1. Заполняем известные данные.
100+200 = 300 г ( масса полученного раствора и масса нужного 7% раствора)
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | ||||
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |

Электронная форма учебника (ЭФУ) Химия. 9 класс включена в состав учебно-методического комплекта (УМК) по предмету Химия 9 класса Габриелян О. С. Химия. 9 класс соответствует требованиям Федерального государственного образовательного стандарта. ЭФУ рекомендована Министерством образования и науки Российской Федерации.
2. Используя формулу (2), рассчитываем массу вещества в 2% и 4% растворах.
математически преобразовываем формулу, чтобы найти неизвестное.
m (в-ва)=ω (в-ва)/100%* m (р-ра)
х=2 (г) — содержалось в первом растворе
х=8 (г) — содержалось во втором растворе
3. Определяем, сколько граммов содержится в третьем растворе
2+8=10 (г) — содержится в третьем растворе.
4. Определяем, сколько граммов NaСl должно быть в четвертом растворе.
х=21 (г) — должно содержаться в третьем растворе
| 2% р-р | 4% р-р | х%р-р | 7%р-р | |
| m (в-ва) | 2 | 8 | 10 | 21 |
| m (р-ра) | 100 | 200 | 300 | 300 |
| ω (в-ва) | 2% | 4% | Х | 7% |
5. Определяем, сколько граммов NaСl нужно добавить в третий раствор, чтобы получить нужную концентрацию.
Ответ: 11 граммов NaСl нужно добавить в третий раствор, чтобы получить 7% концентрацию.
Массовая доля

Для производства синтетических материалов, растворов и смесей важно знать не только из чего они состоят, но в каком количестве должен быть добавлен каждый компонент. Если говорить языком химии, нужно знать массовую долю веществ в смеси. Сейчас мы узнаем, что она собой представляет и как ее находить.
О чем эта статья:
Что такое массовая доля
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
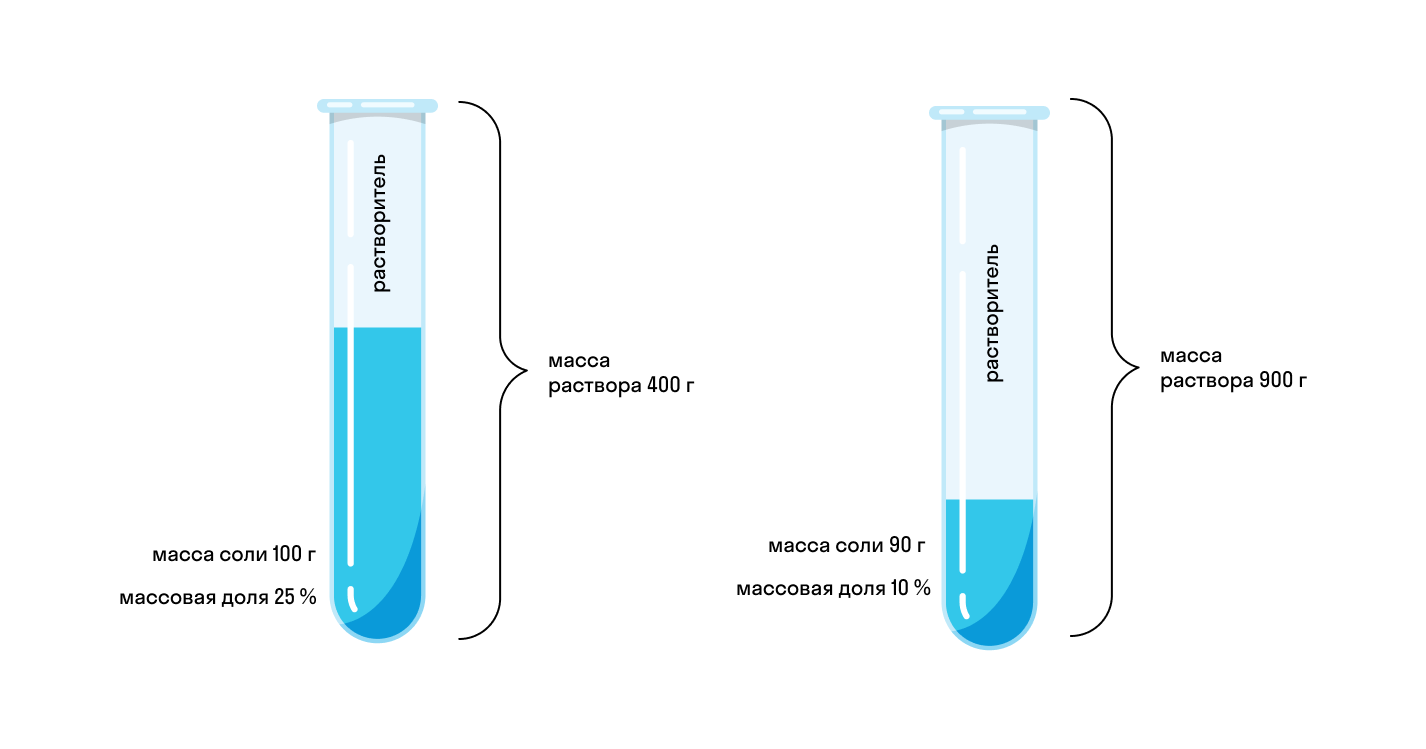
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Определение молярной концентрации вещества
В результате деления целого предмета на части образуются его доли. Они могут быть равными либо нет. В химии существует понятие «массовая доля». Оно характеризует соотношение масс компонентов и выражается в долях единицы или процентах.
Массовая доля в химии — что это за параметр
Массовой долей компонента называется отношение его массы к массе смеси.
Другими словами, массовая доля части в целом расценивается как ее отношение к сумме масс всех, составляющих эту смесь, компонентов.
Для обозначения данного параметра введен символ ω (омега). ω может иметь процентное выражение либо измерятся в долях единицы.
Любая смесь (жидкая, твердая, газообразная) состоит из компонентов, сумма масс которых равна массе смеси. Их количество в единице объема конечного вещества различно. При приготовлении составов используются установленные рецептуры с соотношением компонентов. В смесях природного происхождения состав зависит от условий внешней среды.
Например, атмосферный воздух населенного пункта, имеющего производственный комбинат, будет различным по составу над жилой зоной и в радиусе выбросов в атмосферу производственных газов. Каждый из этих газов составляет в выбросах определенный процент. Зная его, а также общую массу выбросов, можно определить массу каждого компонента воздушной смеси и сравнить ее с аналогичными параметрами воздушных масс над жилой зоной.
На таком же принципе основаны экологические исследования состава вод открытых водоемов, сплавов, концентратов в пищевой промышленности, фармацевтических препаратов и т.д.
Понятие «массовая доля» хоть и является аналогичным понятиям «объемная доля» или «молярность», но отлично тем, что при ее определении используются именно массы компонентов и смеси в целом.
Умение определять массовую долю важно, например, если нужно рассчитать, сколько бензина можно получить из нефти определенной массы или какое количество каждого компонента взять для приготовления синтетических материалов.
От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве. Плотность вещества рассчитывают на основании формулы:
m вещества = ρ вещества × V вещества
Исходя из этой формулы, если плотность воды 1 г/мл, то 1 мл воды будет иметь массу 1 г.
Вычисление массовой доли элемента в веществе
Чтобы определить массовую долю вещества в смеси, следует высчитать соотношение его массы к массе всей смеси. Математически это выражение записывается так:
ω вещества = m вещества ÷ m смеси
Такой метод можно применить и для определения массовой доли элемента в каком-либо веществе. Формула аналогична:
ω элемента = M элемента ÷ M вещества
Например, перед исследователем стоит задача определить массовую долю водорода в этиловом спирте. На первом этапе, исходя из формулы этанола, нужно рассчитать его молярную (относительную молекулярную) массу:
Затем, зная, что относительная атомная масса шести атомов водорода равна 6, составляется выражение:
Полученный результат является безразмерным, но может быть выражен в процентах. Для этого цифра умножается на 100%, и получается 13%.
Трактовка результата задачи следующая: в каждом грамме этилового спирта содержится 0,13 г водорода. Соответственно, с увеличением массы спирта увеличивается и масса содержащегося в нем водорода. Например, в 10 г этанола содержится 1,3 г водорода.
Молярная (относительная молекулярная) масса спирта рассчитывалась путем суммирования атомных масс каждого элемента в зависимости от количества атомов, входящих в молекулу С 2 Н 6 О .
В случае двухкомпонентного раствора его масса будет равна сумме масс растворителя и растворенного вещества. Растворителем при этом часто выступает вода.
Формула молярной концентрации, единица измерения
Если в 1 литре раствора содержится известное количество молей одного из компонентов, то всегда можно рассчитать молярность такого раствора. Молярность, или молярная концентрация, измеряется в м о л ь / д м 3 или м о л ь / л . Также единицы измерения иногда обозначаются как М .
К примеру, для раствора серной кислоты, содержащего в одном литре 2 м о л ь Н 2 S O 4 , молярная концентрация может быть обозначена как 2 М Н 2 S O 4 .
Под молярной концентрацией понимают количество вещества в единице объема раствора
В формуле С М обозначена молярная концентрация вещества или молярность, n — количество вещества, V — объем всего раствора. Получаемая в результате расчетов величина измеряется в м о л ь / л .
Можно выразить молярную концентрацию через массу и объем. Зная, что n = m / M , получаем нужную формулу:
Используя формулу молярной концентрации, можно проводить различные расчеты.
Определить молярную концентрацию раствора глицерина, если известно, что его плотность равна 1 , 1 г / м л .
Решение. Известно, что массовая доля глицерина в растворе с такой плотностью равна 40,36%.
Таким образом, молярная концентрация раствора глицерина с плотностью 1 , 1 г / м л равна 4 , 82 м о л ь / л .
Какова молярность воды при температуре 25°C?
Решение. Литр воды, имеющей температуру 25°C, характеризуется плотностью 0 , 99707 г / м л .
На первом этапе определяем массу и количество воды. На втором — искомую молярную концентрацию воды.
Ответ: молярная концентрация воды с температурой 25°C составляет 55 , 3458 м о л ь / л .
Как перевести одну концентрацию в другую
Концентрация раствора — это количество вещества, содержащееся в единице объема (массы раствора).
В жизни человека окружает много растворов. Они представляют собой однородные устойчивые смеси, состоящие из нескольких компонентов.
Растворы бывают жидкими, твердыми и газообразными.
Состав растворов можно описать с помощью качественных и количественных характеристик. Качественные характеристики состава раствора:
- насыщенный (раствор, в котором данное вещество при данной температуре больше не растворяется);
- ненасыщенный (раствор, в котором при данной температуре еще может раствориться дополнительное количество данного вещества);
- пересыщенный (раствор, содержащий больше растворенного вещества, чем его может растворится при данной температуре, однако образование осадка в нем еще не началось, неустойчив).
Количественными характеристиками являются молярность, нормальность, массовая доля, моляльность, а также титр и мольная доля.
Часто на практике стоит задача перевода одной величины, выражающей состав раствора, в другую. Рассмотрим способ перевода массовой доли в молярную и нормальную концентрацию, а также рассчитаем моляльность, молярность и титр раствора.
Теперь найдем молярность и нормальность раствора:
В заключение найдем моляльность и титр раствора.
На практике, чтобы определить искомые величины, часто пользуются таблицей перевода одной концентрации в другую. Выглядит она следующим образом:
Когда решается задача пересчета массовой доли (или процентной концентрации вещества) в молярную концентрацию, нужно иметь в виду, что массовая доля определяется на основе массы раствора. В то же время для вычисления молярной концентрации, помимо массы, необходимо знать объем или плотность раствора.
В химии существуют общие формулы перевода концентраций. Так, используя вышеприведенные обозначения, формула перевода массовой доли в молярную или нормальную концентрацию имеет следующий вид:
Массовая доля вещества
Читайте также:
