Массовая доля металла в соединении
Обновлено: 16.05.2024
Задачи на смеси — очень частый вид задач в химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет.
О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию.
Получается примерно так:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2H2O.
Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида.
А в приведенном уравнении предполагается, что их равное количество. - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Количество цинка принимается за х, а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны. - Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.
Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
Необходимые теоретические сведения.
Способы выражения состава смесей.
- Массовая доля компонента в смеси — отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
Продукты восстановления азотной кислоты.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| NO2 | NO | N2O | N2 | NH4NO3 |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота | Неактивные металлы (правее железа) + разб. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота | Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления | Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: Al, Cr, Fe, Be, Co. | ||||
| Не реагируют с азотной кислотой ни при какой концентрации: Au, Pt, Pd. | ||||
Продукты восстановления серной кислоты.
| SO2 | S | H2S | H2 | |
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. кислота | Щелочноземельные металлы + конц. кислота | Щелочные металлы и цинк + концентрированная кислота. | Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная) | |
| Пассивация: с холодной концентрированной серной кислотой не реагируют: Al, Cr, Fe, Be, Co. | ||||
| Не реагируют с серной кислотой ни при какой концентрации: Au, Pt, Pd. | ||||
Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (Li, Na, K, Rb, Cs), а также металлы IIA группы: Са, Sr, Ba. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
Решение примера 1.
- Находим количество водорода:
n = V / Vm = 5,6 / 22,4 = 0,25 моль. - По уравнению реакции:
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
Решение примера 2.
- Находим количество водорода:
n = V / Vm = 8,96 / 22,4 = 0,4 моль. - Пусть количество алюминия — х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
| x | 1,5x (мольное соотношение Al:Н2 = 2:3) | |
| 2Al | + 6HCl = 2AlCl3 + | 3H2 |
| y | y | |
| Fe | + 2HCl = FeCl2 + | H2 |
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:
mFe = n • M = 0,1 • 56 = 5,6 г
mAl = 0,2 • 27 = 5,4 г
ωFe = mFe / mсмеси = 5,6 / 11 = 0,50909 (50,91%),
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
Решение примера 5.
- Определяем количество вещества газа:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль. - Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
mраствора = ρ • V = 1,115 • 565 = 630,3 г
mHNO3 = ω • mраствора = 0,2 • 630,3 = 126,06 г
nHNO3 = m / M = 126,06 / 63 = 2 моль
| х + 3у = 0,13 (количество азота) | |
| 65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов) |
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
нитрат цинка в количестве 0,2 моль:
mZn(NO3)2 = n • M = 0,2 • 189 = 37,8 г
нитрат алюминия в количестве 0,3 моль:
mAl(NO3)3 = n • M = 0,3 • 213 = 63,9 г
избыток азотной кислоты в количестве 0,44 моль:
mHNO3ост. = n • M = 0,44 • 63 = 27,72 г
| Масса нового раствора | = | Сумма масс смешиваемых растворов и/или веществ | - | Масса осадков | - | Масса газов |
Тогда для нашей задачи:
mнов. раствора = масса раствора кислоты + масса сплава металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов. раствора = 630,3 + 21,1 − 3,36 = 648,04 г
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — 8,96 л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO2, а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Задачи для самостоятельного решения.
1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси.
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?
2-6. После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
3. Три металла и сложные задачи.
3-1. При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. 14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. 13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г?
3-8. Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси.
Массовая доля

Для производства синтетических материалов, растворов и смесей важно знать не только из чего они состоят, но в каком количестве должен быть добавлен каждый компонент. Если говорить языком химии, нужно знать массовую долю веществ в смеси. Сейчас мы узнаем, что она собой представляет и как ее находить.
О чем эта статья:
Что такое массовая доля
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
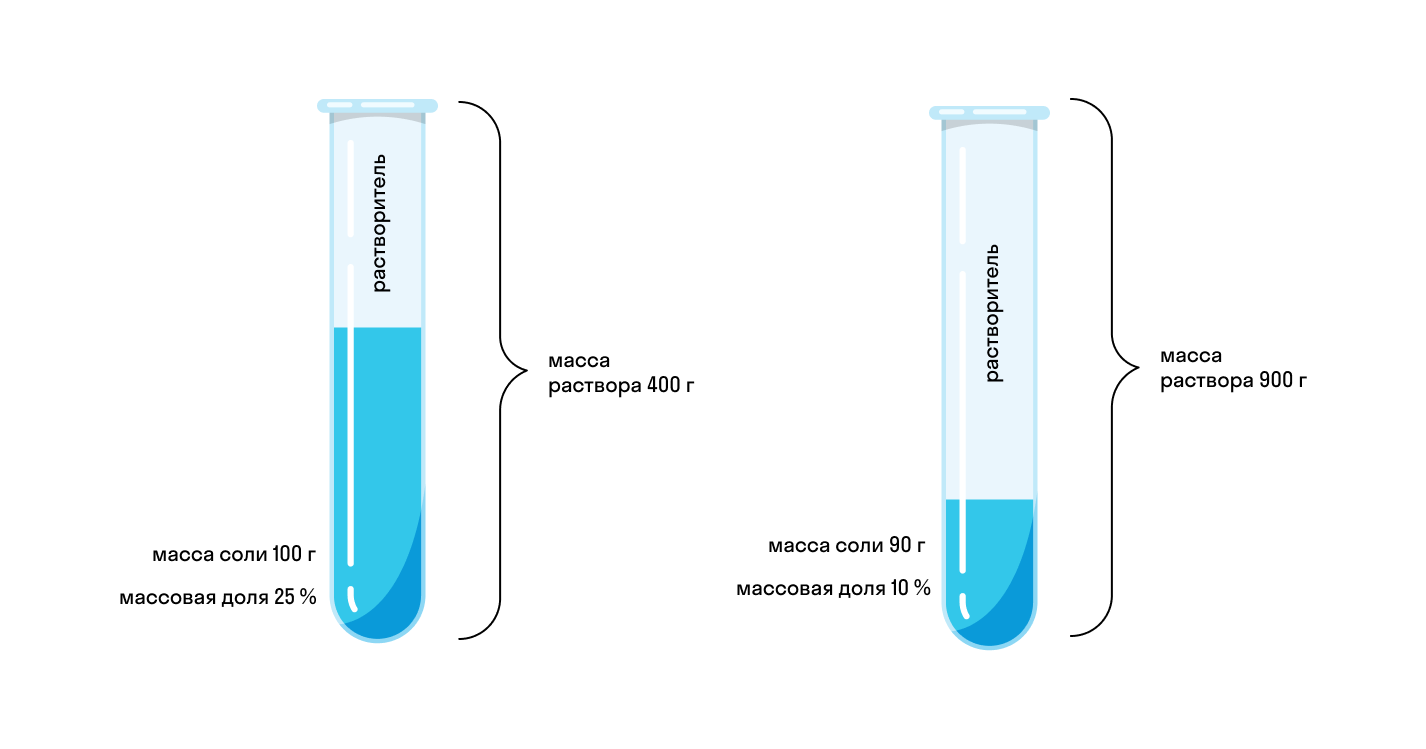
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
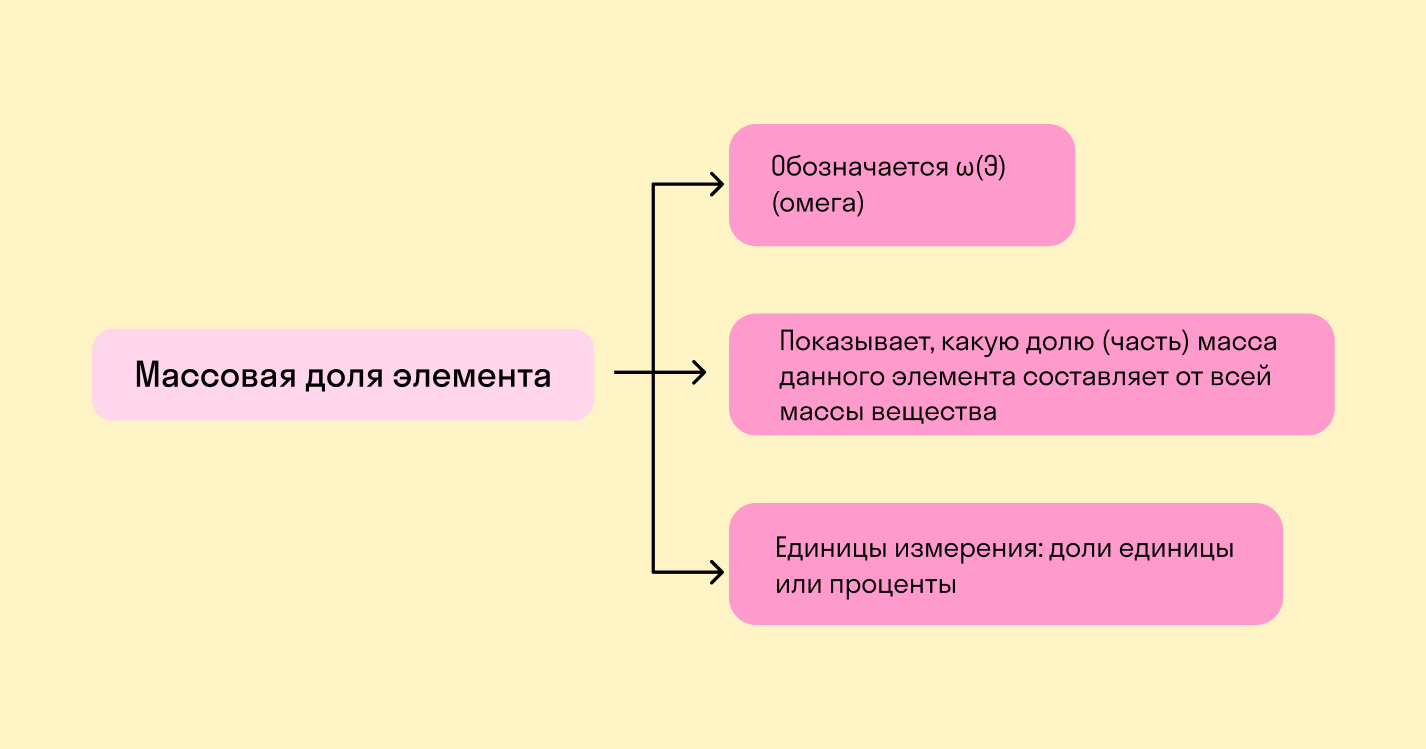
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Численно относительная молекулярная масса вещества равна его молярной массе, что удобно использовать в расчетах. Но путать эти два понятия не стоит. Относительная молекулярная масса характеризует 1 молекулу вещества, в то время как молярная масса — 1 моль вещества.
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Задачи на смеси и сплавы металлов
Задачи на смеси и сплавы на ЕГЭ по химии
Задачи на смеси и сплавы — очень частый вид задач на ЕГЭ по химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет.
О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
Типичные заблуждения и ошибки при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию.Вот одна из распространенных ошибок:
«Смесь оксидов кальция и бария растворили в соляной кислоте…»Многие выпускники пишут уравнение реакции так:
Способы выражения состава смесей.
- Массовая доля компонента в смеси— отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
где
– "омега", массовая доля компонента в смеси,
– масса компонента,
– масса смеси
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это .
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| Неактивные металлы (правее железа) + конц. кислота | ||||
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы ( ), а также металлы IIA группы: . При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
Внимание! Многие ошибки в решении задач ЕГЭ по химии связаны с тем, что школьники плохо владеют математикой. Специально для вас - материал о том, как решать задачи на проценты, сплавы и смеси.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
- Находим количество водорода: моль.
- По уравнению реакции:
Количество железа тоже 0,25 моль. Можно найти его массу:
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за — число моль одного из металлов, а за — количество вещества второго.
- Находим количество водорода: моль.
- Пусть количество алюминия — моль, а железа моль. Тогда можно выразить через и количество выделившегося водорода:
а масса всей смеси
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
- С концентрированной серной кислотой реагирует только медь, число моль газа: моль
Так как мольное соотношение меди и сернистого газа , то меди тоже моль.
Можно найти массу меди:
Ты нашел то, что искал? Поделись с друзьями!
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
- Определяем количество вещества газа: моль.
- Определяем массу раствора азотной кислоты, массу и количество вещества растворенной :
Проверим массу смеси:
т.е. кислота была в избытке и можно вычислить её остаток в растворе:
нитрат цинка в количестве моль:
нитрат алюминия в количестве моль:
избыток азотной кислоты в количестве моль:
= масса раствора кислоты + масса сплава металлов — масса азота
Пример 6. При обработке г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт , а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
1-1. Смесь меди и алюминия массой г обработали -ным раствором азотной кислоты, при этом выделилось л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой г обработали концентрированным раствором щелочи. При этом выделилось л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой г растворили в разбавленной серной кислоте. Получили сульфат цинка массой г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой г на избыток раствора хлорида меди (II) образовалось г меди. Определите состав исходной смеси.
1-6. Какая масса -ного раствора соляной кислоты потребуется для полного растворения г смеси цинка с оксидом цинка, если при этом выделился водород объемом л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте г смеси железа и меди выделяется оксид азота (II) объемом л (н.у.). Определите состав исходной смеси.
1-8. При растворении г смеси железных и алюминиевых опилок в -ном растворе соляной кислоты ( г/мл) выделилось л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
2-1. Смесь кальция и алюминия массой г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения г сплава магния с алюминием использовано мл -ного раствора серной кислоты ( г/мл). Избыток кислоты вступил в реакцию с мл раствора гидрокарбоната калия с концентрацией моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой г с хлором образовалась смесь хлоридов железа (II) и (III) массой г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила ?
2-6. После обработки избытком брома смеси калия и магния общей массой г масса полученной смеси твердых веществ оказалась равной г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой г окислили избытком кислорода, всего было израсходовано л (н.у.). Полученную смесь растворили в г -го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
3-1. При обработке г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении (в порядке перечисления). г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой г (массы всех компонентов равны) поместили в раствор соляной кислоты массой г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой г?
3-8. Смесь хрома, цинка и серебра общей массой г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной г. Вычислите массовые доли металлов в исходной смеси.
Читайте также:
