Медь активный или неактивный металл
Обновлено: 18.05.2024
Чем примечательна медь, и за какие такие заслуги ее считают одним из важнейших металлов в истории человечества? Каковы ее плотность, температура плавления и прочие физико-химические свойства? Чем вызван скачок цен на медь в 2020-2021 гг., и почему это в общем-то только начало? Отвечаем на эти и другие вопросы в нашей четвертой статье из цикла «материаловедение».

Медь (Cu) – мягкий и пластичный металл золотисто-розового цвета, 29-й элемент периодической системы. Это один из главных промышленных металлов. По объемам производства среди цветметов медь вторая вслед за алюминием.
Ковкая и устойчивая к коррозии, медь используется в инженерных коммуникациях, машино- и судостроении, ювелирном деле. Однако до 60% от производимых объемов идет на электротехнику и энергетику. И это вполне логично: по тепло- и электропроводности медь впереди всех промышленных металлов и дышит в спину только серебру. Но сколько стоит медь, а сколько – серебро. Разница в цене стократная.

Медь – один из первых металлов на службе у человека. И это неспроста. Начнем с простого факта: чистая медь – химически неактивный металл, она не стремится к взаимодействию с другими элементами и веществами, как тот же алюминий. Вот почему в природе она часто встречается в самородках, даже чаще, чем железо. Кроме того, у нее умеренная температура плавления – 1 085°C, тогда как у железа 1539 °C
Одни из древнейших медных артефактов возрастом 8500 лет обнаружены на раскопках поселения Чатал-Хююк (Турция). При экскавации кургана археологи нет-нет да находили окалины и шлак – казалось бы, явные свидетельства переплавки медной руды. Впрочем, некоторые ученые воздерживаются от скоропалительных выводов. По их версии, куски руды могли образоваться случайно в попытках намешать краску для ритуальных погребений.
Тем не менее к IV тысячелетию до н. э. медь приручили если и не все цивилизации, то многие. Сперва медные самородки обрабатывали холодной ковкой: заготовки для наконечников копий и будущие лезвия топоров обстукивали камнями до нужной формы. Горючую же ковку миру явила невероятно продвинутая по тем временам кипро-минойская цивилизация. Как показывают раскопки, в III тысячелетии до н. э. на Кипре уже вовсю плавили медь из малахита, бирюзы и других окисных руд. Отсюда, между прочим, и латинское название меди Cuprum, производное от Aes Cyprium («металл Кипра»).
Сегодня медь добывают в основном из сернистых соединений CuS, Cu2S сульфидных руд: медного колчедана, медного блеска и др. В России крупнейшее медные месторождения сосредоточены в Красноярском крае и Забайкалье, а ведущим производителем считается «Норникель».

Чистая медь – мягкий и пластичный металл из семейства переходных. Она легко тянется в проволоку, хорошо обрабатывается давлением в горячем и холодном состоянии, сваривается почти всеми видами термомеханической сварки и сносно режется. К технологическим недостаткам относят низкие литейные качества. Дело в том, что расплав меди густотекучий, отливки дают большую усадку, а это требует сложных расчетов и вообще делает расход материала непомерным.
Плотность: 8933 кг/м3 (8,93 г/см3). Изделия из меди и медных сплавов увесистые. Подсчитано, что если в легковушке заменить всю медную проволоку алюминиево-циркониевой, то автомобиль «сбросит» около 12 кг.
Температура плавления: 1083°C. Это среднеплавкий металл. Для сравнения: у цинка температура плавления – 419,5°C, у алюминия – 658°C, железа – 1 539°C.
Коэффициент теплопроводности: 394 Вт/(м·К). Высокая теплопроводность делает медь эффективной в радиаторах охлаждения, отопления и кондиционирования, системах водоснабжения.
Электропроводность: 55,5—58 МСм/м. Этот показатель падает с увеличением доли примесей. По этой причине провода по нормативам изготавливают из меди с примесями не более 0,1% от состава.
Высокая стойкость к коррозии. Причем не только в пресной и морской воде, но и в различных химических средах, включая органические кислоты, едкие щелочи и галогены.
Цвет: от золотисто-розового до желто-красного. Желтоватые нотки – заслуга оксидной пленки, образующейся при взаимодействии с воздухом. Впоследствии эта пленка служит естественной защитой от коррозии. Отметим, что медь окисляется даже при комнатной температуре, чем разительно отличается от золота и серебра.

Поскольку медь отлично проводит электричество, ее активно используют в электронике, смартфонах, телевизорах, компьютерах и т. д.

В домах с медными трубами аварийные ситуации – редкость. Для сравнения: по данным ВЦИОМ за 2006 год, в первые три года использования пластиковых труб аварии случаются в 8 квартирах из 100. Кроме того, медь в отличие от пластика инертна к хлору и благодаря ионизации имеет антибактерицидные свойства. Совсем как серебро. Это, к слову, объясняет, почему поручни и дверные ручки из медесодержащих сплавов называют самоочищающимися.

От внутриквартирной разводки до перекачки мазута – медные трубы пригодятся в самом широком спектре инженерных работ. При этом срок их службы может достигать 50-100 лет.

Всего лишь одна ветряная турбина мощностью 3 МВт нуждается в более 4 т меди. Отметим, что в том числе переход на зеленую энергетику со всеми ее солнечными панелями и ветрогенераторами спровоцировал стремительный рост цен на медь, наметившийся еще с 2017 года.

Медь сплавляют с золотом, чтобы придать тому большую прочность на изгиб и стойкость к истиранию. Те же розовое и красное золото – это все сплавы меди с чистым желтым золотом в пропорции 1:3 (для пробы 750).

Первичная медь маркируется по ГОСТ 859-2014 буквой М и числом, обозначающей чистоту металла. Самая беспримесная марка однокомпонентной меди – М006, переплавляемая из катодов в вакууме, восстановительной или инертной атмосфере. Степень ее чистоты не менее 99,99%. Для сравнения: получаемая переплавкой лома М3 содержит 99,5% меди.
Иногда после числа в маркировке стоит буква: М1ф, М2р… Эта буква на конце обозначает легирующий элемент либо указывает степень раскисления. К примеру, в марке М1ф помимо собственно меди (99,9%) содержится фосфор (0,04%) и другие примеси. В марке М2р 99,7% меди, 0,01% раскисляющего кислорода и до 0,06% фосфора, а остальное – примеси.
Отметим, что примеси в составе значительно снижают характеристики меди, в первую очередь тепло- и электропроводность. Особенно критично в этом плане превышение доли мышьяка (As) и сурьмы (Sb). По этой причине как проводник используют только электролитическую медь чистых марок: М1 (99,9%), М0 (99,93%) и практически беспримесную М006 (99,99%).
Для большей прочности и улучшения технологических свойств (в первую очередь – литейных) в меди растворяют различные легирующие компоненты: Zn, Sn, Be, Ae, Mn, Ni, Si. В целом по химическому составу все сплавы на основе меди можно разделить на три большие группы: латуни, бронзы и медно-никелевые сплавы.

Медный сплав с добавлением цинка (от 5 до 45%) и иногда другими присадками. Цвет всегда с блеском и в зависимости от содержания цинка варьируется от красно-желтого или желтого (Zn ≤ 20%) до чуть зеленоватого (Zn 36-45%). Если сравнивать с медью, латунь удобнее в литье, но склонна к растрескиванию под напряжением и хуже реагирует на морскую воду. Применение: сантехника, коммутирующие устройства в электротехнике, различная фурнитура, украшения и др.

Сплав меди с оловом (~12%) и другими легирующими компонентами: алюминием, марганцем, фосфором, кремнием и др. Цвет красновато-коричневый. Будучи более хрупкими, чем медь и латунь, многие бронзы тем не менее прекрасно подходит для художественного литья, давая всего 1% усадки. Также бронза отлично противостоит морской воде и агрессивной химии, из-за чего применяется в топливной и паровой арматуре. Кому-то она известна и как подшипниковый материал – дают о себе знать отменные антифрикционные свойства.

В частности, конструкционные сплавы мельхиор (Ni 5-30%) и нейзильбер (Ni 5-35%, Zn 13-45%). Меньше на слуху электротехнические сплавы константан (Ni 39-41%, Mn 1-2%) и копель (Ni 43-44%, Fe 2-3%).
Применяются медно-никелевые сплавы в изготовлении реостатов и резисторов; в судостроении; в медицинской промышленности; в чеканке монет. В частности, до 2009 года из сплавов меди с никелем чеканились монеты Банка России в 1 и 2 рубля. В 2009 году материал поменяли: с тех пор это сталь с гальванопокрытием. Что ж, посткризисное время требует посткризисных решений.
На середину июля 2021 года цена за 1 кг меди на пунктах приема составляет от ~300 руб. за медно-никелевую трубу МНЖ5-1 до ~550 руб. за блестящий медный кабель.
Что касается цен на биржах, то после шокировавшего многих зимнего пика наметился курс на постепенную стабилизацию. На момент написания статьи на Лондонской бирже медь торгуется по стоимости $9 419,2817 за тонну.

Стабилизация – стабилизацией, но отката цен к уровню 2019 года пока не предвидится. Куда вероятнее нас ждет новый виток роста. Тому есть несколько причин. Самые очевидные – разгон мировой инфляции и дефицит металлопроката, вызванный прекращением сбора лома в первую волну коронавирусных карантинов, лавиной отложенного спроса впоследствии. В долгосрочной перспективе во все это вмешается еще и агрессивная политика озеленения энергетики. На декарбонизацию экономик согласно целям устойчивого развития, навязанных ООН и расписанных на первом этапе до 2030 года, понадобится много редкоземельных и цветных металлов. И медь в этом списке значится чуть ли не первой.

В чистом виде медь в производстве замочно-скобяных изделий не используется. Зато в ход идут медные и медесодержащие сплавы, прежде всего латунь и ЦАМ (цинковый сплав с Cu ~1%).
Если упрощенно, то чем больше меди в сплаве, тем качественнее фурнитура: точнее в размерах, дольше держит покрытие, лучше противостоит коррозии. К примеру, дверные петли Palladium отлиты из премиальной латуни Class A с Cu 54-57,4%. Отсюда эталонная геометрия, поразительная плавность хода и срок службы длиной в вечность. Также отметим латунные навесные замки Palladium и смесители Manzzaro. В последних, кстати, используется латунь ЛЦ40С с Cu 59-60%.
И в заключение о фурнитуре из медесодержащего сплава ЦАМ, прежде всего – о дверных ручках. В самом материале меди ~1%. Однако меднение является важнейшим этапом в гальванизации, от него зависит долговечность наносимого покрытия. Если производитель схитрил и недоложил адгезионный медный слой в требуемую толщину, ручка потрется или потемнеет за 1-2 года. При честном же соблюдении технологии ручка из ЦАМ должна сохранять близкий к товарному вид 5-10 лет. Даже если установлена на двери в ванной, на кухне и в других помещениях с капризной средой.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
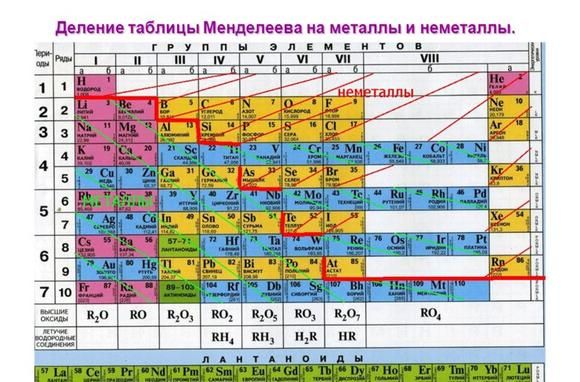
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Химические свойства металлов

Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
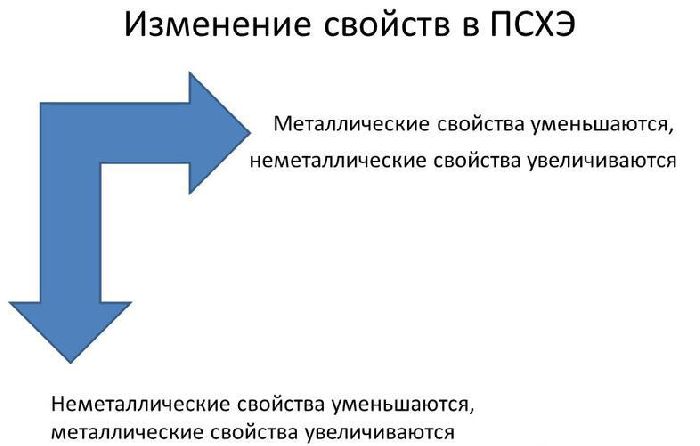
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Особенности
Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина
При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление
Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
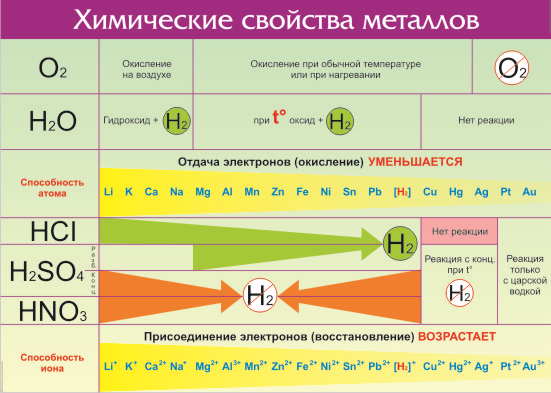
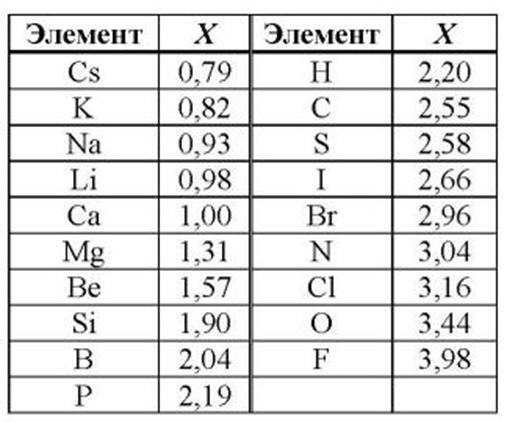
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Читайте также:
