Медь это активный или неактивный металл
Обновлено: 20.09.2024
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Материаловедение: медь
Чем примечательна медь, и за какие такие заслуги ее считают одним из важнейших металлов в истории человечества? Каковы ее плотность, температура плавления и прочие физико-химические свойства? Чем вызван скачок цен на медь в 2020-2021 гг., и почему это в общем-то только начало? Отвечаем на эти и другие вопросы в нашей четвертой статье из цикла «материаловедение».

Медь (Cu) – мягкий и пластичный металл золотисто-розового цвета, 29-й элемент периодической системы. Это один из главных промышленных металлов. По объемам производства среди цветметов медь вторая вслед за алюминием.
Ковкая и устойчивая к коррозии, медь используется в инженерных коммуникациях, машино- и судостроении, ювелирном деле. Однако до 60% от производимых объемов идет на электротехнику и энергетику. И это вполне логично: по тепло- и электропроводности медь впереди всех промышленных металлов и дышит в спину только серебру. Но сколько стоит медь, а сколько – серебро. Разница в цене стократная.

Медь – один из первых металлов на службе у человека. И это неспроста. Начнем с простого факта: чистая медь – химически неактивный металл, она не стремится к взаимодействию с другими элементами и веществами, как тот же алюминий. Вот почему в природе она часто встречается в самородках, даже чаще, чем железо. Кроме того, у нее умеренная температура плавления – 1 085°C, тогда как у железа 1539 °C
Одни из древнейших медных артефактов возрастом 8500 лет обнаружены на раскопках поселения Чатал-Хююк (Турция). При экскавации кургана археологи нет-нет да находили окалины и шлак – казалось бы, явные свидетельства переплавки медной руды. Впрочем, некоторые ученые воздерживаются от скоропалительных выводов. По их версии, куски руды могли образоваться случайно в попытках намешать краску для ритуальных погребений.
Тем не менее к IV тысячелетию до н. э. медь приручили если и не все цивилизации, то многие. Сперва медные самородки обрабатывали холодной ковкой: заготовки для наконечников копий и будущие лезвия топоров обстукивали камнями до нужной формы. Горючую же ковку миру явила невероятно продвинутая по тем временам кипро-минойская цивилизация. Как показывают раскопки, в III тысячелетии до н. э. на Кипре уже вовсю плавили медь из малахита, бирюзы и других окисных руд. Отсюда, между прочим, и латинское название меди Cuprum, производное от Aes Cyprium («металл Кипра»).
Сегодня медь добывают в основном из сернистых соединений CuS, Cu2S сульфидных руд: медного колчедана, медного блеска и др. В России крупнейшее медные месторождения сосредоточены в Красноярском крае и Забайкалье, а ведущим производителем считается «Норникель».

Чистая медь – мягкий и пластичный металл из семейства переходных. Она легко тянется в проволоку, хорошо обрабатывается давлением в горячем и холодном состоянии, сваривается почти всеми видами термомеханической сварки и сносно режется. К технологическим недостаткам относят низкие литейные качества. Дело в том, что расплав меди густотекучий, отливки дают большую усадку, а это требует сложных расчетов и вообще делает расход материала непомерным.
Плотность: 8933 кг/м3 (8,93 г/см3). Изделия из меди и медных сплавов увесистые. Подсчитано, что если в легковушке заменить всю медную проволоку алюминиево-циркониевой, то автомобиль «сбросит» около 12 кг.
Температура плавления: 1083°C. Это среднеплавкий металл. Для сравнения: у цинка температура плавления – 419,5°C, у алюминия – 658°C, железа – 1 539°C.
Коэффициент теплопроводности: 394 Вт/(м·К). Высокая теплопроводность делает медь эффективной в радиаторах охлаждения, отопления и кондиционирования, системах водоснабжения.
Электропроводность: 55,5—58 МСм/м. Этот показатель падает с увеличением доли примесей. По этой причине провода по нормативам изготавливают из меди с примесями не более 0,1% от состава.
Высокая стойкость к коррозии. Причем не только в пресной и морской воде, но и в различных химических средах, включая органические кислоты, едкие щелочи и галогены.
Цвет: от золотисто-розового до желто-красного. Желтоватые нотки – заслуга оксидной пленки, образующейся при взаимодействии с воздухом. Впоследствии эта пленка служит естественной защитой от коррозии. Отметим, что медь окисляется даже при комнатной температуре, чем разительно отличается от золота и серебра.

Поскольку медь отлично проводит электричество, ее активно используют в электронике, смартфонах, телевизорах, компьютерах и т. д.

В домах с медными трубами аварийные ситуации – редкость. Для сравнения: по данным ВЦИОМ за 2006 год, в первые три года использования пластиковых труб аварии случаются в 8 квартирах из 100. Кроме того, медь в отличие от пластика инертна к хлору и благодаря ионизации имеет антибактерицидные свойства. Совсем как серебро. Это, к слову, объясняет, почему поручни и дверные ручки из медесодержащих сплавов называют самоочищающимися.

От внутриквартирной разводки до перекачки мазута – медные трубы пригодятся в самом широком спектре инженерных работ. При этом срок их службы может достигать 50-100 лет.

Всего лишь одна ветряная турбина мощностью 3 МВт нуждается в более 4 т меди. Отметим, что в том числе переход на зеленую энергетику со всеми ее солнечными панелями и ветрогенераторами спровоцировал стремительный рост цен на медь, наметившийся еще с 2017 года.

Медь сплавляют с золотом, чтобы придать тому большую прочность на изгиб и стойкость к истиранию. Те же розовое и красное золото – это все сплавы меди с чистым желтым золотом в пропорции 1:3 (для пробы 750).

Первичная медь маркируется по ГОСТ 859-2014 буквой М и числом, обозначающей чистоту металла. Самая беспримесная марка однокомпонентной меди – М006, переплавляемая из катодов в вакууме, восстановительной или инертной атмосфере. Степень ее чистоты не менее 99,99%. Для сравнения: получаемая переплавкой лома М3 содержит 99,5% меди.
Иногда после числа в маркировке стоит буква: М1ф, М2р… Эта буква на конце обозначает легирующий элемент либо указывает степень раскисления. К примеру, в марке М1ф помимо собственно меди (99,9%) содержится фосфор (0,04%) и другие примеси. В марке М2р 99,7% меди, 0,01% раскисляющего кислорода и до 0,06% фосфора, а остальное – примеси.
Отметим, что примеси в составе значительно снижают характеристики меди, в первую очередь тепло- и электропроводность. Особенно критично в этом плане превышение доли мышьяка (As) и сурьмы (Sb). По этой причине как проводник используют только электролитическую медь чистых марок: М1 (99,9%), М0 (99,93%) и практически беспримесную М006 (99,99%).
Для большей прочности и улучшения технологических свойств (в первую очередь – литейных) в меди растворяют различные легирующие компоненты: Zn, Sn, Be, Ae, Mn, Ni, Si. В целом по химическому составу все сплавы на основе меди можно разделить на три большие группы: латуни, бронзы и медно-никелевые сплавы.

Медный сплав с добавлением цинка (от 5 до 45%) и иногда другими присадками. Цвет всегда с блеском и в зависимости от содержания цинка варьируется от красно-желтого или желтого (Zn ≤ 20%) до чуть зеленоватого (Zn 36-45%). Если сравнивать с медью, латунь удобнее в литье, но склонна к растрескиванию под напряжением и хуже реагирует на морскую воду. Применение: сантехника, коммутирующие устройства в электротехнике, различная фурнитура, украшения и др.

Сплав меди с оловом (~12%) и другими легирующими компонентами: алюминием, марганцем, фосфором, кремнием и др. Цвет красновато-коричневый. Будучи более хрупкими, чем медь и латунь, многие бронзы тем не менее прекрасно подходит для художественного литья, давая всего 1% усадки. Также бронза отлично противостоит морской воде и агрессивной химии, из-за чего применяется в топливной и паровой арматуре. Кому-то она известна и как подшипниковый материал – дают о себе знать отменные антифрикционные свойства.

В частности, конструкционные сплавы мельхиор (Ni 5-30%) и нейзильбер (Ni 5-35%, Zn 13-45%). Меньше на слуху электротехнические сплавы константан (Ni 39-41%, Mn 1-2%) и копель (Ni 43-44%, Fe 2-3%).
Применяются медно-никелевые сплавы в изготовлении реостатов и резисторов; в судостроении; в медицинской промышленности; в чеканке монет. В частности, до 2009 года из сплавов меди с никелем чеканились монеты Банка России в 1 и 2 рубля. В 2009 году материал поменяли: с тех пор это сталь с гальванопокрытием. Что ж, посткризисное время требует посткризисных решений.
На середину июля 2021 года цена за 1 кг меди на пунктах приема составляет от ~300 руб. за медно-никелевую трубу МНЖ5-1 до ~550 руб. за блестящий медный кабель.
Что касается цен на биржах, то после шокировавшего многих зимнего пика наметился курс на постепенную стабилизацию. На момент написания статьи на Лондонской бирже медь торгуется по стоимости $9 419,2817 за тонну.

Стабилизация – стабилизацией, но отката цен к уровню 2019 года пока не предвидится. Куда вероятнее нас ждет новый виток роста. Тому есть несколько причин. Самые очевидные – разгон мировой инфляции и дефицит металлопроката, вызванный прекращением сбора лома в первую волну коронавирусных карантинов, лавиной отложенного спроса впоследствии. В долгосрочной перспективе во все это вмешается еще и агрессивная политика озеленения энергетики. На декарбонизацию экономик согласно целям устойчивого развития, навязанных ООН и расписанных на первом этапе до 2030 года, понадобится много редкоземельных и цветных металлов. И медь в этом списке значится чуть ли не первой.

В чистом виде медь в производстве замочно-скобяных изделий не используется. Зато в ход идут медные и медесодержащие сплавы, прежде всего латунь и ЦАМ (цинковый сплав с Cu ~1%).
Если упрощенно, то чем больше меди в сплаве, тем качественнее фурнитура: точнее в размерах, дольше держит покрытие, лучше противостоит коррозии. К примеру, дверные петли Palladium отлиты из премиальной латуни Class A с Cu 54-57,4%. Отсюда эталонная геометрия, поразительная плавность хода и срок службы длиной в вечность. Также отметим латунные навесные замки Palladium и смесители Manzzaro. В последних, кстати, используется латунь ЛЦ40С с Cu 59-60%.
И в заключение о фурнитуре из медесодержащего сплава ЦАМ, прежде всего – о дверных ручках. В самом материале меди ~1%. Однако меднение является важнейшим этапом в гальванизации, от него зависит долговечность наносимого покрытия. Если производитель схитрил и недоложил адгезионный медный слой в требуемую толщину, ручка потрется или потемнеет за 1-2 года. При честном же соблюдении технологии ручка из ЦАМ должна сохранять близкий к товарному вид 5-10 лет. Даже если установлена на двери в ванной, на кухне и в других помещениях с капризной средой.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
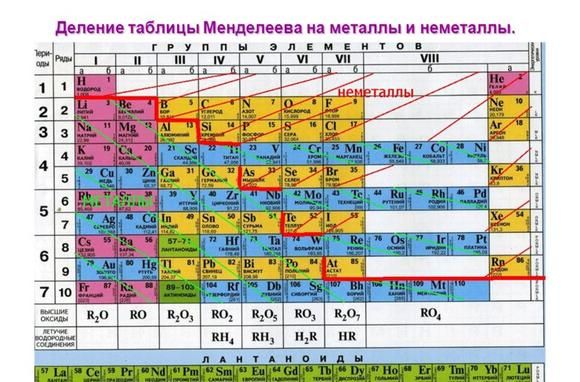
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Химические свойства металлов

Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
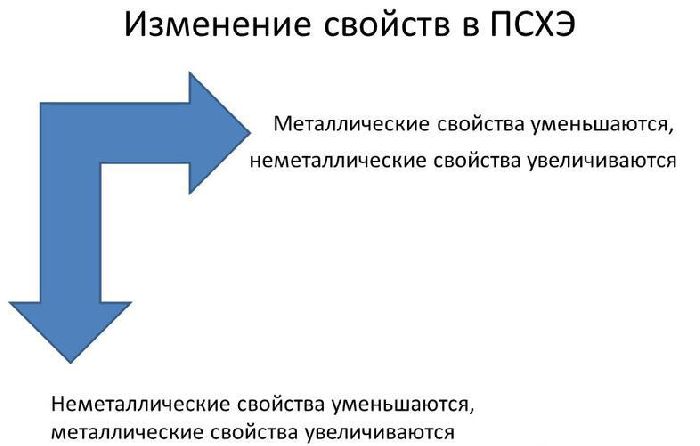
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Особенности
Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина
При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление
Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
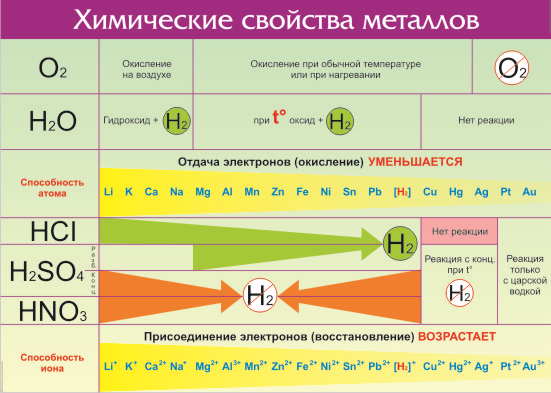
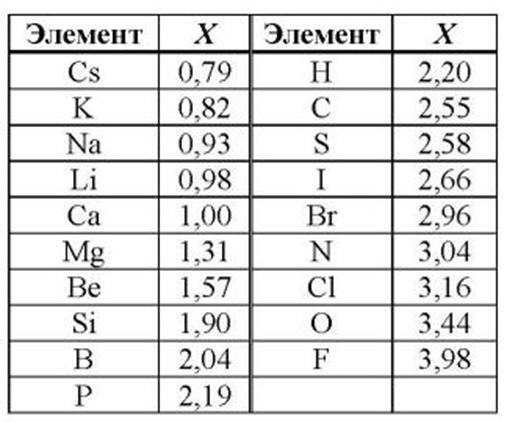
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Читайте также:
