Металл cu что это
Обновлено: 05.05.2024
МЕДЬ
Cu (cuprum),
химический элемент IB подгруппы (семейства монетных металлов - Cu, Ag, Au) периодической системы элементов. Известна и широко используется с древних времен (медный век, бронзовый век). Медь наряду с серебром и золотом используется для чеканки монет, применяется в произведениях искусства и в электротехнике. Медь получают из ее руд: куприта, содержащего оксид меди, малахита, содержащей основной карбонат меди, халькозина (медный блеск) и халькопирита (медный колчедан), содержащих сульфид меди. Мировым лидером по производству меди считается Чили, затем идут США, Россия, Казахстан, Канада, Замбия, Заир, Польша и Перу.
Свойства. Медь - мягкий, тяжелый, ковкий, тягучий, вязкий и достаточно прочный металл красновато-желтого цвета в отраженном свете и зеленый в проходящем (в очень тонком слое). Чистая медь очень хорошо проводит тепло и электрический ток, уступая в этом только серебру, но ее электрическая проводимость резко падает в присутствии примесей мышьяка, сурьмы, кремния и др. Расплавленная медь поглощает воздух и после затвердевания в отливке остаются пузырьки воздуха, затрудняющие обработку. В ряду напряжений медь стоит после водорода и при реакции с кислотами не вытесняет из них водород, поэтому медь широко используется в гальванических элементах. Медь устойчива к коррозии при обычной температуре в сухом воздухе, но при нагревании окисляется, образуя оксиды меди(I) и меди(II): Cu2O и CuO. При долговременной атмосферной коррозии постепенно образует основной карбонат, по составу аналогичный малахиту: 2Cu + O2 + CO2 + H2O = Cu2(OH)2CO3. С галогенами медь соединяется уже при комнатной температуре, легко взаимодействует с серой и селеном; с водородом, азотом и углеродом не реагирует даже при высокой температуре. В отсутствие кислорода медь не реагирует ни с хлороводородной (соляной) кислотой, ни с разбавленной серной, но растворяется в горячей концентрированной серной кислоте (Cu + 2H2SO4 (r) CuSO4 + SO2 + 2H2O) и хорошо в азотной, образуя нитрат меди и оксиды азота. СВОЙСТВА МЕДИ
Атомный номер 29 Атомная масса 63,54 Изотопы
Температура плавления, ° С 1083 Температура кипения, ° С 2567 Плотность, г/см3 8,92 Твердость (по Моосу) 2,5 Содержание в земной коре, % (масс.) 0,007 Степени окисления +1, +2
Применение. Большая часть мирового производства меди используется в электротехнической промышленности для изготовления проводов. Листовая медь широко применяется для изготовления кровли, желобов, водостоков. Из-за коррозионной стойкости в морской воде, и в частности к действию морских организмов и растений, она является прекрасным материалом для кораблей. Медь часто используют в химической, пищевой промышленности и промышленности ферментов, для изготовления чайников, перегонных аппаратов, емкостей, теплообменников и другой утвари. Благодаря своему блеску и красивому цвету медь широко используется в декоративных изделиях и произведениях искусства, а также в гальванопластике и гравировании. Медь входит в состав многочисленных сплавов, которых известно более 1000. Самые распространенные из них - латуни (сплавы с цинком), бронзы (сплавы с оловом), медно-никелевые сплавы (мельхиор, нейзильбер, манганин, копель и т.д.); одним из наиболее распространенных применений меди является ее использование в сплавах для чеканки монет. Медь принадлежит к числу микроэлементов, необходимых для нормальной жизнедеятельности растений. Ее вносят в почву с микроудобрениями. Она способствует росту растений, повышению устойчивости против засухи, холода и некоторых заболеваний.
Соединения. Электронное строение атома меди 1s22s22p63s23p63d104s1. Атом меди легко отдает внешний электрон, образуя соединения Cu(I). Не все электроны на 3d-оболочке прочно удерживаются ядром, поэтому многие элементы способны оттягивать два электрона от атома меди, образуя устойчивый ион Cu2+. Соединения Cu(II) наиболее распространены и более стабильны, а относительно малый радиус иона и высокий заряд ядра позволяют меди проявлять акцепторные свойства с образованием комплексных ионов, например [[CuCl4]]2-, имеющего координационную связь. Ионы меди координируют молекулы воды в растворе, образуя стабильный комплексный ион [[Cu(H2O)4]]2+, который и вызывает голубую окраску разбавленных водных растворов соединений меди. Медь образует много соединений в степени окисления +1 и +2, но известны и некоторые нестабильные соединения меди в степени окисления +3. Соединения в степени окисления +1 обычно плохо растворяются в воде, являются восстановителями, легко окисляются на воздухе и, как правило, менее практически ценны и реже используются по сравнению с соединениями, в которых медь находится в степени окисления +2.
Соединения меди(I). Cu2O - темнокрасный кристаллический порошок, применяемый для изготовления рубинового стекла, окрашивания фарфора, гальванопластики металлических поверхностей. Хлорид меди(I) CuCl - серовато-белый кристаллический порошок, используемый как инсектицид, для очистки ацетилена и денитрации искусственного шелка. Кислота HCuCl2 (с комплексным анионом) используется в газовом анализе для поглощения CO.
Соединения меди(II). Оксид CuO - черный порошок, активный окислитель, используемый при сжигании органических соединений в элементном анализе. CuO используется также для производства солей, окраски в зеленый или голубой цвет стекла, фарфора, глиняных изделий, для очистки нефти от серы и в медицине. Гидроксид Cu(OH)2 - голубовато-зеленый порошок - в горячих растворах превращается в черный оксид меди(II). Гидроксид меди(II) растворяется в растворе тартрата щелочного металла с образованием тартрата меди CuC4H4O6 (реактив Фелинга), применяемого для обнаружения и определения восстанавливающих сахаров. Гидроксид меди(II) используется также как фунгицид в составе бордоской жидкости для уничтожения или предотвращения развития патогенных грибов и бактерий на семенах и сельскохозяйственных растениях на полях и на фабриках производства кормов. Гидроксид тетрамминмеди(II) (комплексное соединение) темноголубого цвета используется в качественном анализе на медь, как растворитель для хлопка, шелка, полотна и в производстве искусственного шелка. Хлорид меди CuCl2.2H2O в виде голубовато-зеленых кристаллов поглощает влагу из влажного воздуха, может увлажнять сухой воздух и используется в производстве краски, стойких чернил и в текстильной промышленности. Сульфат меди CuSO4 - наиболее распространенное соединение меди - получают растворением оксида (гидроксида или карбоната) меди в серной кислоте или металла в конц. серной кислоте. В промышленности его получают обжигом сульфида с дальнейшим растворением оксида в серной кислоте. Безводный сульфат бесцветен, но, хорошо поглощая воду, образует голубой пентагидрат CuSO4.5H2O (медный купорос). Сульфат меди(II) используется в изготовлении электролитических покрытий, гальванопластике, для изготовления пигментов, инсектицидов, для консервирования и дубления кожи, пропитки шпал, в крашении хлопка и шелка и как вяжущее средство. Он ядовит для низших организмов, особенно для морских водорослей, и поэтому используется на станциях водоподготовки. Ацетат меди(II) Cu(CH3COO)3*H2O (ярь-медянка) применяется для приготовления зеленой масляной краски. Смешанный ацетат-арсенит меди(II) Cu(CH3COO)2*Cu3(AsO3)2 (парижская зелень) применяется для уничтожения вредителей растений. Все соли меди ядовиты, поэтому медную посуду лудят, т.е. покрывают внутри слоем олова, чтобы предотвратить возможность образования солей.
См. также
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ;
МЕДНАЯ ПРОМЫШЛЕННОСТЬ.
ЛИТЕРАТУРА
Смирнягин А.П. и др. Промышленные цветные металлы и сплавы. М., 1974 Подчайнова В.Н., Симонова Л.Н. Медь. М., 1990
Металл cu что это

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
Смотрите так же:
СТРУКТУРА
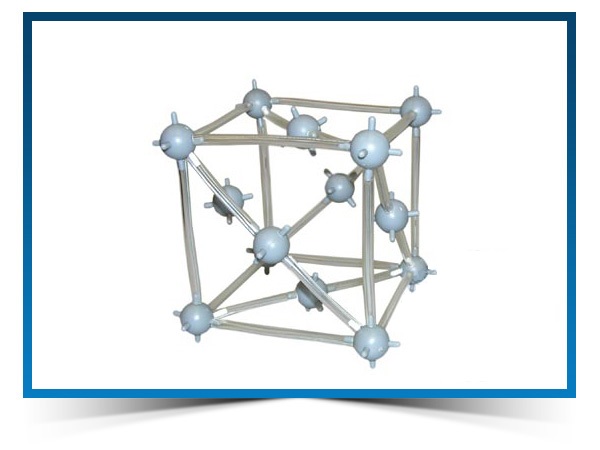
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура – кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
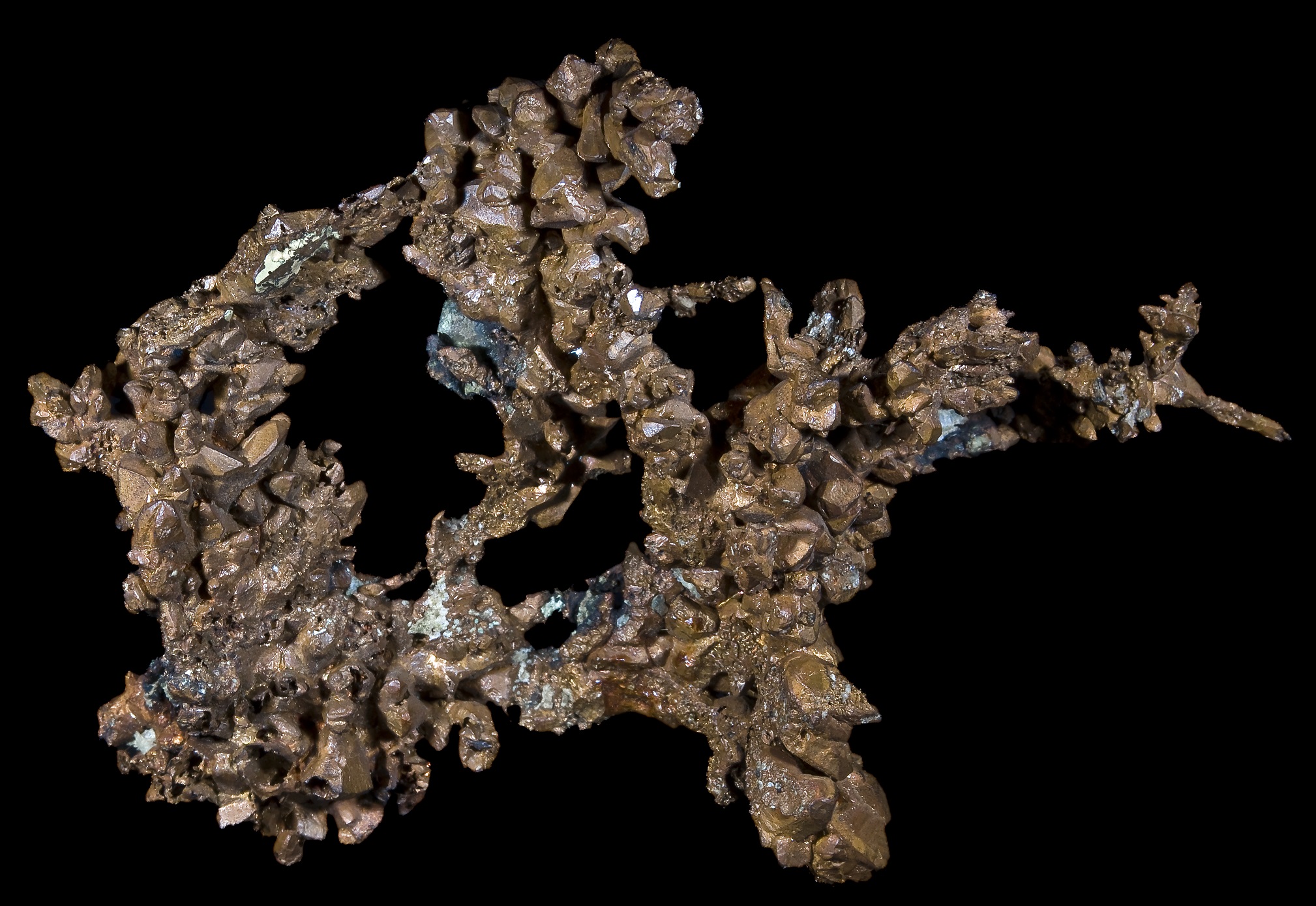
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10 −3 % (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10 −7 % и 10 −7 % (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди – Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Купрум

Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Содержание
История и происхождение названия
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе

Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63 Cu и 65 Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64 Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10 -8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения

В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu + и намного более стабильную Cu 2+ , которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)2 3- , полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu20 имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu 2+ (водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2] - устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl - (водн.) → [CuCl] - (водн.)
Хлорид меди(I) - белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение - комплексный дихлорокупрат(I)-ион [CuCl2] - . При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2] + . Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла [1] . Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2] [3] . Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2] , на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2] . Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн [4] . Основными производителями меди в России являются:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Медь (Cu, Cuprum)
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).

Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
- орехи, злаки, бобовые
- рыба, морепродукты
- крупы (особенно рис и гречка), макаронные изделия, ржаной хлеб , сырой яичный желток
- кисломолочные продукты , фрукты, ягоды и зелень .
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.
Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Материаловедение: медь
Чем примечательна медь, и за какие такие заслуги ее считают одним из важнейших металлов в истории человечества? Каковы ее плотность, температура плавления и прочие физико-химические свойства? Чем вызван скачок цен на медь в 2020-2021 гг., и почему это в общем-то только начало? Отвечаем на эти и другие вопросы в нашей четвертой статье из цикла «материаловедение».

Медь (Cu) – мягкий и пластичный металл золотисто-розового цвета, 29-й элемент периодической системы. Это один из главных промышленных металлов. По объемам производства среди цветметов медь вторая вслед за алюминием.
Ковкая и устойчивая к коррозии, медь используется в инженерных коммуникациях, машино- и судостроении, ювелирном деле. Однако до 60% от производимых объемов идет на электротехнику и энергетику. И это вполне логично: по тепло- и электропроводности медь впереди всех промышленных металлов и дышит в спину только серебру. Но сколько стоит медь, а сколько – серебро. Разница в цене стократная.

Медь – один из первых металлов на службе у человека. И это неспроста. Начнем с простого факта: чистая медь – химически неактивный металл, она не стремится к взаимодействию с другими элементами и веществами, как тот же алюминий. Вот почему в природе она часто встречается в самородках, даже чаще, чем железо. Кроме того, у нее умеренная температура плавления – 1 085°C, тогда как у железа 1539 °C
Одни из древнейших медных артефактов возрастом 8500 лет обнаружены на раскопках поселения Чатал-Хююк (Турция). При экскавации кургана археологи нет-нет да находили окалины и шлак – казалось бы, явные свидетельства переплавки медной руды. Впрочем, некоторые ученые воздерживаются от скоропалительных выводов. По их версии, куски руды могли образоваться случайно в попытках намешать краску для ритуальных погребений.
Тем не менее к IV тысячелетию до н. э. медь приручили если и не все цивилизации, то многие. Сперва медные самородки обрабатывали холодной ковкой: заготовки для наконечников копий и будущие лезвия топоров обстукивали камнями до нужной формы. Горючую же ковку миру явила невероятно продвинутая по тем временам кипро-минойская цивилизация. Как показывают раскопки, в III тысячелетии до н. э. на Кипре уже вовсю плавили медь из малахита, бирюзы и других окисных руд. Отсюда, между прочим, и латинское название меди Cuprum, производное от Aes Cyprium («металл Кипра»).
Сегодня медь добывают в основном из сернистых соединений CuS, Cu2S сульфидных руд: медного колчедана, медного блеска и др. В России крупнейшее медные месторождения сосредоточены в Красноярском крае и Забайкалье, а ведущим производителем считается «Норникель».

Чистая медь – мягкий и пластичный металл из семейства переходных. Она легко тянется в проволоку, хорошо обрабатывается давлением в горячем и холодном состоянии, сваривается почти всеми видами термомеханической сварки и сносно режется. К технологическим недостаткам относят низкие литейные качества. Дело в том, что расплав меди густотекучий, отливки дают большую усадку, а это требует сложных расчетов и вообще делает расход материала непомерным.
Плотность: 8933 кг/м3 (8,93 г/см3). Изделия из меди и медных сплавов увесистые. Подсчитано, что если в легковушке заменить всю медную проволоку алюминиево-циркониевой, то автомобиль «сбросит» около 12 кг.
Температура плавления: 1083°C. Это среднеплавкий металл. Для сравнения: у цинка температура плавления – 419,5°C, у алюминия – 658°C, железа – 1 539°C.
Коэффициент теплопроводности: 394 Вт/(м·К). Высокая теплопроводность делает медь эффективной в радиаторах охлаждения, отопления и кондиционирования, системах водоснабжения.
Электропроводность: 55,5—58 МСм/м. Этот показатель падает с увеличением доли примесей. По этой причине провода по нормативам изготавливают из меди с примесями не более 0,1% от состава.
Высокая стойкость к коррозии. Причем не только в пресной и морской воде, но и в различных химических средах, включая органические кислоты, едкие щелочи и галогены.
Цвет: от золотисто-розового до желто-красного. Желтоватые нотки – заслуга оксидной пленки, образующейся при взаимодействии с воздухом. Впоследствии эта пленка служит естественной защитой от коррозии. Отметим, что медь окисляется даже при комнатной температуре, чем разительно отличается от золота и серебра.

Поскольку медь отлично проводит электричество, ее активно используют в электронике, смартфонах, телевизорах, компьютерах и т. д.

В домах с медными трубами аварийные ситуации – редкость. Для сравнения: по данным ВЦИОМ за 2006 год, в первые три года использования пластиковых труб аварии случаются в 8 квартирах из 100. Кроме того, медь в отличие от пластика инертна к хлору и благодаря ионизации имеет антибактерицидные свойства. Совсем как серебро. Это, к слову, объясняет, почему поручни и дверные ручки из медесодержащих сплавов называют самоочищающимися.

От внутриквартирной разводки до перекачки мазута – медные трубы пригодятся в самом широком спектре инженерных работ. При этом срок их службы может достигать 50-100 лет.

Всего лишь одна ветряная турбина мощностью 3 МВт нуждается в более 4 т меди. Отметим, что в том числе переход на зеленую энергетику со всеми ее солнечными панелями и ветрогенераторами спровоцировал стремительный рост цен на медь, наметившийся еще с 2017 года.

Медь сплавляют с золотом, чтобы придать тому большую прочность на изгиб и стойкость к истиранию. Те же розовое и красное золото – это все сплавы меди с чистым желтым золотом в пропорции 1:3 (для пробы 750).

Первичная медь маркируется по ГОСТ 859-2014 буквой М и числом, обозначающей чистоту металла. Самая беспримесная марка однокомпонентной меди – М006, переплавляемая из катодов в вакууме, восстановительной или инертной атмосфере. Степень ее чистоты не менее 99,99%. Для сравнения: получаемая переплавкой лома М3 содержит 99,5% меди.
Иногда после числа в маркировке стоит буква: М1ф, М2р… Эта буква на конце обозначает легирующий элемент либо указывает степень раскисления. К примеру, в марке М1ф помимо собственно меди (99,9%) содержится фосфор (0,04%) и другие примеси. В марке М2р 99,7% меди, 0,01% раскисляющего кислорода и до 0,06% фосфора, а остальное – примеси.
Отметим, что примеси в составе значительно снижают характеристики меди, в первую очередь тепло- и электропроводность. Особенно критично в этом плане превышение доли мышьяка (As) и сурьмы (Sb). По этой причине как проводник используют только электролитическую медь чистых марок: М1 (99,9%), М0 (99,93%) и практически беспримесную М006 (99,99%).
Для большей прочности и улучшения технологических свойств (в первую очередь – литейных) в меди растворяют различные легирующие компоненты: Zn, Sn, Be, Ae, Mn, Ni, Si. В целом по химическому составу все сплавы на основе меди можно разделить на три большие группы: латуни, бронзы и медно-никелевые сплавы.

Медный сплав с добавлением цинка (от 5 до 45%) и иногда другими присадками. Цвет всегда с блеском и в зависимости от содержания цинка варьируется от красно-желтого или желтого (Zn ≤ 20%) до чуть зеленоватого (Zn 36-45%). Если сравнивать с медью, латунь удобнее в литье, но склонна к растрескиванию под напряжением и хуже реагирует на морскую воду. Применение: сантехника, коммутирующие устройства в электротехнике, различная фурнитура, украшения и др.

Сплав меди с оловом (~12%) и другими легирующими компонентами: алюминием, марганцем, фосфором, кремнием и др. Цвет красновато-коричневый. Будучи более хрупкими, чем медь и латунь, многие бронзы тем не менее прекрасно подходит для художественного литья, давая всего 1% усадки. Также бронза отлично противостоит морской воде и агрессивной химии, из-за чего применяется в топливной и паровой арматуре. Кому-то она известна и как подшипниковый материал – дают о себе знать отменные антифрикционные свойства.

В частности, конструкционные сплавы мельхиор (Ni 5-30%) и нейзильбер (Ni 5-35%, Zn 13-45%). Меньше на слуху электротехнические сплавы константан (Ni 39-41%, Mn 1-2%) и копель (Ni 43-44%, Fe 2-3%).
Применяются медно-никелевые сплавы в изготовлении реостатов и резисторов; в судостроении; в медицинской промышленности; в чеканке монет. В частности, до 2009 года из сплавов меди с никелем чеканились монеты Банка России в 1 и 2 рубля. В 2009 году материал поменяли: с тех пор это сталь с гальванопокрытием. Что ж, посткризисное время требует посткризисных решений.
На середину июля 2021 года цена за 1 кг меди на пунктах приема составляет от ~300 руб. за медно-никелевую трубу МНЖ5-1 до ~550 руб. за блестящий медный кабель.
Что касается цен на биржах, то после шокировавшего многих зимнего пика наметился курс на постепенную стабилизацию. На момент написания статьи на Лондонской бирже медь торгуется по стоимости $9 419,2817 за тонну.

Стабилизация – стабилизацией, но отката цен к уровню 2019 года пока не предвидится. Куда вероятнее нас ждет новый виток роста. Тому есть несколько причин. Самые очевидные – разгон мировой инфляции и дефицит металлопроката, вызванный прекращением сбора лома в первую волну коронавирусных карантинов, лавиной отложенного спроса впоследствии. В долгосрочной перспективе во все это вмешается еще и агрессивная политика озеленения энергетики. На декарбонизацию экономик согласно целям устойчивого развития, навязанных ООН и расписанных на первом этапе до 2030 года, понадобится много редкоземельных и цветных металлов. И медь в этом списке значится чуть ли не первой.

В чистом виде медь в производстве замочно-скобяных изделий не используется. Зато в ход идут медные и медесодержащие сплавы, прежде всего латунь и ЦАМ (цинковый сплав с Cu ~1%).
Если упрощенно, то чем больше меди в сплаве, тем качественнее фурнитура: точнее в размерах, дольше держит покрытие, лучше противостоит коррозии. К примеру, дверные петли Palladium отлиты из премиальной латуни Class A с Cu 54-57,4%. Отсюда эталонная геометрия, поразительная плавность хода и срок службы длиной в вечность. Также отметим латунные навесные замки Palladium и смесители Manzzaro. В последних, кстати, используется латунь ЛЦ40С с Cu 59-60%.
И в заключение о фурнитуре из медесодержащего сплава ЦАМ, прежде всего – о дверных ручках. В самом материале меди ~1%. Однако меднение является важнейшим этапом в гальванизации, от него зависит долговечность наносимого покрытия. Если производитель схитрил и недоложил адгезионный медный слой в требуемую толщину, ручка потрется или потемнеет за 1-2 года. При честном же соблюдении технологии ручка из ЦАМ должна сохранять близкий к товарному вид 5-10 лет. Даже если установлена на двери в ванной, на кухне и в других помещениях с капризной средой.
Читайте также:

