Металл не относящийся к щелочным металлам
Обновлено: 16.05.2024
А) Ca Б) М g В) Sr Г) Fe .
13.Тип связи в простом веществе натрия:
Б) ковалентная неполярная
В) металлическая
Г) ковалентная полярная
14. Наиболее ярко выраженные металлические свойства
проявляет:
А) Mg Б) K В) Al Г) Ca
15. Какую электронную конфигурацию имеет атом наиболее
активного металла?
А) 1 s 2 2 s 2 2 p 11 Б) 1 s 2 2 s 2 2 p 6 3 s 1
В) 1 s 2 2 s 2 Г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
16. Алюмотермия - это
А) восстановление алюминия водородом из его оксида
Б) восстановление металлов из оксидов алюминием
В) шлифовка алюминиевых изделий
Г) получение алюминиевых сплавов
ТЕСТ №2 по теме «Металлы»
1. Какому металлу соответствует электронная формула
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 ?
А) Mo Б) Zn
В) Ba Г) Fe
2. При взаимодействии железа с разбавленной H 2 SO 4 образуется
3.Какой металл не вытеснит водород из разбавленной H 2 SO 4 ?
А) Fe Б) Cr В) Cu Г) Zn
4.В порядке уменьшения восстановительных свойств металлы расположены в ряду:
А ) Al, Zn, Fe Б ) Al, Na, K
В ) Fe, Zn, Mg Г ) Fe, Zn, Al
5.Оксиды CrO и CrO 3 -
А) основные
Б) основные и кислотные
В) кислотные
Г) кислотные и основные
6.К какому типу элементов относится железо?
А) р - элементам
Б) s -элементам
В) d -элементам
Г) f -элементам
7. На d - подуровне максимально может находиться:
А) 2е Б) 6е В)10е Г) 18е
8. Металлический хром может взаимодействовать с:
А) H 2 О Б) HCl (разб.)
В) HNO 3 (конц.) Г) NaOH (конц.)
9. Для металлов не характерно следующее физическое свойство:
А) теплопроводность
Б) металлический блеск
В) электропроводность
Г) хрупкость
10.Установите соответствии между металлом и способом его получения
А) Na 1. алюмотермия
Б) Fe 2. восстановление углеродом
В) Cr 3 . электролиз расплавов солей
11. С точки зрения типа кристаллической решетки «лишнее» простое вещество среди данных
А) алмаз В) железо
Б) хром Г) кобальт
12.Электронная формула иона Fe +2
А) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 6
Б) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 0 3 d 10
В) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 0 3 d 6
Г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10
13. Свойства оксидов металлов побочных подгрупп с уменьшением степени окисления металла изменяются в следующем порядке
А) основные, амфотерные, кислотные
Б) кислотные, амфотерные, основные
В) основные, кислотные, амфотерные
Г) кислотные, основные, амфотерные
14. В схеме превращения
веществами X и Y соответственно являются
В) Fe и HCl
15. В схеме превращения
веществами X 1 , X 2 , X 3 соответственно являются
Итоговая контрольная работа по химии 9 класс

Работа состоит из 3 частей (А, В и С) и включает 13 заданий (А-8, В-2, С-3). На её выполнение отводится 40 минут. Задания рекомендуется выполнять по порядку.
Просмотр содержимого документа
«Итоговая контрольная работа по химии 9 класс»
Итоговая (стандартизированная) контрольная работа по химии
за курс «Химия. 9 класс»
Вариант № 1
А1. Распределение электронов по энергетическим уровням 2е, 8е, 2е соответствует частице 1) Мg 0 2) О 2- 3) Мg 2+ 4) S 2-
А2. В ряду элементов Na – Mg – Al - Si
уменьшаются радиусы атомов
уменьшается число протонов в ядрах атомов
увеличивается число электронных слоёв в атомах
уменьшается высшая степень окисления атомов в соединениях
А3. Фактор, не влияющий на скорость химических реакций,
природа реагирующих веществ
концентрация реагирующих веществ
4)тип химической реакции
А4. Наиболее электропроводным металлом из перечисленных является
А5. Металл, не относящийся к щёлочноземельным,
1)магний 3) стронций
2)кальций 4) барий
А6. Наиболее активно реагирует с водой
скандий 3) калий
магний 4) кальций
А7. Агрегатное состояние иода при нормальных условиях
жидкое 2) твёрдое 3) газообразное
А8.Металл, с которым не взаимодействует концентрированная серная кислота,
1)железо 2)магний 3)цинк 4)натрий
Часть В. Тестовые задания на соответствие.
В1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
Реагирующие Продукты их
вещества взаимодействия
Б) CuО + HCl 2) CuCl
В2. Установите соответствие между типами и уравнениями химических реакций.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
А) соединения, ОВР, необратимая
Б) разложения, ОВР, эндотермическая
В) соединения, ОВР, гомогенная
УРАВНЕНИЯ РЕАКЦИЙ
FeO + C → Fe + CO -Q
Часть С. Задания с развёрнутым ответом.
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения Zn → ZnCl2 → Zn(OH)2 → ZnO
Для перехода 2 запишите ионное уравнение.
С2. . К 34,8г сульфата калия прилили раствор, содержащий 83,2 г хлорида бария. Определите массу образовавшегося осадка. (5б).
С3.Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu +HNO3→Cu(NO3)2+NO +H2O.
Итоговая (стандартизированная) контрольная работа по химии за курс «Химия. 9 класс».
Вариант № 2
А1. Распределение электронов по энергетическим уровням 2е, 8е, 6е соответствует атому
углерода 3) фосфора
А2. В ряду элементов С –N - О - F
уменьшается высшая степень окисления элементов в соединениях
увеличиваются радиусы атомов
уменьшается восстановительная способность простых веществ
увеличивается высшая степень окисления элементов в соединениях
способ получения реагентов
А4. Металл, не относящийся к щелочным металлам,
кальций 4) натрий
А5. Свойство ртути, которое ограничивает её применение в бытовых термометрах
А6. Водород нельзя получить путём взаимодействия металлов с кислотой
азотной 3) соляной
серной 4) фосфорной
А7. Свойство, характерное для озона,
хорошо растворяется в воде
не имеет запаха
А8. Вода взаимодействует с каждым из веществ, формулы которых
Часть В. Тестовые задания на соответствие.
В2. Установите соответствие между исходными веществами и продуктами реакций.
Исходные вещества Продукты реакции
В ) NaOH и SO2 3) NaOH и H2
В2. Установите соответствие между типами и уравнениями реакций.
А) замещения, ОВР, эндотермическая
Б) разложения, ОВР, экзотермическая
В) соединения, ОВР, необратимая
УРАВНЕНИЯ РЕАКЦИЙ
С1. Запишите уравнения реакций, с помощью которых можно осуществить превращения MgO→ MgCI2→Mg(OH)2→ Mg(NO3)2
Для перехода 3 запишите ионное уравнение.
С2. К раствору, содержащему 63,9г нитрата алюминия, прилили раствор, содержащий 39,2г фосфорной кислоты. Определите массу фосфата алюминия.
С3. Расставьте коэффициенты в уравнении реакции с помощью электронного баланса. Cu + HNO3→ Cu(NO3)2 + NO2 + H2O
Рекомендации по оцениванию работы
Максимальное количество баллов – 21 балл
Задания базового уровня (А1-А8), только один правильный ответ. (1 балл)
Задания повышенного уровня (В1-В2), найти соответствие. (2 балла)
Задание С1, С2, С3 - требуют полного ответа. (3 балла)
Соответствие баллов, полученных за выполнение заданий, отметке/оценке по пятибалльной шкале оценивания
1.Выберите, какой (какие) из перечисленных элементов относится (относятся) к щелочным металлам?
a)S
b)Все металлы
c)Цезий
d)Са
3.Отметьте верное утверждение, относящееся к щелочным металлам:
a)натрий и калий — легкоплавкие серебристо-белые металлы, мягкие и пластичные
b)натрий нельзя получить методом электролиза
c)в простых веществах щелочных металлов имеется ковалентная неполярная связь
d)это газы
4.Отметьте, при взаимодействии каких пар веществ образуется гидроксид лития:
a)оксид лития и вода
b)Li и вода
c)нет правильного ответа
d)оксид этого металла и азотная кислота
5.Отметьте подходящие вещества.
Гидроксид лития взаимодействует как с раствором ______, так и с оксидом
______ с образованием соли и воды.
6.В предложенном перечне отыщите правильное суждение о щелочных металлах в ряду натрий — калий — рубидий:
a)число электронов на внешнем энергетическом уровне уменьшается
b)имеют одинаковое количество электронов в атоме
c)характерна положительная степень окисления, равная единице
d)все перечисленные
7.Выберите верное утверждение.
Чтобы получить:
a)хлорид натрия, можно к раствору хлорида калия добавить натрий
b)бромид калия, нужно к раствору гидроксида калия добавить бромоводородную кислоту
c)карбонат натрия, можно натрий опустить в раствор угольной кислоты
d)оксид натрия, можно к гидроксиду калия добавить натрий
8.Укажи, какой (какие) из перечисленных элементов относится (относятся) к щелочноземельным металлам?
a)Cu
b)B
c)Все металлы, расположенные во второй A группе Периодической системы Д. И. Менделеева
d) Ra
9.Укажи ряд веществ, в котором записаны названия веществ, относящихся к щелочам:
a)гидроксид лития, гидроксид бария
b)гидроксид бария, гидроксид цинка
c)оксид бериллия, оксид лития
d)азотная кислота, фосфорная кислота
10.Укажи верное утверждение, относящееся к щелочноземельным металлам:
a)щелочноземельные металлы не реагируют с водой
b)на внешнем энергетическом уровне все атомы щелочноземельных металлов c)имеют два электрона
d)на внешнем уровне атомы щелочноземельных металлов имеют три электрона
это газы
11.Укажи, при взаимодействии каких пар веществ образуется гидроксид бария:
a)оксид Ва и вода
b)оксид этого металла и серная кислота
c)соль этого металла и оксид этого металла
d)Ва и вода
12.Укажи все утверждения, верные для сульфата бария:
a)не токсичен для организма человека
b)не растворяется в угольной кислоте
c)жидкость
d)образуется при взаимодействии гидроксида бария и сульфата натрия
13.В предложенном перечне выбери правильное суждение о щелочноземельных металлах в ряду кальций — стронций — барий:
a)характерны окислительные свойства
b)число энергетических уровней равно двум
c)восстановительные свойства усиливаются
d)нет правильного ответа
14.Укажи неверное утверждение.
Чтобы получить:
a)нитрат бария, можно к раствору нитрата меди(II) добавить барий
b)оксид кальция, нужно провести электролиз расплава хлорида кальция
c)гидроксид бария, можно провести взаимодействие оксида бария с водой
d)сульфат бария, нужно барий опустить в раствор серной кислоты
Металлы IA группы
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
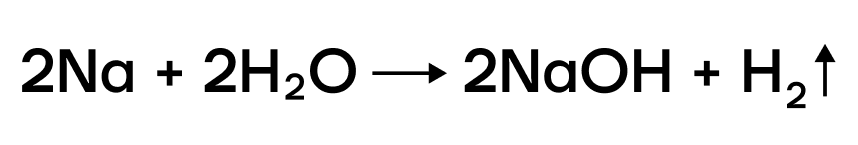
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
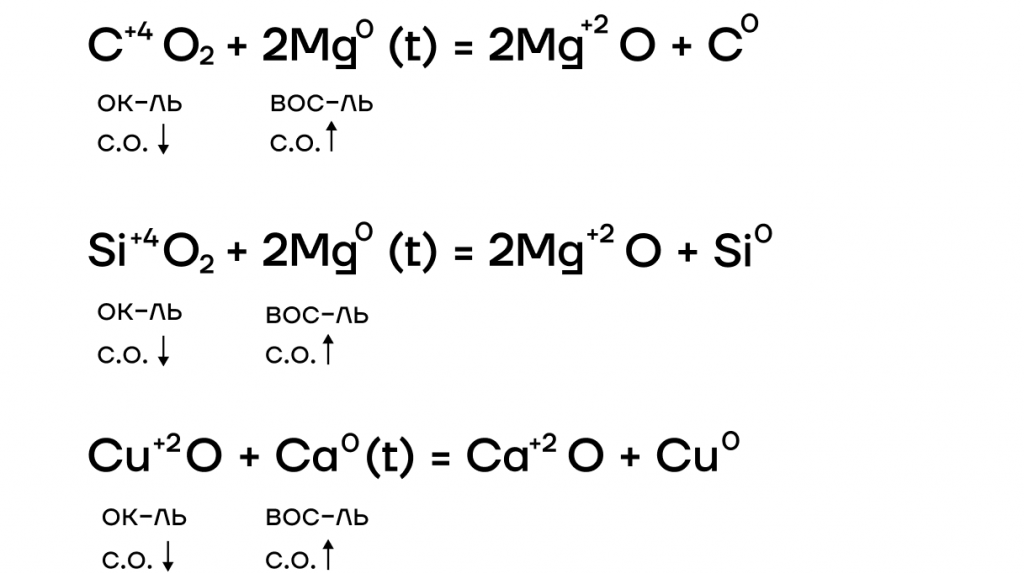
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
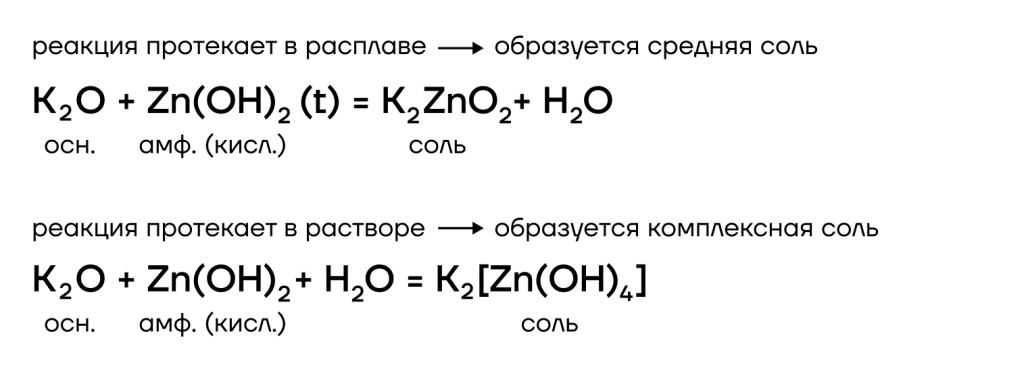
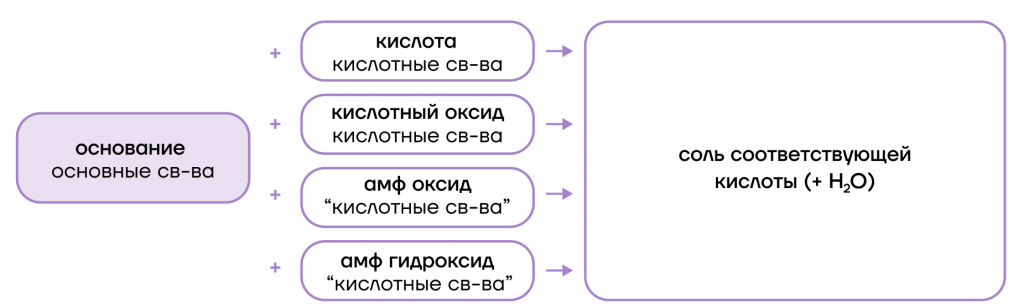
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
- вступают в реакции ионного обмена с кислотами и солями:
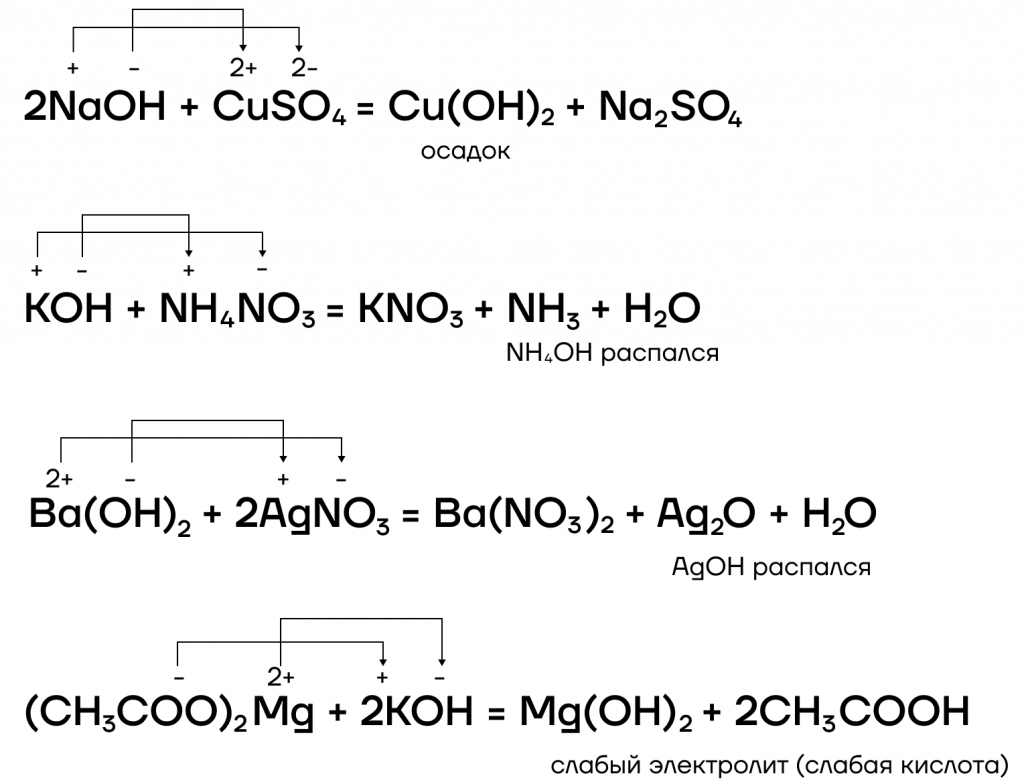
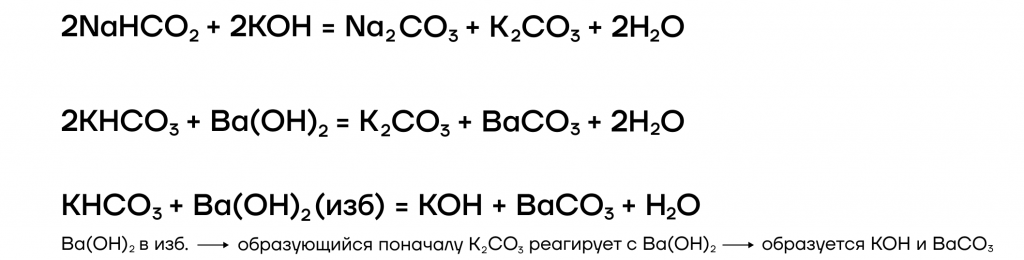
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
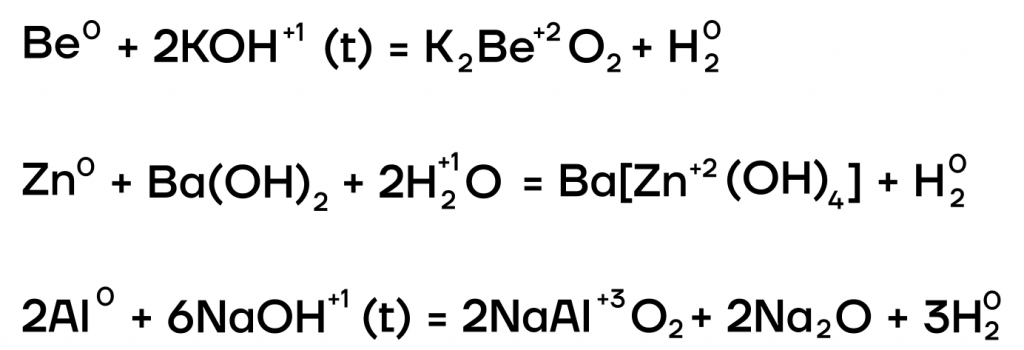
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.

Читайте также:
