Металл оксид гидроксид оксид
Обновлено: 01.06.2024
Сложными веществами, или химическими соединениями называются вещества, молекулы которых состоят из атомов двух или более различных химических элементов. Молекула сложного вещества состоит из частиц двух типов: положительно-заряженные называются катионы, а отрицательно-заряженные – анионы. Так, например, молекула воды Н2О состоит из разных атомов: двух атомов водорода и одного атома кислорода, и потому является веществом сложным. Эти атомы, группируясь, образуют заряженные частицы – ионы: положительно-заряженный катион водорода (Н+ ) и отрицательно-заряженный анион гидроксида – гидроксид-ион (ОН– ).
В целом молекула любого сложного вещества электронейтральна, суммарный положительный заряд катионов полностью компенсируется суммарным отрицательным зарядом анионов, образующих молекулу. В случае молекулы воды на один положительный катион водорода с зарядом +1 приходится один отрицательный гидроксид-ион с зарядом –1, таким образом, суммарный заряд образуемой молекулы равен нулю.
При составлении молекул сложных неорганических веществ сначала записывают катион, а потом анион. Заряды катионов и анионов можно определить по таблице растворимости веществ: (в крайнем левом столбце перечислены основные анионы с указанием их заряда, а в верхней строке аналогичным образом представлены катионы).
Выделяют четыре основные класса сложных неорганических веществ.
1) Оксиды – сложные вещества, состоящие из двух элементов, один из которых – кислород. Анион кислорода в таких соединениях называется оксид-ион и имеет заряд –2 (О2– ). Например, ион Ca2+ с оксид-ионом О2– образуют молекулу СаО, а ион Fe3+ с оксид-ионом О2– образуют молекулу Fe2О3.
2) Гидроксиды (основания) – сложные вещества, где анионом является гидроксидная группа (ОН– ), имеющая заряд (–1). Например, ион Вa 2+ образует гидроксид, формула которого Ва(ОН)2, а ион аммония NH4 + , гидроксид с формулой NH4ОН.
3) Кислоты – сложные вещества, где катионом является положительно- заряженный ион водорода (Н+ ), а анионом – кислотный остаток. Количество атомов водорода в молекуле кислоты будет равно модулю заряда кислотного остатка. Так анион SO4 2– , имеющий заряд (–2), образует кислоту, молекула которой записывается как H2SO4. Выделяют одноосновные кислоты: HF – фтороводородная (плавиковая), HCl – хлороводородная (соляная), HNO3 – азотная, HNO2 – азотистая; и многоосновные кислоты: H2SO4 – серная, H2SO3 – сернистая, H2S – сероводородная, H2СO3 – угольная, H3PO4 – ортофосфорная.
4) Соли – это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков. Например, катион Ni2+ и анион NO3 – образуют соль, формула молекулы которой будет записываться как Ni(NO3)2. Данное вещество в водном растворе будет диссоциировать по схеме: Ni(NO3)2 ↔ Ni2+ + 2NO3 – . Тип кислотного остатка определяет название соли:
F – – фторид, Cl– – хлорид, NO3 – – нитрат, NO2 – – нитрит; SO4 2– – сульфат, SO3 2– – сульфит, S 2– – сульфид, СO3 2– – карбонат, PO4 3– – ортофосфат.
Для названия индивидуальных химических веществ, их групп и классов пользуются химической номенклатурой.
Названия веществ строятся по их формуле справа налево: сначала название аниона (в именительном падеже), затем название катиона (в родительном падеже). Если элемент катиона может иметь несколько валентностей, то в скобках римскими цифрами указывается валентность элемента катиона, которую он проявляет в данном соединении. Единственную валентность в соединениях проявляют: - щелочные металлы (Li, Na, K, Rb, Cs) – I; - щелочно-земельные металлы (Be, Mg, Ca, Sr, Ba) – II; - Zn – II, Al – III. Например: KCl – хлорид калия, BaSO4 – сульфат бария, AgNO3 – нитрат серебра (I), NaOH – гидроксид натрия, (NH4)2CO3 – карбонат аммония, Fe3(PO4)2 – ортофосфат железа (II), Cr2O3 – оксид хрома (III).
Оксиды и гидроксиды металлов

Видеоурок содержит материал об основных оксидах и гидроксидах металлов, их физических и химических свойствах.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Оксиды и гидроксиды металлов"
Для всех металлов известны их оксиды и гидроксиды, а у d-элементов различные степени окисления, поэтому они образуют множество оксидов и гидроксидов. Свойства этих оксидов и гидроксидов зависят от положения металла в периодической системе, от его активности и степени окисления металла. Таким образом, все металлы образуют солеобразующие оксиды.
Известно, что чем ярче выражены металлические свойства, тем сильнее основные свойства оксидов и гидроксидов.
Для s- и p-элементов слева направо по периоду уменьшаются металлические свойства, а значит и основные свойства оксидов и гидроксидов металлов. В IA группе сверху вниз увеличиваются радиусы атомов, при отдаче электронов с внешнего уровня образуются катионы. Естественно, что степень окисления у этих элементов не изменяется, а основный характер оксидов усиливается.

Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов 3 периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаковое, но степень окисления изменяется, то есть она возрастает, а радиус иона уменьшается, поэтому характер оксидов изменяется от основного через амфотерные к кислотному.

Например, оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства, а уже оксид алюминия проявляют амфотерные свойства.
Так, оксид натрия – это основный оксид, поэтому он будет реагировать с кислотными и амфотерными оксидами, с кислотами. Например, в реакции оксида натрия с оксидом углерода (IV) образуется соль – карбонат натрия, в реакции оксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.

По группе сверху вниз металлические свойства s- и p-элементов усиливаются, поэтому усиливаются и основные свойства их оксидов.

Например, в группе II A оксид бериллия проявляет амфотерные свойства, поэтому он легко растворяется в растворах кислот и щелочей. Например, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции оксида бериллия с раствором гидроксида натрия образуется комплексная соль – тетрагидроксобериллат натрия.

Соединения бария и радия имеют уже ярко выраженные основные свойства, поэтому они будут реагировать с кислотными и амфотерными оксидами, а также с кислотами. Так, в реакции оксида бария с азотной кислотой образуется соль – нитрат бария и вода.

Характер гидроксида зависит также от степени окисления и радиуса иона. Чем больше степень окисления, тем меньше радиус иона.

Поэтому в ряду от гидроксида натрия до гидроксида алюминия идёт ослабление основных свойств и усиление кислотных, так как возрастает степень окисления и уменьшается радиус иона.

Например, в I A группе сверху вниз увеличивается радиус иона, степень окисления не изменяется, поэтому усиливаются основные свойства. В ряду от гидроксида лития до гидроксида цезия основные свойства будут усиливаться.

Переходные элементы, расположенные в малых периодах – это Be, Al образуют оксиды и гидроксиды, проявляющие амфотерные свойства.
Получим гидроксид алюминия и исследуем его свойства. Сначала в растворимую соль алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид алюминия.

Затем разделим этот осадок на две части: к первой части добавим соляную кислоту, осадок растворяется из-за образования растворимой соли – хлорида алюминия. Ко второй части осадка добавим гидроксид калия – осадок также растворяется, потому что образуется растворимая соль – тетрагидроксоалюминат калия.
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твёрдыми основаниями при сплавлении.
Например, при сплавлении гидроксида хрома (III) с гидроксидом калия образуется соль – метахромит калия и вода, при сплавлении гидроксида хрома (III) с оксидом калия образуется метахромит калия и вода, при сплавлении гидроксида хрома (III) с карбонатом калия также образуется соль метахромит калия, вода и углекислый газ.

Аналогично оксид и гидроксид алюминия ведёт себя: при сплавлении оксида алюминия и гидроксида калия образуется соль – металюминат калия и вода, при сплавлении гидроксида алюминия и гидроксида калия образуется соль – метаалюминат калия и вода.
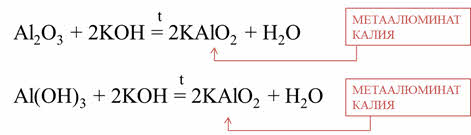
Оксид и гидроксид бериллия также проявляет амфотерные свойства, потому что они реагирует с кислотами, щелочами. Так, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции гидроксида бериллия и серной кислоты образуется соль – сульфат бериллия и вода.

Большое влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления металла, поэтому с увеличением степени окисления металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6.
В оксиде CrO и гидроксиде Cr(OH)2 степень окисления хрома +2, поэтому этот оксид и гидроксид будут проявлять основные свойства. В оксиде Cr2O3 и гидроксиде Cr(OH)3 окисления хрома +3, поэтому оксид и гидроксид в этой степени окисления будут проявлять амфотерные свойства, в оксиде CrO3 и гидроксиде H2CrO4 степень окисления хрома +6 – это высшая степень окисления для атома хрома, поэтому этот оксид и гидроксид проявляют кислотные свойства.


Таким образом, с увеличением степени окисления металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основных через амфотерные к кислотным.

презентация к уроку по теме "Оксиды и гидроксиды металлов". Урок-обобщение. Сравниваются свойства металлов 1,2,3 групп главных подгрупп и их кислородных соединений.
Просмотр содержимого документа
«Оксиды и гидроксиды металлов»
или = водород + основание (если основание не растворимо в воде)
Реакция протекает только в том случае, если
металл находится в ряду активности до водорода.
Основание – сложное вещество, в котором каждый атом металла связан с одной или несколькими гидроксогруппами.
в степенях окисления +1 и +2 проявляют основные свойства ,
Заполнить таблицу: Сравнительная характеристика оксидов и гидроксидов
металлов главных подгрупп I - III групп
Вопросы для сравнения
I группа
II группа
Степень окисления Ме в оксиде.
2. Физические свойства.
III группа
3. Химические свойства (сравнить).
4. Способы получения оксидов.
Взаимодействие:
б) с кислотами
в) с кислотными оксидами
г) с амфотерными оксидами
д) со щелочами
5. Формула гидроксида.
Степень окисления Ме в гидроксиде.
6. Физические свойства
7. Химические свойства (сравнить).
8. Способы получения гидроксидов.
а) действие на индикаторы
г) с растворами солей
д) с неметаллами
е) со щелочами
ж) с амфотерными оксидами и гидроксидами
з) отношение к нагреванию

Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
Na 2 O , Mg +2 O , Al 2 O 3
основные амфотерный
Na +1 O Н , Mg +2 (O Н ) 2 , Al +3 (O Н ) 3
щелочь Слабое Амфотерный
основание гидроксид
В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз .

Соединения металлов I А группы
Оксиды щелочных металлов
Общая формула Ме 2 О
Физические свойства: Твердые, кристаллические вещества, хорошо растворимые в воде.
Li 2 O , Na 2 O – бесцветные, К 2 О, Rb 2 O – желтые, Cs 2 О – оранжевый.
Способы получения:
Окислением металла получается только оксид лития
4 Li + O 2 → 2 Li 2 O
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li 2 O ) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na 2 O 2 + 2Na → 2Na 2 O
KO 2 + 3K → 2K 2 O
Химические свойства
Типичные основные оксиды:
Взаимодействуют с водой, образуя щелочи: Na 2 О + H 2 O →
2. Взаимодействуют с кислотами, образуя соль и воду: Na 2 О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na 2 О + SO 3 →
4. Взаимодействуют с амфотерными оксидами, образуя соли: Na 2 О + ZnO → Na 2 ZnO 2

Гидроксиды щелочных металлов
Общая формула – МеОН
Физические свойства: Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Сильные основания - Щелочи. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
1. Электролиз растворов хлоридов:
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2
2. Обменные реакции между солью и основанием:
K 2 CO 3 + Ca(OH) 2 → CaCO 3 + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2 Li + 2 H 2 O → 2 LiOH + H 2
Li 2 O + H 2 O → 2 LiOH
Na 2 O 2 + 2 H 2 O → 2 NaOH + H 2 O 2
![Химические свойства 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H 2 O 3. Взаимодействуют с кислотными оксидами. 2NaOH + SO 3 → Na 2 SO 4 + H 2 O 4. Взаимодействуют с растворами солей, если образуется газ или осадок. 2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными оксидами и гидроксидами 2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ] 2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ] 7. При нагревании не разлагаются, кроме LiOH .](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img11.jpg)
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl + H 2 O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными оксидами и гидроксидами
2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ]
2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ]
7. При нагревании не разлагаются, кроме LiOH .
![Соединения металлов главной подгруппы II группы Оксиды металлов II А группы Общая формула МеО Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. Способы получения: Окисление металлов (кроме Ba , который образует пероксид) 2Са + О 2 → 2СаО 2) Термическое разложение нитратов или карбонатов CaCO 3 → CaO + CO 2 2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2 Химические свойства ВеО – амфотерный оксид Оксиды Mg , Ca , Sr , Ba – основные оксиды Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание): СаО + H 2 O → 2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img12.jpg)
Соединения металлов главной подгруппы II группы
Оксиды металлов II А группы
Общая формула МеО
Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде.
Окисление металлов (кроме Ba , который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO 3 → CaO + CO 2
2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2
ВеО – амфотерный оксид
Оксиды Mg , Ca , Sr , Ba – основные оксиды
Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание):
2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 →
4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]

Гидроксиды металлов II А группы
Общая формула – Ме(ОН) 2
Физические свойства: Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН) 2 – в воде нерастворим.
Основные свойства усиливаются в ряду:
Ве(ОН) 2 → Mg (ОН) 2 → Ca (ОН) 2 → Sr (ОН) 2 → В a (ОН) 2
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2 H 2 O → Ba ( OH ) 2 + H 2
CaO (негашеная известь) + H 2 O → Ca ( OH ) 2 (гашеная известь)
![Химические свойства Ве(ОН) 2 – амфотерный гидроксид Mg (ОН) 2 – слабое основание Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют с кислотами, образуя соль и воду: Ве(ОН) 2 + Н 2 SO 4 → 3. Взаимодействуют с кислотными оксидами: Са(ОН) 2 + SO 3 → 4. Взаимодействуют с растворами солей, если образуется газ или осадок: Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ] При нагревании разлагаются: Са(ОН) 2 →](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img14.jpg)
Ве(ОН) 2 – амфотерный гидроксид
Mg (ОН) 2 – слабое основание
Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи.
Изменяют цвет индикаторов:
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН) 2 + Н 2 SO 4 →
3. Взаимодействуют с кислотными оксидами:
4. Взаимодействуют с растворами солей, если образуется газ или осадок:
Ва(ОН) 2 + K 2 SO 4 →
Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ]
При нагревании разлагаются: Са(ОН) 2 →

Соединения металлов главной подгруппы III группы
Соединения алюминия
Оксид алюминия
Al 2 O 3
O = Al – O – Al = O
Физические свойства: Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий).
Твердое тугоплавкое ( t° пл.=2050 ° С) вещество; существует в нескольких кристаллических модификациях.
Сжигание порошка алюминия: 4 Al + 3 O 2 → 2 Al 2 O 3
Разложение гидроксида алюминия: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O
![Химические свойства Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует. 1) Реагирует с кислотами и растворами щелочей: Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ] 2) Сплавляется со щелочами или карбонатами щелочных металлов: Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2 Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img16.jpg)
Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1) Реагирует с кислотами и растворами щелочей:
Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2
Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O
![Гидроксид алюминия Al ( OH ) 3 Физические свойства: белое кристаллическое вещество, нерастворимое в воде. Способы получения: 1) Осаждением из растворов солей щелочами или гидроксидом аммония: AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4 Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый) 2) Слабым подкислением растворов алюминатов: Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3 Химические свойства Al ( OH ) 3 - а мфотерный гидроксид : 1) Реагирует с кислотами и растворами щелочей: Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ] (тетрагидроксоалюминат натрия) При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img17.jpg)
Гидроксид алюминия Al ( OH ) 3
Физические свойства: белое кристаллическое вещество,
нерастворимое в воде.
1) Осаждением из растворов солей щелочами или гидроксидом аммония:
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl
Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4
Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый)
2) Слабым подкислением растворов алюминатов:
Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3
Al ( OH ) 3 - а мфотерный гидроксид :
Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O
Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ]
При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O

Все металлы образуют солеобразующие оксиды. Однако оксиды проявляют свойства основных оксидов, а другие проявляют кислотно-основные, то есть амфотерные свойства. От чего это зависит? Следует знать следующее – металл, проявляющий степень окисления +1, +2 образует оксиды основного характера, т.к. это типичные металлы, которые расположены в I и II группах, главных подгруппах.
ПРИМЕР: I группа, главная подгруппа представлены элементами Li, Na, K, Rb, Cs, Fe. К концу группы главной подгруппы у элементов возрастает атомный радиус. При отдаче электрона с внешнего уровня образуются катионы. Степень окисления у всех элементов к концу группы не изменяется, а вот характер оксидов – основной, будет усиливаться.
Li2O → Na2O →K2O →Rb2O →Cr2O →Fr2O
Усиливается основной характер
Возрастает радиус нового элемента
Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов III периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаково, однако изменяется степень окисления. К концу периода она возрастает, что вызывает уменьшение радиуса иона. Вследствие чего характер оксида изменяется от основного через амфотерный к кислотному.
Na2 +1 O; Mg +2 O; Al2 +3 O3
Степень окисления возрастает
Радиус иона уменьшается, характер оксида изменяется
от основного к амфотерному
Оксиды металлов соответствуют гидроксиды. Если степень окисления металлов +1, +2, +3, +4, то они образуют оксиды: Ме2 +1 О, Ме +2 О, Ме2 +3 О3, Ме +4 О2 и гидроксиды: Ме +2 (ОН)2, Ме +3 (ОН)3, Ме +4 (ОН)4.
Характер гидроксида зависит также от степени окисления элемента и радиуса иона. Чем больше степень окисления, тем меньше радиус иона, характер гидроксида в большей степени кислотно-основной, то есть проявляет амфотерность.
ПРИМЕР: 3 период. Гидроксиды: Na +1 OH, Mg +2 (OH)2, Al +3 (OH)3
Ослабление свойств оснований, усиление кислотных свойств
Возрастает степень окисления; уменьшается радиус иона;
Щелочь, основание, амфотерное основание
В группах; главных подгруппах:
ПРИМЕР: I группа, главная подгруппа.
Li +1 OН; Na +1 OН; K +1 OН; Rb +1 OН; Cr +1 OН
Степень окисления не изменяется
Радиус иона возрастает,
усиливаются свойства гидроксидов как оснований
Переходные элементы, расположенные в малых периодах – это Ве (2 период), Al(3 период), образуют оксиды ВеО,Al2O3 и гидроксиды Ве(ОН)2и Al(OН)3 - проявляющие амфотерные кислотно-основные свойства. Что это означает?
ПРИМЕР: основные свойства: взаимодействие с кислотами, оксидами и гидроксидами.
ВеО + 2НСl = ВеСl2 + Н2О
Al2O3 + 6НСl = 2AlСl3 + 3Н2О
Ве(ОН)2 + Н2SO4 = BeSO4 + 2Н2О
2Al(OН)3 + 3Н2SO4 = Al2(SO4)3 + 6Н2О
Кислотные свойства: взаимодействие с щелочами и оксидов, и гидроксидов.
Al2O3+ 2KOН = 2KAlO2 + Н2О
Al(OН)3 + 2KOН = 2KAlO2 + Н2О
И если раствор щелочи, то образуется комплекс
Al2O3+ 2KOН + 3Н2О = 2K[Al(OН)4]
Al(OН)3 + KOН = K[Al(OН)4]
Итак, с увеличением степени окисления металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основного к кислотно-основному, а далее проявляют кислотный характер.
У элементов побочных подгрупп изменение степени окисления можно рассмотреть на примере одного металла.
ПРИМЕР: металл Хром(Сr) может проявлять степень окисления +2, +3,+6.
Степень окисления +2. Сr +2 O -2 – основной оксид, гидроксид Cr(OH)2 – основание;
Степень окисления +3. Сr2 +3 O3 -2 – амфотерный оксид, гидроксид Cr(OH)3 – амфотерное основание;
Степень окисления +6. Сr +6 O3 -2 – кислотный оксид, гидроксид Н2СrO4, H2Cr2O7 – кислота.
Известно, что степень окисления максимальная определяется по номеру группы. Элемент Хром расположен в VI группе, побочной подгруппе. Элемент Сера также расположена в этой группе, только в главной подгруппе. В высшей степени окисления они образуют кислотные оксиды Сr2O3 и SO3, которым соответствуют кислоты Н2СrO4, Н2SO4.Знание такого сходства многих элементов позволило Д. И. Менделееву построить укороченную таблицу химических элементов, где в отличие от длиннопериодной кроме групп появились подгруппы – главная и побочная. Все элементы одной группы проявляют максимальную валентность, степень окисления соответственно равна номеру группы.
Вернёмся к примеру с Хромом.
СrO → Сr2O3 → Сr + O3 - оксиды
Cr(OH)2 → Cr(OH)3 → Н2СrO4 - гидроксиды
- Что происходит со степенью окисления?
Степень окисления возрастает.
- Как вы думаете, а радиус иона как изменяется?
Радиус иона Хрома с увеличением степень окисления уменьшается
- Как эти изменения сказываются на свойствах соединения?
Происходит изменение свойств оксидов и гидроксидов от основного, через амфотерный к кислотным.
1. Всем типичным металлам соответствуют оксиды основного характера, а их гидроксиды – основания.
2. Переходные металлы d-элементы образуют несколько оксидов и гидроксидов. В зависимости от изменения степени окисления и радиуса иона в данных соединениях свойства изменяются. При увеличении степени окисления радиус иона уменьшается, ослабевают основные свойства, нарастают кислотно-основные, а затем кислотные как у оксидов, так и у гидроксидов.
3. В одной группе ПСХЭ Д.И. Менделеева, но в разных подгруппах раположены элементы, у которых валентность максимальная степень окисления соответственно равна номеру группы.
v Составить формулу оксида и гидроксида хрома(III). Уравнениями реакций подтвердить их амфотерность.
1)Сr2O3 – оксид хрома(III).
Основной оксид взаимодействует с кислотой:
Сr2O3 + 6HCl = 2CrCl3 + 3H2O.
Кислотный оксид взаимодействует со щелочью:
Сr2O3 + 2KOH = 2KCrO2 + H2O.
2) Cr(OH)3 – гидроксид хрома(III).
Основание, взаимодействует с кислотой:
Cr(OH)3 + 6HCl = 2CrCl3 + 3H2O. Осадок исчезает.
Проявляет кислотные свойства, так как взаимодействует с раствором щелочи: р-р
Cr(OH)3 + KOH = K[Cr(OН)4]. Осадок исчезает.
ИСТОРИЯ ОТЕЧЕСТВА
учебник «ИСТОРИЯ РОССИИ» (часть 3) § 52, п 7 § 53
Охарактеризуйте геополитическое положение России после распада СССР.
Россия укрепила статус мировой державы, что выразилось в росте её международного авторитета.
Россия утратила союзников в Восточной Европе, Азии, Африке, Латинской Америке.
Россия по отношению к Западу практически вернулась к состоянию времён Ивана Грозного.
Значительно ослабла обороноспособности государства.
Как называлась программа военного сотрудничества НАТО с европейскими государствами и бывшими советскими республиками
Закавказья и Центральной Азии, которые не являются членами организации.
Партнёрство во имя мира
Дружба ради справедливости
Какой российский дипломат за постоянное согласие с условиями западных коллег получил прозвище «Мистер "Да"»?
Укажите истинность либо ложность утверждений.
«Большая восьмёрка» – это семь наиболее крупных индустриальных государств мира: США, Япония, Германия, Россия, Франция, Италия,
24 декабря 1991 года Россия заняла место СССР в ООН и стала постоянным членом Совета Безопасности ООН.
В 1998 году был образован политический союз ГУУАМ, в который вошли Грузия, Украина, Казахстан, Беларусь, Россия.
В марте 1992 года Россия и остальные страны СНГ вступили в Североатлантический альянс.
Какое из нижеописанных утверждений нельзя отнести к достижениям Е. Примакова во время его нахождения на посту министра
Развивалось сотрудничество с Вьетнамом в сфере нефтедобычи
Россия была принята в Европейское экономическое сотрудничество
Наладились контакты с Японией, Индией, Южной Кореей, странами Юго-Восточной Азии и Персидского залива
Одним из крупнейших торговых партнёров России на Востоке стал Китай.
Россия и Иран заключили соглашение о сотрудничестве в области мирного использования атомной энергии
Расположите министров иностранных дел Российской Федерации в хронологическом порядке, начиная с самого раннего.
Андрей Владимирович Козырев
Евгений Максимович Примаков
Игорь Сергеевич Иванов
Какие приоритеты в области национальной безопасности России озвучил Б. Ельцин в своём послании к Федеральному Собранию в 1994
Необходимость решения всех международных проблем дипломатическим путём на основе баланса интересов сторон
Усиление контроля за международной торговлей оружием при соблюдении российских интересов в этой области
Ликвидация очагов военных конфликтов у границ государства
Укрепление режима нераспространения оружия массового уничтожения
Отрицание наличия государственных интересов, признание господства общечеловеческих ценностей над классовыми, национальными,
идеологическими, религиозными и всеми остальными
Напишите фамилию министра иностранных дел РФ, при котором Россия была принята в АТЭС.
Используя учебник § 52 и дополнительные материалы составьте хронику важнейших событий во внешней политики России
А) Прочитайте фрагмент Концепции внешней политики Российской Федерации и напишите термин, обозначающий декларируемую в
концепции систему международных отношений.
«… Россия заинтересована в стабильной системе международных отношений, основанной на принципе равноправия, взаимного уважения
и взаимовыгодного сотрудничества. Эта система призвана обеспечить надёжную безопасность каждого члена мирового сообщества в
политической, военной, экономической, гуманитарной и иных областях. Главным центром регулирования международных отношений в
XXI веке должна оставаться Организация Объединённых Наций.»
факты, подтверждающие общность принципов и направлений внешней политики ДНР и РФ.
В) Используя § 52 учебника и дополнительные источники приведите 5-6 фактов свидетельствующих об укреплении позиций России на
внешнеполитической арене. Выделите основные достижения и проблемы внешней политики России на современном этапе.
Проработайте § 53 и дополнительные ресурсы
А. Расшифруйте аббревиатуру и дайте определение следующего понятия. ВВП
Б. Определите и запишите 4-5 первоочередных задач, которые стоят перед Россией в XXI в.
Проанализируйте фрагмент Послания Президента РФ В.В. Путина Федеральному Собранию 12 декабря 2012 г. (с. 103 учебника). Используя
дополнительные источники заполните таблицу
Обращение Путина к Федеральному собранию
2012 г 2018 г. 2020 г.
Сформулируйте главную мысль (идею) обращения. По каким показателям Россия достигла наибольших успехов? Перечислите их.
ПОЯСНЕНИЯ К ВЫПОЛНЕНИЮ ЗАДАНИЙ
1. Форма ответа - Текстовый файл (возможно скан страницы рабочей тетради)
2. задание можно выполнить частями (срок выполнения полного объема задания до 30.04)
3. задания отмеченные *** являются дополнительным заданием
(не является обязательным и оценивается дополнительно)
4. задание 4 и задание В из домашнего задания (Перейдите по ссылке и пройдите тест) - скриншот
страницы результата тестирования
Читайте также:
