Металл основный оксид щелочь соль
Обновлено: 16.05.2024
Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере соединений алюминия и цинка)
Соли – это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металлов.
Общим способом получения солей является взаимодействие оснований с кислотами:
NaOH + HCl = NaCl + H2O (так же эту реакцию называют реакцией нейтрализации, т.к. соли не имеют среды – она нейтральна)
Общая формула солей: Mex(Ac)y, где
Классификация солей
(III) Приставка «ди» используется, если в молекуле основной соли с одним атомом Me связаны с гидроксильными группами.
- Средние (нормальные) соли – это продукты полного замещения атомов водорода на металл.
Название средней соли = название Ac + название Me + валентность Me
- NaCl – хлорид натрия
- Fe(NO3)2 - нитрат железа (II)
Название кислой соли = «Гидро» или «Дигидро» + название Ac + название Me + валентность Me
- NaHCO3 – гидрокарбонат натрия
- KH2PO4 – дигидрофосфат калия
Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me
- CaOHCl – гидроксохлорид кальция
- Ca(OH)2SO4 – гидроксосульфат кальция
- Fe(OH)2NO3 – дигидроксонитрат железа
- [Ag(NH3)2]Сl – хлорид диаммин серебра (I)
- [Cu(NH3)4]SO4 – сульфат тетрааммин меди (II)
- K4[Fe(CN)6] – гексацианоферрат (II) калия
Химические свойства солей
I. Средние соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и анионы Ac.
К примеру, хлорид калия в водном растворе распадается на катионы калия и анионы хлора.
Щелочные и щелочноземельные металлы с солями реагировать не будут, так как вступают в реакцию с водой.
Например, при взаимодействии сульфата меди с железом, происходит замещение меди железом, так как железо более активный металл, чем медь и находится в электрохимическом ряду напряжений левее водорода.
CuSO4 + Fe → FeSO4 + Cu↓
При взаимодействии сульфида железа с цинком происходит тот же процесс, но в данной реакции более активным металлом является цинк. Цинк вытесняет железо из соединения, в результате происходит образование чистого железа.
FeS + Zn → ZnS + Fe↓
Взаимодействие хлорида железа (III) с раствором гидроксида калия является качественной реакцией на ионы Fe 3+ . Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами.
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
В представленной ниже реакции осуществляется взаимодействие между хлоридом бария и серной кислотой. Продуктами реакции являются нерастворимая соль и сильная кислота. Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета – хлорида серебра. Эта реакция является качественной на хлорид-ионы.
AgNO3 + KCl → AgCl↓ + KNO3
- Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
- Если металл находится в ряду напряжений левее магния, то в результате реакции образуется нитрит и кислород. Реакция протекает по следующей схеме:
II. Кислые соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и сложный анион Ac. Диссоциация протекает в две стадии. Первая стадия всегда необратима, по второй стадии протекает обратимая диссоциация.
В результате данной реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.
Реакции разложения гидрокарбонатов кальция и магния являются причиной образования накипи в водонагревательных приборах.
III. Основные соли
- Способны в водных растворах разлагаться на сложные катионы и анионы Ac. Диссоциация проходит в несколько ступеней, причем по первой ступени разложение проходит необратимо. Все последующие ступени протекают обратимо.
Al(OH)2CH3COO → Al(OH)2 + + CH3COO —
Al(OH) 2+ ↔ AlOH 2+ + OH —
Al(OH) 2+ ↔ Al 3+ + OH —
IV. Комплексные соли
- Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).
Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это - вторичная диссоциация комплексных ионов.
Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения:
Данная реакция является качественной реакции на ионы Fe 3+ . Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия.
Металл основный оксид щелочь соль
I. Учебный видео-фильм: “Генетическая связь между отдельными классами неорганических соединений”
II. Генетический ряд металлов
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Генетические связи - это связи между разными классами, основанные на их взаимопревращениях.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→
→основный оксид→металл
III. Генетический ряд неметаллов
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота →кислотный оксид→неметалл
IV. Закрепление
Осуществите превращения по схеме, укажите типы реакций, назовите вещества
V. Тренажёры
Прочитайте отрывок из романа Л. Буссенара «Похитители бриллиантов» и выполните задания:
«Пожар пылал несколько часов подряд. Пещера превратилась в настоящую печь по обжигу извести. Неслыханной силы пламя обожгло весь известковый пласт, который представляет собой углекислую соль кальция. Под действием огня известняк разложился, угольная кислота выделилась, и получилось именно, то, что называется негашеной известью. Оставалось только, чтобы на нее попало известное количество воды.
Так и случилось. Ливень, который последовал за грозой, залил всю эту огромную массу негашеной извести, она разбухла, стала с непреодолимой силой распирать сжимавший её уголь и выталкивать его по направлению к пропасти… Скалы, деревья, клад, мумии – все исчезло в мгновение ока вместе с презренными негодяями».
Задания:
- Составить и осуществить цепочку превращений.
- Решить задачу.
- Определить массу негашеной извести, образующейся при разложении известняка массой 300г., в котором массовая доля некарбонатной примеси составляет 20%.
Лабиринт
Пять человек отправляются в путешествие в царство Солей. Если формула вещества соответствует приведенному под ней названию, то вы переходите к следующему пункту по стрелке «да», если не соответствует – по стрелке «нет». Можно войти в любой «вход». Но правильный «выход» только один – «пункт Г».
Взаимосвязь различных классов неорганических веществ
Как уже известно, существует четыре класса неорганических соединений. К ним относятся оксиды, основания, кислоты и соли. При подробном изучении способов получения каждого класса соединений можно проследить определенную взаимосвязь между всеми классами. Например, из кислот можно получить соли, из оксидов основания и так далее. Такая связь называется генетической.
Следовательно, генетическая связь – это связь между классами неорганических соединений, которая основана на получении веществ одного класса из веществ другого класса, а также их химических свойств.
На основании данной связи составляют генетические ряды, которые включают в себя представителей разных классов, но состоящие из одного элемента.
Генетическую связь можно представить в виде схемы.
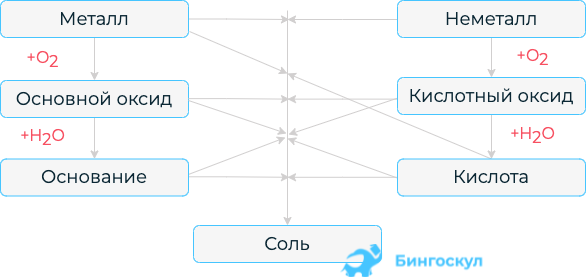
Из данной схемы видно, что существует определенная взаимосвязь между классами. Основополагающими элементами генетического ряда являются либо металл, либо неметалл.
- Для получения оксида необходимо осуществить взаимодействие металла либо неметалла с кислородом.
- При взаимодействии с водой из основного оксида можно получить основание, а из кислотного – кислоту.
- Соль образуется при различных реакциях между всеми классами неорганических соединений. Например, металл + неметалл, основный оксид + кислотный оксид, основание + кислота и так далее.
Можно выделить два типа генетических рядов, которые мы и рассмотрим.
1. Генетический ряд металла
Металл → Основный оксид → Основание → Соль
- Ряд кальция: Ca → CaO → Ca(OH)2 → Ca Cl2;
- Ряд натрия: Na → Na2O → NaOH → Na3PO4;
- Ряд магния: Mg → MgO → Mg(OH)2 → Mg(NO3)2;
- Ряд железа: Fe → FeO → Fe(OH)2 → FeSO4.
Рассмотрим взаимосвязь в данных рядах на примере магния.
- Для получения оксида магния из чистого металла, осуществим реакцию взаимодействия с кислородом.
- При взаимодействии основного оксида с водой, в частности оксида магния, получим основание – гидроксид магния.
- Для получения соли из нерастворимого основания, необходимо добавить кислоту.
2. Генетический ряд неметалла
Неметалл → Кислотный оксид → Кислота → Соль
Рассмотрим взаимосвязь в данных рядах на примере углерода.
- Для получения оксида углерода осуществим реакцию взаимодействия с кислородом – горение. Протекает с выделением энергии.
- При взаимодействии кислотного оксида с водой, в частности оксида углерода, получим угольную кислоту.
- Для получения соли из кислоты, необходимо добавить основание.
Для составления генетических цепочек необходимо знать химические свойства каждого класса неорганических соединений, а также валентные возможности того элемента, который лежит в основе генетического ряда.
Классификация неорганических веществ
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
