Металл плавящийся при комнатной температуре
Обновлено: 04.10.2024
Все зависит от того, что считать комнатной температурой, температура в комнате может быть +18 градусов, а может быть и +40 градусов.
Сплав металлов натрий -12%, калий -47%, цезий -41%, называемый учеными – "Советский сплав" плавится при температуре -79 градусов. Применяется в ракетных двигателях.
Сплав металлов, который в последнее время широко применяется для замены высоко токсичной ртути – галинстан, состоящий на 68% из галия, 22% идия и 10% олова, будет плавится при температуре -19 градусов.
Если комнатной температурой считать +18 градусов, то при такой температуре, из чистых металлов, жидким будет только один металл – ртуть. температура плавления которой составляет -39 градусов.
Один из самых редких элементов на земле – "франций". Температура его плавления составляет +21 градус. Это химически не устойчивый. Сильно радиоактивный металл. Получают его искусственным путем, с помощью ядерных реакций минералов урана. Растворим в воде. Практического применения пока не имеет.
Следующим металлом по легкоплавкости будет Цезий – температура его плавления составляет +28,4 градуса. Радиоактивный, в чистом виде не используется пока нигде. При соединении с цирконием и оловом в безвоздушном пространстве, является источником света. В виде фторида или хлорида цезия используется для сварки молибдена. В качестве бромида цезия, используется для изготовления инфракрасных приборов. Изотопы цезия используются в производстве радиоизотопных источников тока.
Если комнатной считать температуру +29,8 градуса, то жидким металлом становится еще и –галий.
Металл рубидий, плавится при температуре +39 градусов. Это радиоактивный металл. На открытом воздухе и в воде воспламеняется. Способен разрушать твердые металлы. Применяется при производстве ракет.
Натрий – плавится при температуре +98 градусов. Но на открытом воздухе, самовозгорается и начинает гореть уже при температуре -298 градусов. По этому его всегда хранят в керосине или масле.
Здесь легко и интересно общаться. Присоединяйся!
Ртуть ГалийКакой-то из щелочных – плавится в руке.
Могут находится в жидком состоянии при комнатной температуре-есть такие. Но чтобы плавились. Откройте секрет
Незнаю , но интересно
Амальгамы. (Сплавы ртути).
ртуть-температура плавления +18
Галлий — крайне необычный металл серебристого цвета: он хрупкий как стекло, плавится при комнатной температуре и при этом чрезвычайно агрессивен к другим металлам. что с вами с утра. задрал вопросами.
. а то. не здряяя живём.
сам ты это слово.
юноша, вы с Украины?
олово точно не плавится, разве в чашке с чаем. не знаю!
у меня того го нет
Есть еще один? Не могу вспомнить.
Гостеприимный вы, однако.
ртуть жидкий метал
ее можно заморозить.
Галлий. В жидком состоянии находятся ртуть, цезий .
–Музыка
–Поиск по дневнику
–Статистика
Среда, 02 Марта 2011 г. 18:33 + в цитатник
Определение
Галлий (лат. Gallium), Ga, химический элемент III группы периодической системы Д. И. Менделеева Дмитрия Ивановича, порядковый номер 31, атомная масса 69,72; серебристо-белый мягкий металл.
Физические свойства
Кристаллический галий имеет несколько полиморфных модификаций, однако термодинамически устойчивой является только одна (I), имеющая орторомбическую (псевдотетрагональную) решётку с параметрами а = 4,5186 Å, b = 7,6570 Å, c = 4,5256 Å. Другие модификации галлия (β, γ, δ, ε) кристаллизуются из переохлаждённого диспергированного металла и являются нестабильными. При повышенном давлении наблюдались ещё две полиморфные структуры галлия II и III, имеющие, соответственно, кубическую и тетрагональную решётки.
Плотность галлия в твёрдом состоянии при температуре T=20°С равна 5,904 г/см3, жидкий галлий при T=29,8°С имеет плотность 6,095 г/см3, то есть при затвердевании объём галлия увеличивается. Температура плавления галлия немного выше комнатной и равна Tпл.=29,8 °C, кипит галлий при Tкип.=2230°С.
Одной из особенностей галлия является широкий температурный интервал существования жидкого состояния (от 30 и до 2230°С), при этом он имеет низкое давление пара при температурах до 1100÷1200°С. Удельная теплоёмкость твёрдого галлия в температурном интервале T÷24°С равна 376,7 Дж/кг·К (0,09 кал/г·град.), в жидком состоянии при T=29÷100°С — 410 Дж/кг·К (0,098 кал/г·град).
Галлий — типичный рассеянный элемент, иногда его также относят и к редким.
Кларк (числовая оценка среднего содержания в земной коре) галлия в земной коре довольно велик и составляет 1,5·10-3 %(масс.). Таким образом, его содержание больше, чем молибдена, висмута, вольфрама, ртути и некоторых других элементов, обычно не относимых к редким.
Основным источником галлия являются бокситы (гидратированный оксид алюминия). Интересно, что бокситовые руды независимо от их местонахождения и особенностей происхождения характеризуются постоянно-равномерным распределением в них галлия — 0,002-0,006 %. Нефелины из апатито-нефелиновых руд Хибинских гор содержат галлий в значительных количествах (0,01-0,04 .
Основные мировые резервы галлия связывают с месторождениями бокситов, запасы которых настолько велики, что не будут истощены в течение многих десятилетий. Однако большая часть галлия, содержащегося в боксите, остается недоступной вследствие недостатка производственных мощностей, объем которых диктуется экономическими причинами. Реальные запасы галлия трудно поддаются оценке. По мнению специалистов U.S. Geological Surveys мировые ресурсы галлия, связанные с месторождениям бокситов, составляют 1 млн тонн. Значительными запасами галлия обладают Китай, США, Россия, Украина, Казахстан.
Получение
Галлий – рассеянный элемент, являющийся постоянным спутником алюминия и цинка, поэтому его производство всегда привязано к переработке алюминиевых или сульфидных полиметаллических (в особенности цинковых) руд. Обычно извлечение галлия из цинковых концентратов сопряжено со многими трудностями, обусловливающими высокую цена металла, поэтому на протяжении уже нескольких десятилетий основным источником (95 получения галлия являются отходы алюминиевой промышленности, а на долю т.н. комплексной переработки отходов (попутно с извлечением цинка, индия, германия) приходится около 5% производственных мощностей. Кроме того, существуют технологии извлечения галлия из колошниковой пыли и золы от сжигания углей, а также отходов их коксования.
Применение
Широкого промышленного применения галлий пока не имеет.
Потенциально возможные масштабы попутного получения галлий в производстве алюминия до сих пор значительно превосходят спрос на металл.
Наиболее перспективно применение галлия в виде химических соединений типа GaAs, GaP, GaSb, обладающих полупроводниковыми свойствами. Они могут применяться в высокотемпературных выпрямителях и транзисторах, солнечных батареях и др. приборах, где может быть использован фотоэффект в запирающем слое, а также в приёмниках инфракрасного излучения. Галлий можно использовать для изготовления оптических зеркал, отличающихся высокой отражательной способностью.
Галлий дорог, в 2005 году на мировом рынке тонна галлия стоила 1,2 млн американских долларов, и в связи с высокой стоимостью и в то же время с большой потребностью в этом металле очень важно наладить его полное извлечение при алюминиевом производстве и переработке каменных углей на жидкое топливо.
Галлий имеет ряд сплавов, жидких при комнатной температуре, и один из его сплавов имеет температуру плавления 3 °C, но с другой стороны галлий (сплавы в меньшей степени) весьма агрессивен к большинству конструкционных материалов (растрескивание и размывание сплавов при высокой температуре), и как теплоноситель он малоэффективен, а зачастую просто неприемлем.
Галлий — превосходный смазочный материал. На основе галлия и никеля, галлия и скандия созданы практически очень важные металлические клеи.
Оксид галлия входит в состав ряда стратегически важных лазерных материалов группы гранатов — ГСГГ, ИАГ, ИСГГ и др.
Галлиевые термометры позволяют в принципе измерить температуру от 30 до 2230° С. Сейчас выпускаются галлиевые термометры для температур до 1200° С.
Элемент № 31 идет на производство легкоплавких сплавов, используемых в сигнальных устройствах. Сплав галлия с индием плавится уже при 16° С. Это самый легкоплавкий из всех известных сплавов.
Какой металл можно расплавить в кипящей воде
Передавая телу энергию, можно перевести его из твёрдого состояния в жидкое (например, расплавить лёд), а из жидкого — в газообразное (превратить воду в пар).
Если газ отдаёт энергию, то может превратиться в жидкость, а жидкость, отдавая энергию, может превратиться в твёрдое тело.
Переход вещества из твёрдого состояния в жидкое называют плавлением.
Чтобы расплавить тело, нужно сначала нагреть его до определённой температуры.
Температуру, при которой вещество плавится, называют температурой плавления вещества.

Плавление олова в стальной ложке
Одни кристаллические тела плавятся при низкой температуре, другие — при высокой. Лёд, например, можно расплавить, внеся его в комнату. Кусок олова или свинца — в стальной ложке, нагревая её на спиртовке. Железо плавят в специальных печах, где достигается высокая температура.
Из таблицы 3 видно, в каких широких пределах лежат температуры плавления различных веществ.
Таблица 3.
Температура плавления некоторых веществ (при нормальном атмосферном давлении)

Например, температура плавления металла цезия 29 °С, т. е. его можно расплавить в тёплой воде.
Переход вещества из жидкого состояния в твёрдое называют отвердеванием или кристаллизацией.
Чтобы началась кристаллизация расплавленного тела, оно должно остыть до определённой температуры.
Температура, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации.
Опыт показывает, что вещества отвердевают при той же температуре, при которой плавятся. Например, вода кристаллизуется (а лед плавится) при 0 °С, чистое железо плавится и кристаллизуется при температуре 1539°С.

Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс

Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик

Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Всё зависит от массы металла, который нужно расплавить и от его формы. Посмотрим, какие металлы самые легкоплавкие. Ртуть расплавлять не нужно, она и так жидкая. Цезий плавится при 28°С, нор самовоспламеняется на воздухе, его плавить не нужно. Галлий плавится при температуре 30°С, его (в ампуле) можно расплавить подмышкой или (в небольшим количестве) – расплавить дыханием на ладони. Рубидий плавится при 39°С, очень активный, но можно расплавить теплой водой, если он в запаянной ампуле. Горячей водой можно расплавить (в запаянных ампулах) калий (плавится при 63°С) и натрий (98°С). Индий плавится при 156°С – никаких проблем. Литий (186°С) плавим на газу в запаянной ампуле. Олово (232°С) плавится паяльником. Висмут (плавится при 271°С), таллий (248°С – яд!), кадмий (321°С – ядовит!) и свинец (327°С) расплавляются тоже легко. Цинк (419°С) я плавил на газу в больших количествах в консервной банке. Сурьме (631°С) может плавиться в запаянной тугоплавкой ампуле, иначе загорится. Магний (651°С) тоже легко загорается, но в инертной атмосфере лента из магния расплавится. Алюминий (660°С каждый может расплавить, если взять проволоку, только капелька расплава повиснет с чехольчике из тугоплавкого оксида алюминия. Барий (660°С) и стронций (770°С) слишком активны на воздухе. Но даже серебро (961°С), золото (1063°С) и медь (1083°) можно расплавить на газу, если взять тонкую проволоку (маленький теплоотвод) и сунуть ее конец в самое горячую часть пламени (синюю) – образуется на конце проволоки маленький королек расплавленного металла. А вот марганец (1250°С) и тем более кобальт, никель и железо уже не расплавить.
Жидкий металл: подводные камни. Взгляд глазами химика

Написать эту статью меня сподвиг пост NotSlow Не так страшен жидкий металл. Там все просто: подстраховался от замыкания, нанес тонким слоем, прикрутил и радуйся низким температурам. Но так ли все хорошо на самом деле?
Для начала нужно выяснить, что это за жидкий металл такой. Среди чистых металлов единственный, который может быть жидким при комнатной температуре — это ртуть. В здравом уме никто сейчас не станет применять ртуть в качестве термоинтерфейса из-за ее крайней токсичности и испаряемости. Два других становятся жидкими уже при температуре человеческого тела — это цезий и галлий. Цезий — это «фтор наоборот» по своей химической активности, он возгорается и взрывается от малейших следов воздуха и влаги и даже разрушает стекло. Остается галлий (на КПДВ именно он). При комнатной температуре галлий все же твердый, однако с некоторыми другими легкоплавкими металлами он образует эвтектики, плавящиеся при 20,5°С (галлий-олово) и даже 15,3 °С (галлий-индий). Еще ниже — в районе 5 °С — плавится тройная эвтектика галлий-индий-олово (62, 25 и 13% соответственно). Имеющиеся в продаже термоинтерфейсы типа «жидкий металл» — это как раз и есть сплавы на основе этих трех элементов, возможно с некоторыми дополнительными присадками.
Исходя из этого, ясны и подводные камни. Первый из них — это абсолютная несовместимость галлийсодержащих сплавов с алюминием!
Во времена, когда уроки химии в школе непременно сопровождались демонстрацией опытов, был среди них и опыт по амальгамированию алюминия. Алюминий покрывали слоем ртути и он тотчас начинал бурно окисляться, рассыпаясь прямо на глазах. Ртуть защищала алюминий от образования оксидного слоя и он образовывался уже на поверхности амальгамы, но не был способен остановить окисление, так как на поверхности жидкости он не удерживался сплошным слоем, растрескивался, и в трещинах открывалась свежая, неокисленная поверхность амальгамы.
Ровно так же действует и галлиевый сплав с той только разницей, что он способен буквально пропитывать алюминий насквозь, проникая в межкристаллитные промежутки. Алюминий, пропитанный жидким галлием, не только окисляется на глазах, но еще и крошится в руках.
Так что ЖМ следует держать от алюминия подальше. И это касается не только алюминиевых радиаторов: случайная капелька «жидкого металла» может уничтожить и корпус ноутбука, если тот из алюминиевого сплава, и любую другую алюминиевую деталь. Хотя бы корпус какого-нибудь конденсатора. Причем капелька эта является классическим катализатором — делает свое черное дело, не расходуясь сама.
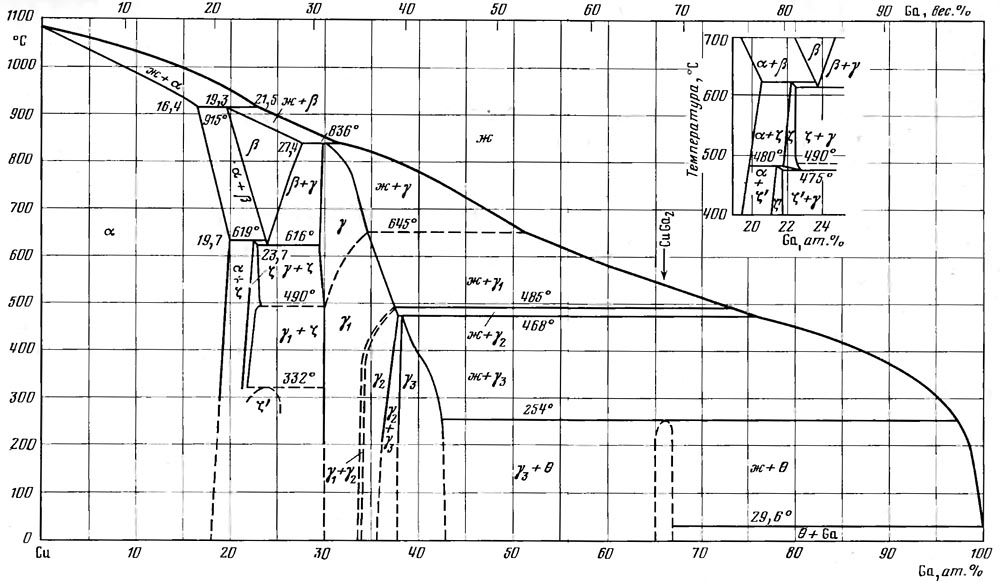
Но и медь к галлию небезразлична. На рисунке выше я привел T-x диаграмму системы медь-галлий (из справочника «Диаграммы состояния двойных металлических систем» под ред. Лякишева), на которой видно бесчисленное множество интерметаллических соединений. Как только галлий вступит в контакт с медью, они тут же начинают образовываться. Жидкий галлий (к его сплавам это тоже относится) вообще очень охотно смачивает и металлы, и неметаллы, а явное химическое сродство этому крайне способствует. Так что «жидкий металл» будет просто впитываться в медь, образуя на границе между металлами корку интерметаллидов. Последние не являются металлами с физической точки зрения, они тугоплавки, хрупки и обладают плохой тепло- и электропроводностью, но главное — «жидкий металл» будет расходоваться на их образование и просто уйдет из зазора. Многие из тех, кто пробовал в деле ЖМ, сообщают, что со временем он перестает работать, и сняв радиатор, они обнаружили, что жидкий металл «испарился». Испариться он не мог — заметное давление пара у его компонентов появляется только свыше тысячи градусов — он просто впитался в медь, прореагировал с ней. Устранить это явление помогает никелевое покрытие на меди, хоть оно и является дополнительным препятствием для тепла.
Кстати, впитываемость галлия и его сплавов в металлы еще касается паяных соединений — помните про ту маленькую капельку, которая может разрушить алюминиевый корпус? Так вот, такая же капелька, попавшая на припой, сделает и его хрупкой, а пайку ненадежной. В какой-то момент это «сработает». Поэтому лично я бы держал «жидкий металл» как можно дальше от любой электроники.
И последнее, о чем следовало бы написать: «жидкий металл», увы, небезвреден. Галлий по некоторым данным сравним по токсичности с мышьяком, второй его компонент, индий — также является токсичным тяжелым металлом. В отличие от ртути сплавы на основе галлия все же абсолютно нелетучи при обычной температуре, так что отравиться их парами не получится, однако из-за своей способности легко прилипать ко всему на свете эти сплавы невероятно мазучие. Испачкать ими, к примеру, руки — легче легкого, а отмыть их до конца очень сложно. Потом это все попадет в рот. Поэтому — работаем с «жидким металлом» и всем, что с ним контактировало только в резиновых перчатках и отдельно от еды, питья и курения. И да, никогда не делайте так, как на КПДВ!
4 невероятных химических субстанции, открытые людьми
Ученые открывают и создают новые материалы постоянно. Но иногда обнаруживаются такие вещи, что челюсть с грохотом падает на пол. Их нужно знать в лицо. От неописуемо легких твердых веществ, используемых NASA, до металлов, которые плавятся в руке, мы нашли для вас несколько невероятных химических веществ, известных и не очень. Быстренько по ним пробежимся.

Аэрогель: самое легкое твердое вещество
Этот удивительный гель представляет собой самое легкое в мире твердое вещество. С момента его изобретения в 1931 году американским ученым Самюэлем Кистлером, он использовался в космических миссиях для сбора пыли из хвоста кометы, госагентствами для разработки изолированных палаток и даже для изготовления одежды, которая защищает человека от экстремального тепла.
NASA назвало его «синим дымом», поскольку выглядит он как голограмма.
Крутым это вещество делают его парадоксальные свойства. Этот жесткий гель состоит по большей части из воздуха, поэтому весит мало, напоминая губку. При этом он отлично отталкивает тепло. Как видно на снимке ниже, он защищает цветок от сильного пламени.

Отдельные молекулы, которые составляют аэрогель, действуют подобно миниатюрным бейсбольным перчаткам — они улавливают быстро движущиеся частицы, не повреждая их. Это свойство оказалось крайне полезным во время миссии NASA Stardust.
Ученые наполнили силикатным аэрогелем массивный коллектор в форме ракетки, который находился снаружи на корабле Stardust. Его цель была в захвате хрупких частиц, остающихся после кометы Уайльд-2, не повреждая их. Поскольку аэрогель прочный и относительно прозрачный, ученые с легкостью обнаружили и извлекли частицы позже для анализа.
Предшественник аэрогеля структурно напоминает желе. Желатиновый порошок в желе образует гибкий, жидкий раствор при смешивании с теплой водой, после чего охлаждается до жесткой запутанной сети, которая химически напоминает непослушный мяч в упряжке, принимая установленную форму. Если вы нагреете желе, оно высохнет и вы снова получите порошок.
Аэрогель, с другой стороны, состоит не из желатина. Чаще всего его делают из кремния, самого распространенного минерала в земной коре Земли. Влажный аэрогель проходит через цикл охлаждения и нагревания под давлением, что позволяет ему сохранять свою форму даже после высыхания. Получившийся аэрогель практически воздушный, твердый и очень легкий. На ощупь он как пенополистирол. Аэрогель можно сделать даже самостоятельно, если знать как.
Галлий: металл, который плавится при комнатной температуре

Этот мягкий, блестящий и одновременно твердый металл довольно необычный. При низких температурах он принимает твердую форму. Но при нагреве до комнатной температуры он плавится в блестящую лужу.

До сих пор его основное применение было в сфере производства смартфонов, аэрокосмической области и в сфере связи. И хотя этот химический элемент присутствует в периодической таблице, в природе он не встречается. Его следы можно найти в цинковой руде и бокситах, из которых делают алюминий. Еще он имеется на Amazon, где его можно купить всего за 10 баксов.
И если вам удастся его раздобыть, держите его подальше от техники — он плохо влияет на другие металлы. Особенно это будет заметно, если алюминий на спинке вашего телефона поцарапан, что позволит галлию проникнуть глубже в металлическую решетку. Смотрите, что будет, если облить галлием поцарапанную крышку iPhone.
Через несколько часов она полностью разложится.

Алмазные нанонити: возможная основа для космического лифта?

Это относительно новое рукотворное волокно из атомов углерода, выстроенных в зигзагообразную структуру, похожу на алмазную, может быть самым прочным и жестким наноматериалом из всех, что мы когда-либо делали.
Открытое в 2014 году, это волокно выявило силу, которая превосходит углеродные нанотрубки, еще один сверхпрочный и легковесный материал. При всем этом оно чрезвычайно тонкое. Всего три атома в поперечнике, гораздо тоньше человеческого волоса. Поскольку эта структура была открыта совсем недавно, ее состав еще должны подтвердить снимки высокого разрешения.

Свойства и поведение тоже нуждаются в более глубоком понимании, прежде чем ее можно будет производить в коммерческих масштабах. Но если все получится, эти алмазные нановолокна могут в теории стать достаточно прочными, чтобы лечь в основу кабеля для космического лифта. Другие кандидаты, например сталь, ломаются под собственным весом.
Ферромагнитная жидкость

Эта похожая на дикобраза кучка сверхтонких магнитных частиц — железа, как правило — это жидкость, которая начинает танцевать и выстраивать невероятные структуры при воздействии магнитного поля.
Каждая отдельная крошечная частица в феррофлюиде (ferrofluid) покрыта поверхностно-активным веществом, которое препятствует слипанию частиц вместе, и суспендирована в жидкости — воде, например. Эти частицы не похожи на магниты на вашем холодильнике. Это «парамагнитные» частицы, то есть становятся крошечными магнитами в присутствии магнитного поля, которые движутся и слипаются с другими крошечными магнитами в поле.

Ферромагнитная жидкость была создана в 1963 году ученым NASA Стивом Паппелом как прототип для ракетного топлива, которое должно было двигать космический аппарат после применения магнитного поля на нее. Самое странное в ферромагнитных жидкостях то, что они ведут себя одновременно как жидкости и как твердые материалы.
Легкоплавкие металлы

С легкоплавкими металлами большинство из нас сталкивается в быту. Всем давно известен ртутный термометр, который позволяет измерять температуру тела человека. За счет низкой температуры плавления ртуть быстро расширяется и демонстрирует, стоит ли срочно принимать жаропонижающее или же перед нами обычный пример «воспаления хитрости».
Ну, а без свинца опытные рыбаки вообще не выходят из дома. Да, удилища просто необходимы, но для утяжеления лески применяются свинцовые грузила, которым можно легко придать форму обычными ручными инструментами. А где еще применяют легкоплавкие металлы?
Какие металлы являются самыми легкоплавкими
Легкоплавкие – это металлы с малой температурой плавления. В номенклатуре, принятой Международным союзом теоретической и прикладной химии (ИЮПАК), такого термина не существует. Специалисты не могут прийти к общему мнению относительно температуры, которая является показателем легкоплавкости: одни говорят о пороге плавления +500 °C, вторые – +600 °C.
И все же основной считается классификация, устанавливающая температуру плавления не более +500 °C. В таблице указаны наиболее распространенные и самые легкоплавкие металлы:
Температура плавления (°С)
Ртуть является наиболее легкоплавким металлом, так как единственная способна менять агрегатное состояние при минусовой температуре. Галлий известен как тающий в руках металл, ведь точка его плавления почти на 7 °C ниже нормальной температуры тела человека.

Среди легкоплавких металлов принято выделять две группы:
- Тяжелые, то есть кадмий, кобальт, свинец, ртуть.
- Легкие, в число которых входят олово, галлий, индий, таллий, полоний, висмут.
К драгоценным элементам относится палладий.
VT-metall предлагает услуги:
Лазерная резка металла Гибка металла Порошковая покраска металла Сварочные работы
Легкоплавкие металлы в приведенном ниже списке названий могут оказывать разное воздействие на живых существ и человеческий организм:
- Калий необходим растениям в качестве удобрения, иначе они начинают болеть и плохо плодоносят. В организме людей этот элемент отвечает за жизненно важные процессы и работает вместе с натрием.
- Кадмий в микродозах положительно влияет на метаболизм, хотя является токсичным, как и его растворимые соединения.
- Висмут токсичен и радиоактивен, при этом входит в состав аптечных препаратов. Их важно принимать только по инструкции, чтобы не навредить организму.
- Галлий токсичен, правда, специалисты расходятся во мнении относительно его опасности – от малой до высокой степени.
- Свинец и ртуть также токсичны и являются бесполезными для человеческого организма даже в малых дозах. Наибольшую опасность представляет собой ртуть из разбившегося медицинского градусника.
- Таллий является сильнейшим ядом, несмотря на то, что выглядит достаточно привлекательно – это мягкое серебристое или серовато-голубое вещество. Он стал широко известен благодаря произведениям Агаты Кристи, ведь в десятке ее романов содержится описание яда, за счет применения этого легкоплавкого металла ее герои часто решали свои проблемы.
Свойства легкоплавких металлов, активно применяемых в промышленности и быту
Известно немало металлов, плавящихся при температуре до +600 °C, но лишь некоторые из них активно используются в промышленности и быту. На остальные приходится в пределах 10 % рынка цветных и черных металлов. Остановимся на наиболее распространенных легкоплавких металлах.
Впервые металл упоминается в неявном виде еще древними греками и египтянами. В те времена его использовали как компонент латуни. В промышленных масштабах производить цинк начали в 1743 году в Бристоле, а в 1746-м появился отдельный способ его получения. Он предполагал прокаливание окиси смеси с углем без доступа кислорода и последующее охлаждение паров в холодильном оборудовании.

Цинк отличается такими химическими и физическими особенностями:
- имеет серебристо-белый цвет, высокую пластичность при +100…+150 °C;
- при комнатной температуре настолько хрупкий, что даже незначительные сгибания вызывают различимый хруст;
- плавится при +419 °C;
- количество примесей непосредственно влияет на хрупкость этого легкоплавкого металла;
- способен образовывать амфотерные соединения;
- под действием воздуха на поверхности цинка формируется оксидная пленка.
Известно свыше 65 минералов, содержащих цинк. Его доля в земной коре исчисляется в пределах 8*10^(-3) %. Цинк есть и в воде, он активно мигрирует в термальных потоках, как и свинец. Крупнейшие месторождения этого металла находятся в Иране, Австралии, Боливии, Казахстане.
Примеры использования данного легкоплавкого металла:
- как антикоррозийное покрытие железа/стали;
- в качестве компонента аккумуляторов и элементов питания сухого типа;
- в типографском деле, где металл используется в виде листов;
- как составляющая сплавов в полупроводниках.
В человеческом организме цинк выполняет функцию катализатора, является компонентом инсулина. Основными источниками этого элемента являются молоко, мясо и яйца. При недостаточном содержании цинка в почве растения начинают болеть. В чистом виде металл является малотоксичным.
Свинец
Это серебристый легкоплавкий металл, который может иметь беловатый или голубоватый отлив. Он широко распространен и прост в обработке, поэтому применялся человеком еще за 6 400 лет до н. э. К промышленному производству свинца приступили в 1840 году, а к концу XX века спрос на него стал падать, так как появились менее опасные для здоровья материалы. В результате пришлось снизить темпы его добычи.
Физические свойства
Химические свойства
Имеет низкую теплопроводность в пределах 35 Вт/(м*к) при 0 °C
Образует оксиды при взаимодействии с кислородом
Отличается высокой пластичностью – свинцовые изделия можно царапать, разрезать ножом, сгибать
Является хорошим реагентом для кислот
Обладает температурой плавления – +328 °C, кипения – +1750 °C
Вступает в реакцию с растворами щелочей
Относится к тяжелым металлам, имея плотность 11,34 г/см3, но данный показатель снижается при повышении температуры
Ряд соединений свинца имеет повышенные кислотные свойства, из-за чего вещество считается окислителем
При достижении 7,26 °K превращается в сверхпроводник
Свинец добывают из руды с галенитом методом флотации, чтобы получить концентрат с 50–80 % чистого вещества. После чего используют один из четырех методов, чтобы изготовить черновой свинец. Основные месторождения данного легкоплавкого металла находятся в США, Китае, России.

Сферы применения свинца:
- изготовление взрывчатки – в ход идет нитрат свинца;
- черная промышленность – выполняет функцию компонента тяжелых жидкостей по обогащению руд;
- катодный материал в источниках тока химического типа;
- термоэлектрический материал – для этого используют теллурид свинца;
- основа свинцовых аккумуляторов и иных источников питания;
- производство шпаклевки и некоторых разновидностей краски;
- присадка для повышения октанового числа бензина.
В медицинской сфере этот металл защищает людей от излучения рентгеновских аппаратов. Один килограмм свинца сейчас стоит всего 2-3 доллара.
Данный легкоплавкий металл сам по себе нетоксичный, зато его производные соединения очень опасны.
Кадмий
Мягкий и ковкий, тягучий металл серебристо-белого цвета. В отличие от описанных выше легкоплавких металлов, стал известен относительно поздно – лишь в 1817 году. Его открыл немецкий профессор Ф. Штромейер, дав название, происходившее от руды, из которой тогда добывали цинк. В земной коре доля кадмия составляет 130 мг/т. В воде он содержится в пропорции 0,11 мк/л. В природе существует только шесть минералов, в составе которых есть кадмий, но в целом он распространен так же широко, как цинк.

Физические характеристики данного легкоплавкого металла:
Почти 40 % производства кадмия обеспечивает изготовление антикоррозийных покрытий для других сплавов. Кадмирование считается электролитической операцией и одним из лучших способов защитить детали и инструменты от образования очагов ржавчины. 20 % получаемого кадмия используют как добавку для краски. Также этот легкоплавкий металл участвует в производстве пленочных солнечных батарей, полупроводников, криогенной техники, задействуется при пайке алюминия.
Не стоит забывать, что в больших концентрациях соединения кадмия являются ядом.
Таллий
Таллий также считается легкоплавким металлом, ведь плавится при +304 °C, а закипает при +1473 °C.

Он был открыт в 1861 году английским ученым Круксом через спектральный метод. Название, выбранное для металла, объясняется наличием зеленых линий спектра – «таллий» переводится с греческого как «зеленая ветвь». Этот металл входит в число элементов рассеянного типа. На данный момент известно всего семь минералов, в которых в неявном виде фигурируют частицы таллия. В земной коре он присутствует в объемах 3,5*10^(-5) %.
Таллий используется в таких сферах:
- в виде амальгамы как теплоноситель в термометрах;
- при кардиологических исследованиях;
- как материал линз в инфракрасной оптике;
- как добавка в металлогалогеновые лампы;
- в минералогии позволяет определять характеристики минералов;
- как яд против грызунов в труднодоступных местах.
Основными физическими свойствами данного легкоплавкого металла являются сверхпроводимость при температуре выше 2,39 °K, твердость 1,3 по Моосу и 20 МПа по Бриннелю. Химическими свойствами таллия является способность вступать в реакцию с неметаллами, хорошая растворимость в азотной и серной кислоте и инертность по отношению к щелочам.
Таллий не является важным элементом для нормальной жизнедеятельности человеческого организма. Более того, он считается ядом кумулятивного типа и при значительных концентрациях приводит к поражению почек, нервной системы, ЖКТ.
Висмут
Этот красивый металл когда-то применяли как материал для ковки эффектных переливающихся сабель, основ винтовок и другого оружия. Первые упоминания о металле датируются 1546-м годом, однако официальное признание он получил лишь спустя почти 200 лет – в 1739 году. Еще через 80 лет элемент был внесен в периодическую систему.

В земной коре содержится 2*10^(-5) % висмута. Он встречается как чистый элемент в руде, поэтому его добыча не представляет большого труда. В промышленных масштабах примерно 85 % материала получают как попутный продукт от переработки медных, оловянных, свинцовых и других руд.
Физические особенности данного легкоплавкого металла:
- 8 кристаллографических модификаций;
- повышение плотности при переходе из твердого состояния в жидкое;
- увеличение удельного электрического сопротивления при росте температуры;
- низкая теплопроводимость на уровне 7,9 Вт/(м*К);
- плавится при +271 °C, кипит при +1564 °C;
- модуль упругости составляет 33–35 ГПа, а модуль сдвига равен 12,5 ГПа;
- хрупкость при комнатной температуре, становится пластичным при +160…+230 °C.
Речь идет о редком металле, ежегодные объемы добычи которого в чистом виде составляют не более 6 200 тонн. Главными странами-поставщиками висмута являются Германия, Монголия, Австралия, Перу, Россия. Цена на этот металл меняется в зависимости от спроса, например, в 2020 году за килограмм висмута просили 12$.
Олово
Люди начали использовать данный легкоплавкий металл в IV веке до н.э., но в чистом виде научились его получать лишь в XXI-м. Олово плавится при +231 °C и закипает при +2 620 °C. Модуль упругости равен 55 ГПа, а временное сопротивление на разрыв составляет 20 МПа. Твердость по Бринеллю у белого и серого олова находится на уровне в 152 МПа и 62 МПа соответственно. Для литья этого металла необходима температура +260…+300 °C.
Олово используется в таких областях:
- в качестве антикоррозийного покрытия в чистом виде либо в качестве сплава – таковыми на основе олова являются белая жесть, бронза и пьютер, который давно стал наиболее распространенным материалом для изготовления посуды;
- как компонент красок;
- в сфере гамма-резонансной спектроскопии;
- в качестве легирующего элемента в производстве титана;
- как абразив – для этих целей применяют двуокись олова;
- как анодный материал в источниках тока химического типа.
Олово считается рассеянным редким элементом, его доля в земной коре находится в пределах 2–8*10^(-3)%. Этот легкоплавкий металл добывают преимущественно из минерала касситерита, который имеет в своем составе до 80 % чистого олова. Вторым по содержанию данного элемента является станнин, известный как оловянный колчедан – в нем содержится до 30 % олова. Главными поставщиками этого металла являются Китай и страны Юго-восточной Азии.
Сейчас нет достоверных сведений относительно влияния олова на организм человека, однако передозировка чревата отравлением и хроническими заболеваниями легких.
Индий
Его в 1863 году открыли немецкие ученые Ф. Рейх и Т. Рихтер. Свое название металл получил из-за синего цвета линий в спектре или цвета индиго, а не в честь Индии, как это может показаться. Индий в чистом виде является редким и дорогим – цена на него стартует от 100 долларов за килограмм. Это объясняется тем, что он встречается всего в пяти минералах, а содержание в земной коре находится на уровне 10^(-5) %.

Сферы использования этого легкоплавкого металла:
- производство ЖК-экранов, обязательным элементом которых является оксидно-оловянная пленка;
- микроэлектроника, где он выполняет функцию акцепторной примеси;
- компонент легкоплавких припоев;
- покрытие зеркал, поскольку по своим отражающим свойствам индий не уступает серебру;
- основа для фотоэлементов;
- производство «голубого золота»;
- уплотнитель, применяемый в вакууме.
Температура плавления этого легкоплавкого металла равна +157 °C, закипает он при +2072 °C. Критическая температура, при которой ему присуща сверхпроводимость, находится на уровне 3,404 °К. Твердость по Бринеллю составляет 9 МПа, а по Моосу – 1,2. Индий производят из отходов цинка, реже свинца и олова. Металл не играет значимой роли в человеческом организме.
Ртуть
Ртуть является ядом. Она активно задействовалась людьми в разных областях уже до нашей эры. Например, античные и средневековые медики лечили этим материалом венерические и другие болезни, алхимики старались превратить его в золото. В современном мире этот наиболее легкоплавкий металл используется в электротехнике, приборостроении, органической химии.

При комнатной температуре ртуть остается жидкой, поскольку плавится уже при -39 °C. Так как ее пары чрезвычайно опасны, данное вещество может содержаться только в закрытом виде.
Галлий
Галлий реже используется в промышленности, чем другие описанные металлы, зато его способность к плавлению можно ощутить, просто прикоснувшись. Дело в том, что этот легкоплавкий металл становится мягким при +29,8 °C, что гораздо ниже температуры тела человека. Иными словами, он просто растекается в руках.

О существовании этого элемента рассуждал еще Д. Менделеев, однако выделить его получилось лишь в 1875 году.
Галлий относится к типичным рассеянным химическим элементам с двойной геохимической природой, а в земной коре его содержится около 19 граммов на тонну. Он не встречается в чистой форме, зато входит в состав множества минералов. Главными экспортерами галлия считаются страны Юго-Западной Африки, Россия, некоторые государства, входящие в СНГ.
Сферы использования металла:
- изготовление соединений полупроводникового типа – на эти цели уходит до 97 % добываемого галлия;
- в качестве холодной пайки в радиоэлектронике для металла и керамики;
- как легирующий элемент;
- дли изготовления оптических зеркал;
- вместо ртути в выпрямителях электрического тока.
Рекомендуем статьи
Галлий считается малотоксичным веществом и не играет значимой роли в жизнедеятельности организмов. Хотя этот металл не является самым легкоплавким в мире, его считают таковым из-за изменений, которые он претерпевает от тепла рук.
Это далеко не все легкоплавкие металлы, однако сфера применения остальных настолько ограничена, что не имеет смысла говорить о них в рамках одной статьи.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Читайте также:
