Металл применяемый как восстановитель в металлургии
Обновлено: 22.09.2024
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
ВОССТАНОВЛЕНИЕ МЕТАЛЛОВ
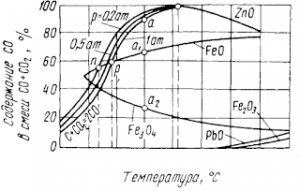
Металлы применяют в элементарном состоянии в виде сплавов и химических соединений. В рудах они связаны в окислы, сульфиды, хлориды, силикаты и иные соединения — минералы. Одна из главных задач металлургии состоит в получении свободных металлов восстановлением природных соединений. Из многих пригодных для этого химических реакций ниже рассмотрены только экономически целесообразные, применяемые в практике металлургии.
Восстановление углеродом или водородом
Наиболее доступный и дешевый восстановитель — углерод— составляет основную массу каменных углей. Восстановление углеродом, например окиси двухвалентного железа, можно записать следующими уравнениями:
Подобные реакции идут вправо — в сторону восстановления, если прочность химической связи кислорода с углеродом больше прочности связи его с металлом. Как известно, прочность химической связи называют сродством, которое в термодинамике измеряют величиной стандартного термодинамического изобар-но-изотермического потенциала, обозначаемого символом ΔZ°. Сродство выражают в Джоулях. Физический смысл его — максимальная работа, которую может совершить реакция. Ее условно считают отрицательной, поэтому отрицательная величина ΔZ° указывает на работоспособность реакции — возможность самопроизвольного ее протекания. Говоря ниже об увеличении термодинамического потенциала, мы будем понимать это, как сдвиг ΔZ в отрицательном направлении. Применение уравнений химической термодинамики часто затруднено отсутствием исходных данных и сложностью расчетов. Более удобны полуэмпирические зависимости ΔZ от температуры типа
здесь Т —абсолютная температура, К, а постоянные коэффициенты А, В, С приведены в справочниках. Для расчета сложных реакций формулу комбинируют с известным уравнением
Из этого легко определить, при какой температуре восстановление железа в стандартных условиях (при рсо = 101325 Па). Давления паров Fe и FeO приняты постоянными, поскольку они находятся в равновесии с соответствующими конденсированными твердыми или жидкими фазами. При равновесии реакции ΔZ 0 Т = 0.
Приведенный расчет сравнительно прост из-за отсутствия в нужных для него уравнениях члена, содержащего lg Т. В других случаях для получения ориентировочных результатов удобнее пользоваться графиками.
Разность получилась отрицательной, следовательно, реакция возможна. Заметим, что линии РbО и СО на рис. 4 пересекаются при температуре около 350° С. Влево от пересечения разность сродства окажется положительной, а восстановление — невозможным; эта точка определяет температуру начала восстановления свинца углеродом при стандартных условиях —(pсо = 101325 Па). Также по пересечению соответствующих линий можно определить температуры начала восстановления других, окислов; для SiO2, Аl2O3, CaO, MgO они выше 1500°C .
Очевидно, можно выбрать условия, при которых одни окислы восстанавливаются до металла, а другие остаются неизменными.
На этом основана, например, выплавка свинца из руд, содержащих окислы железа, кремния, кальция. При свинцовой плавке восстанавливается только свинец, имеющий сравнительно малое сродство к кислороду. Другие окислы сплавляются в жидкий шлак (плотность γ=3000÷3500 кг/м 3 ), всплывающий над свинцом (γРb≈ 10000 кг/м 3 ), подобно тому, как слой масла всплывает над водой.
Очень важна скорость восстановления: металлургические переделы должны быть производительными, а для этого надо, чтобы входящие в них реакции протекали быстро.
Твердые окислы восстанавливаются твердым углеродом медленно из-за малой поверхности контакта реагирующих веществ; даже при тонком измельчении частицы соприкасаются неплотно. К тому же продукт реакции — металл, возникающий в местах контакта, затрудняет дальнейшее взаимодействие. Твердый углерод может быть энергичным восстановителем только, если поверхность его омывается жидким или газообразным окислом. Твердые окислы восстанавливаются преимущественно газообразной окисью углерода:
В расплавах, плохо смачивающих углерод, а такие встречаются часто, частицы его окружены газовой пленкой из СО и СО2. Восстановление здесь происходит также через газовую фазу. Константу равновесия реакций надо записать отношением парциальных давлений СО2 и СО. Давления паров MeO, Me и углерода при их избытке постоянны, они входят в величину K р, поэтому
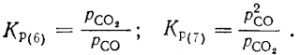
Обе константы равновесия можно выразить процентными соотношениями СО и СО2. Обозначив содержание в процентах СО в смеси через x, а СО2 — через 100— х, найдем
Величины K р зависят от давления и температуры, данные об этом приведены на рис. 5. Показанные здесь окислы могут восстанавливаться, если СО в равновесных газах реакции (7) больше, чем необходимо для реакции (6). Например, при температуре 800° С можно восстановить FeO и Fe3O4. точка а лежит выше а1 и а2, но нельзя получить цинк из его окиси. Точки n и р соот ветствуют началу восстановления FeO при общих давлеяниях смеси СО +СО2 соответственно 20265 и 101325 Па — при температурах около 630 и 680° С. Цинк восстанавливается при всех давлениях близ 930° С, различие, связанное с давлением, и здесь имеется, но оно невелико и неразличимо на графике.
Температуры начала восстановления Fe2О3 и РbО очень малы вследствие малого сродства к кислороду; однако в действительности они выше вычисляемых термодинамически из-за малых скоростей взаимодействия. Термодинамически получаются необходимые, а не достаточные условия восстановления, последние требуют еще и учета кинетики реакций. Например, углерод при обычных температурах практически не окисляется, уголь может лежать на воздухе веками, хотя термодинамический потенциал образования СO2 равен — 393,8 кДж уже при 25° С.
Теплоту, выделяемую реакцией, здесь и далее условимся считать отрицательной; ΔН 0 <0 — термодинамический признак экзотермичности. Заканчивая обсуждение рис. 5, заметим также, что для равновесия реакций восстановления РbО и Fe 2O3 с повышением температуры требуется более высокое содержание СО в газах, а для FeO и ZnO — меньшее.
По принципу Ле-Шаталье, при внешнем воздействии на равновесную систему в ней возникают противодействующие процессы. Если реакция экзотермическая [ΔН<0, уравнения (8) и (10)] при повышении температуры требуется большее содержание восстановителя — СО в газах. Наоборот, реакции восстановления Fe3О4 (9) и ZnO поглощают тепло (ΔН>0); при высоких температурах равновесное парциальное давление СО в газах здесь снижается.
Водород для восстановления окислов применяют реже, он дороже и взрывоопасен, но необходим в тех случаях, когда уг лерод может образовать с металлами иногда нежелательные карбиды, например при восстановлении вольфрама и молибдена:
Восстановителями окислов могут служить непредельные углеводороды, входящие в состав природного газа и нефти.
Многие металлы представлены в природе сульфидами, для оценки возможности восстановления которых по реакции 2MeS + C = Me + CS2
рассмотрим рис. 6, характеризующий сродство элементов к сере В большинстве случаев углерод не пригоден для непосредственного восстановления сульфидов. Также мало пригоден для и водород: линия H2S расположена высоко, что указывает редкую возможность реакций типа:
В металлургической практике природные сульфиды сначала обжигают: нагреванием при доступе воздуха переводят в окислы, которые затем восстанавливают углеродом. Например, сульфид свинца — галенит окисляют при температуре около 1000° С:
Окись свинца восстанавливают углеродом. Также получают из сульфида цинк. Надо отметить, что на рис. линия ZnO имеет излом, соответствующий точке кипения металла при 907° С. Восстанавливаясь при температуре около 930° С, цинк получается в виде паров, которые отводят из печи, охлаждают и конденсируют в виде жидкого или твердого металла (в зависимости от температуры в конденсаторе). Заметим попутно, что подобные изломы прямых на рис. указывают на изменение агрегатного состояния — плавление либо кипение металла или его соединения.
надо записать с учетом парциального давления паров цинка, которые здесь неравновесны с жидким металлом:

Связь между величинами ΔZ 0 и К выражается уравнением изотермы из которого при подстановке R = 8,326 Дж/ (град • моль) и замене натурального логарифма десятичным получим
Похожие страницы:
Восстановление алюминия углеродом Восстановление окиси алюминия углеродом может быть выражено следующим уравнением: Аl2O3 + 3С ⇄ 2Аl + 3СО —.
Что такое реакции восстановления окисления Окисление и восстановление Ионизационные потенциалы Ионное состояние Восстановитель Окислитель Реакции окисления восстановления Окислительно восстановительные реакции Окислительно.
Автоклавное восстановление металлов из растворов водородом и другими газами Восстановлению обязательно должно предшествовать образование водородного электрода, возможное при контакте газа.
Восстановление окислов сульфидами Некоторые металлы восстанавливаются из окислов сульфидами по общим схемам: MeS + 2MeO= 3Ме + SO2, MeS + O2 = Me + SO2. .
Термическое получение магния Сложность и вредность электролитического способа получения магния уже давно вынуждали изыскивать новые способы получения этого металла. Наиболее.
Металлотермия Некоторые окислы не удается превратить в удобные для электролиза легкоплавкие соединения или растворить в расплавах других солей. Вместе с.
Цементация (металла металлом)
Цементация это нанесение слоя металла на метал, путем восстановления его на поверхности с помощью химической реакции.
Примером служит цементация железа медью, подобно электролизу используется очень широко.
Что такое цементация
Цементацией в металлургии цветных металлов называют восстановление одного металла другим из водных растворов, например по реакции:
Подобно электролизу это также окислительно-восстановительный процесс, возникающий, однако, не в результате протекания тока, а самопроизвольно.
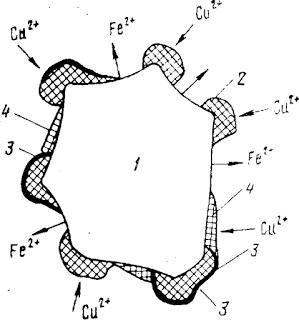
Рис. Схема цементации меди железом: 1 — частицы железа; 2 — участки осаждения меди; 3 — загрязнение поверхности; 4 — распространение осадка меди на свежую поверхность железа.
Реакцию составляют две окислительно-восстановительные системы , образующие гальванический элемент, который при одномолярных активностях имеет электродвижущую силу:
Е0 =0,34— (—0,44) =0,78 В.
По ходу реакции активность (концентрация) меди в растворе убывает, а железа увеличивается и наступает равновесие. Применив выражение , получив

Для любой окислительно-восстановительной реакции, потенциал окислителя индексом ок, а восстановителя — в и заменяя — lgK=pK, получим аналогично:

Константа равновесия реакции цементации меди железом будет
В действительности равновесие не достигается по кинетическим причинам, а остаточная концентрация меди значительно выше.
Схема взаимодействия частицы железа, погруженной в раствор соли меди, показана на рисунке 1.
Как происходит цементация металла
Ионы Сu 2+ начинают разряжаться на наиболее активных участках поверхности, имеющих наибольший запас поверхностной энергии, где предпочтительней происходит адсорбция.
Зародыши, кристаллов растут, разряжая на себя новые ионы и возникает система гальванических элементов, общим анодом которых служит железо, а катодами — кристаллы меди.
Если по какой-либо причине, например в результате окисления или иного загрязнения поверхности, рост кристаллов прекратится, ионы меди найдут новые центры для адсорбции, способные образовать свежие зародыши.
При этом суммарная площадь катодов увеличится, а поверхность железа, способная передавать ионы его в раствор, сократится.
Скорость цементации
Скорость осаждения меди зависит от условий диффузии ее к катодным участкам; однако по мере уменьшения открытой поверхности осадителя она может контролироваться и диффузией Fe 2+ в раствор через проходы и поры между кристаллами.
Чем мельче осадитель и больше его суммарная поверхность, тем быстрее и полнее цементация. Последнюю часто удается ускорить искусственной сдиркой осадка частиц осадителя, например в шаровых мельницах или иным способом.
Из опыта известно, что однозарядные катионы и особенно Н + ускоряют цементацию. Теоретического объяснения этому пока нет.
Статья на тему Цементация
Цементация золота и серебра цинком Разные исследователи неоднократно пытались выделять золото и серебро из цианистых растворов алюминием, сорбцией на активированном.
Осаждение меди цементацией Осадителем служат железная стружка, обрезки проволоки и жесть из старых консервных банок, с которой оловянное покрытие предварительно.
Содержание статьи1 ЧТО ТАКОЕ ФОСФАТИРОВАНИЕ1.1 Фосфатирование металла 1.2 Толщина фосфатных пленок ЧТО ТАКОЕ ФОСФАТИРОВАНИЕ Это создание на поверхности металлических изделий.
Электрохимическое растворение золота До сих пор процесс растворения благородных металлов в цианистых растворах рассматривался нами как чисто химический, при котором.
Скорость выщелачивания меди Скорость выщелачивания — второе условие выгодности гидрометаллургии. Некоторые термодинамически возможные реакции протекают в водных растворах весьма медленно.
Электролиз меди с нерастворимыми анодами Для этого процесса пригодны растворы сульфата меди, получаемые разными способами, однако содержащие не менее 30.
4.2.1. Понятие о металлургии: общие способы получения металлов.
Металлургия — это комплексная отрасль промышленности, которая занимается производством металлов.
Поскольку большинство металлов в природе существует в виде различных соединений, то химическая суть металлургических процессов заключается в восстановлении металлов:
В зависимости от того, какой используется восстановитель и каковы условия, при которых проводят процессы восстановления различают пиро-, гидро-, электро- и биометаллургию.
Пирометаллургия (от греч. огонь и металлургия) представляет собой все химические способы восстановления металлов из руд, осуществляемые с применением высоких температур.
В качестве восстановителей в пирометаллургии используют уголь (кокс), оксид углерода (II), водород, активные металлы, кремний.
Оксидные руды чаще всего восстанавливают коксом или оксидом углерода (II) — этот процесс носит название карботермия:
Для извлечения металлов пирометаллургическим способом из сульфидных руд их сначала подвергают предварительному отжигу:
А затем, полученный оксид восстанавливают коксом:
Тугоплавкие металлы, например, молибден и вольфрам, восстанавливают водородом:
Если восстановителями химически активные металлы, то этот пирометаллургический способ называют металлотермия. В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием. Способ металлотермии позволяет восстанавливать металлы не только из оксидов, но и с галогенидов:
Известен способ восстановления металлов кремнием, называемый силикотермией:
Гидрометаллургия представляет собой метод получения металлов, заклющийся в преобразовании природных соединений металлов в растворимую форму с последующим восстановлением металла из раствора. О возможности применения гидрометаллургических процессов для извлечения металлов еще в 1763 г.. Говорил М. В. Ломоносов. Гидрометаллургического способами добывают благородные (золото, серебро, платину), цветные (медь, никель, цинк, кобальт), редкие (цирконий, гафний, тантал) и другие металлы:
К преимуществам данного способа относится возможность его использования для получения металлов при их малом содержании в руде, которую невозможно перерабатывать обычными способами; снижение во многих случаях загрязнения окружающей среды, например, при обжиге сульфидных руд.
Электрометаллургия — это способ получения металлов с применением электрического тока — электролиза. Электролизом расплавов получают самые активные металлы (от лития до марганца в ряду активности), электролизом водных растворов — менее активные (Zn, Cu, Ni, Cr и т.д.).
Биометалургия основана на биохимических процессах, протекающих при использовании микроорганизмов. Известно, что микроорганизмы типа литотрофы (с лат. – «поедающие камни») могут преобразовывать нерастворимые сульфиды металлов в растворимые сульфаты. Сейчас с применением микроорганизмов добывают медь (в США данный метод достигает 10% от общего ее производства), уран, рений, серебро, никель, свинец, а также некоторые редкие металлы.
Читайте также:
