Металл проявляющий переменную степень окисления в соединениях алюминий
Обновлено: 28.04.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Контрольная работа по теме «Металлы» 11 класс
А. Тестовые задания с выбором ответа
1 . s-Элементу 4-го периода Периодиче ской системы соответствует электронная формула:
а. ls 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 . Б. 1s 2 2s 2 2p 6 3s 2 3p 6 3d4
в. ls 2 2s 2 2p 6 3s 2 3p 6 4s 1 .
Г. ls 2 2s 2 2p 6 3s 1 .
2. Электронная формула иона Na + :
A. ls 2 2s 2 2p 6 3s 2 . В. ls 2 2s 2 2p 6 .
Б. ls 2 2s 2 2p 6 3 s 1 . Г. ls 2 2s 2 2p 5 .
3. Переменную степень окисления в
соединениях проявляет:
А. Барий. В. Медь.
Б. Кальций. Г. Цезий.
4. Простое вещество — железо — мо жет являться:
A. Только восстановителем.
Б. Только окислителем.
B. И окислителем, и восстановителем.
5. Схема превращений
представляет собой процессы:
A. Только восстановления.
Б. Только окисления.
Г.Восстановления (переход 1), окисления (переход 2).
6. Восстановительные свойства в ряду химических элементов
A.Изменяются периодически.
Б. Не изменяются.
7 Формула вещества X в уравнении реакции
Си + 2Н 2 в0 4(конц = CuS0 4 + X + 2Н 2 0:
А. Н 2 . Б. S0 2 . В. H 2 S. Г. S0 3 .
8 Формулы продуктов электролиза расплава бромида натрия на инертных элект родах:
A. Na, Н 2 . В. NaOH, Вг 2 , Н 2 .
Б. Na, Вг 2 . Г. NaOH, Н 2 .
9 Цинк взаимодействует с каждым ве ществом группы:
A. Водород, сульфат меди (II) (р-р), метаналь.
Б. Кислород, муравьиная кислота, сера.
B. Оксид углерода (IV), оксид кальция, фенол(расплав).
Г. Глюкоза, этанол, хлор.
10 Основные свойства гидроксидов усиливаются в ряду:
A.КОН—NaOH—Ве(ОН) 2 —LiOH. Б. Ве(ОН) 2 —LiOH—NaOH—КОН.
B.LiOH—Be(OH) 2 -NaOH—КОН.
Г. КОН—NaOH—Ве(ОН) 2 —LiOH.
ЧАСТЬ Б. Задания со свободным ответом
11 Составьте формулы высшего окси да и гидроксида элемента, в ядре которого со держится 56 протонов.
Назовите эти вещества, укажите их характер.
12 Составьте уравнения реакций сле дующих превращений:
А1--А1 2 0 3 -- А1С1 3 -> A1(N0 3 ) 3 -- А1(ОН) 3 .
- Дополните фразу: «В периоде с уменьшением заряда ядра атома от галогена к щелочному металлу радиус атомов . ».
- Сравните число атомов в 32 г меди и 12 г магния.
- Рассчитайте объем (н. у.), количе ство вещества и массу газа, полученного при взаимодействии 3,5 г лития с водой, взятой в избытке.
Контрольная работа по теме «Металлы»
ЧАСТЬ А. Тестовые задания с выбором ответа
1 d-Элементу 4-го периода Периодиче ской системы соответствует электронная фор мула:
A.ls 2 28 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
Б. ls 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2 .
B.ls 2 2s 2 2p 6 3s 2 3p 6 4s 2
Г. ls 2 2s 2 2p 6 3s 2 3p 2 .
2 . Электронная формула иона А1 3+ :
A. ls 2 2s 2 2р e 3s 2 3p 3 .
Б. 1s 2 2s 2 2p e 3s 2 3p 0
B.ls 2 2s 2 2p 6 3s 1 .
Г. ls 2 2s 2 2p 6 .
3 Переменную степень окисления в соединениях проявляет:
А. Алюминий. В. Железо.
Б. Барий. Г. Рубидий.
4 Простое вещество— медь — может являться:
A.Только восстановителем.
Б. Только окислителем.
B.И окислителем, и восстановителем.
5 Схема превращений
A.Только восстановления.
Б. Только окисления.
B.Окисления (переход 1), восстановления (переход 2).
Г. Восстановления (переход 1), окисления (пе реход 2).
6 Восстановительные свойства в ряду химических элементов
A. Изменяются периодически.
Б. Не изменяются.
B. Ослабевают.
Г. Усиливаются.
Ag + 2HN0 3(KOHц) = AgN0 3 + X + Н 2 0:
А. Н 2 . Б. N0 2 . В. N 2 . Г. N 2 0.
8 Формулы продуктов электролиза раствора хлорида меди (И) на инертных элект родах:
А. Си, Н 2 . В. Си, О 2 .
Б. Си, С1 2 . Г. Си(ОН) 2 , Н 2 .
9 Магний взаимодействует с каждым веществом группы:
A. Гидроксид натрия, водород, кислород.
Б. Вода, уксусная кислота, хлор.
B. Оксид меди (И), этанол, фенол (расплав).
Г. Вода, серная кислота (раствор) гидроксид калия.
10 Основные свойства гидроксидов уси ливаются в ряду:
A. Sr(OH) 2 -Ca(OH) 2 -Mg(OH) 2 -Al(OH) 3 .
Б. Mg(OH) 2 -Al(OH) 3 -Sr(OH) 2 -Ca(OH) 2 .
B. Ca(OH) 2 -Al(OH) 3 -Mg(OH) 2 -Sr(OH) 2 .
Г. Al(OH) 3 -Mg(OH) 2 -Ca(OH) 2 -Sr(OH) 2 .
11Составьте формулы высшего окси да и гидроксида элемента, в ядре которого со держится 4 протона. Назовите эти вещества, укажите их характер.
12Составьте уравнения реакций сле-
дующих превращений:
Fe(OH) 2 --- Fe(OH) 3----- Fe 2 0 3 ---- Fe ---> FeCl 3 .
- Дополните фразу: «В главной под группе с увеличением заряда ядра радиус ато мов . ».
- Сравните число атомов в 130 г цин ка и 120 г железа.
- Рассчитайте объем (и. у.), количе ство вещества и массу газа, полученного при взаимодействии 10 г кальция с водой, взятой в избытке.
1 р-Элементу 4-го периода Периодиче ской системы соответствует электронная фор мула:
A.ls 2 2s 2 2р 6 3s 2 3р 6 3d 10 4s 2 4p 2 .
Б. Is 2 2s 2 2p 6 3s 2 3p 6 3d4s 2
B.ls 2 2s 2 2p 6 3s 2 3p 6 4s 2
Г. ls 2 2s 2 2p 6 3s 2 3p 1 .
2 Электронная формула иона Mg 2+ :
A. ls 2 2s 2 2p 6 3s 2 . В. ls 2 2s 2 2p 6 .
Б. ls 2 2s 2 2p 6 3s 1 . Г. ls 2 2s 2 2p 5 .
А. Барий. В.Стронций.
Б. Рубидий. Г. Хром.
4 Катионы меди Си + могут являться:
B. Окисления (переход 1), восстановления (переход 2).
Hg + 2H 2 S0 4(KOH4> - HgS0 4 + X + 2Н 2 0: А. Н 2 . Б. S0 2 . В. H 2 S. Г. S0 3 .
8 Формулы продуктов электролиза расплава иодида натрия на инертных электродах:
A. Na, Н 2 . В. Na, I 2 .
Б. NaOH, I 2 . Г. NaOH, Н 2 .
9 Натрий взаимодействует с каждым веществом группы:
A. Бензол, вода, уксусная кислота.
Б. Бензол, водород, фенол (расплав).
B. Вода, уксусная кислота, фенол (расплав).
Г. Вода, углекислый газ, этанол.
10 Основные свойства гидроксидов ос-
лабевают в ряду:
A.КОН—Са(ОН) 2 —Mg(OH) 2 Ве(ОН) 2 .
Б. KOH-Be(OH) 2 -Ca(OH) 2 -Mg(OH) 2 .
B.Be(OH) 2 -Mg(OH) 2 -Ca(OH) 2 -KOH.
Г. Mg(OH) 2 -Ca(OH) 2 -KOH-Be(OH) 2 .
- Составьте формулы высшего окси да и гидроксида элемента, в ядре которого со держится 37 протонов. Назовите эти вещества, укажите их характер.
- Составьте уравнения реакций сле дующих превращений:
Си -- Cu(N0 3 ) 2 ------ Си(ОН) 2 ----СиО ----Си.
- Дополните фразу: «В периоде с уве личением заряда ядра атома от щелочного ме талла к галогену радиус атомов . ».
- Сравните число атомов в 27 г сереб ра и алюминиевой проволоке такой же массы.
15 Рассчитайте объем (н. у.), количество вещества и массу газа, полученного при
взаимодействии 46 г натрия с водой, взятой
в избытке.
Контрольная работа «Металлы»

4. вещества, взаимодействие которых сопровождается образованием газа.
1. алюминий и гидроксид натрия 2. Хлорид аммония и нитрат серебра 3. Серная кислота(р-р) и медь 4. Аммиак и соляная кислота
5. вещества, вступающие в реакцию при комнатной температуре
1. ртуть и сера 2. Железо и вода 3. Магний и сера 4. Медь и кислород
6. железо взаимодействует с каждым из двух веществ
1. соляная кислота и хлор 2. Хлорид лития и гидроксид калия
3. серная кислота и оксид алюминия 4. Сульфат меди и карбонат кальция
7. вещества взаимодействие которых не сопровождается образованием водорода
1. Сu u H2SO4 2. Al u NaOH 3. Ca u H2O 4. NaH u H2O
8. верны ли следующие суждения о свойствах металлов
А. железо способно вытеснять водород из растворов соляной и азотной кислот
Б. при сгорании натрия и калия на воздухе образуются пероксиды металлов
1. верно только А 2. Верно только Б
3. верны оба суждения 4. Неверны оба суждения
9. формула вещества Х в цепочке превращений
1 вариант
10. массовая доля железа наибольшая в соединении (показать решение)
Часть Б. задания с выбором нескольких вариантов ответа и на соответствие
11. вещества, способные восстанавливать медь из ее оксида
1. оксид углерода (IV) 2.Углерод 3. Сера 4. Водород 5. Соляная кислота
12. установите соответствие между исходными веществами и продуктами реакции
Исходные вещества продукты реакции
Fe u HCl 2. FeCl2
Часть В. Задания с развернутым ответом
13. составьте уравнения реакций с водой для калия, железа. Укажите условия прохождения реакций.
14. к раствору сульфата металла со степенью окисления +3 добавили небольшое количество гидроксида калия. Образовавшийся белый студенистый осадок разделили на две части. В одну пробирку прилили соляную кислоту. Во вторую раствор гидроксида калия. В обеих пробирках осадок растворился. Определите исходное вещество и запишите уравнения реакций.
Вариант
10 Массовая доля меди наибольшая в соединении
11. химический элемент в атоме которого распределение электронов по слоям 2е8е2е
1. имеет ярко выраженные металлические свойства
2. проявляет в соединениях только отрицательную степень окисления
3. с неметаллами образует соединения с ковалентной связью
4. образует летучее водородное соединение
13. составьте уравнения реакций магния с азотной кислотой, если известно, что одним из продуктов реакции является оксид азота (II)
Расставьте коэффициенты методом электронного баланса
14. металлическую пластинку красного цвета прокалили. Полученное вещество черного цвета разделили на две части. Одна часть при нагревании в токе водорода превратилась в исходный металл . а растворение другой части в серной кислоте сопровождалось образованием голубого раствора. Определите неизвестный металл и запишите уравнения химических реакций.
Таблица окисления химических элементов

Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название
Символ
Степень окисления
-3, -2, -1, 0, +1, +2, +3, +4, +5
+2, +3, редко +4 и +6
-1, +1, +5, редко +3, +4
+3, +6, редко +2, +3, +5
+6, редко +2, +3, +4, +5
+3, +4, +6, +8, редко +2
+3, +4, +6, редко +1, +2
+2, +4, +6, редко +1, +3
+3, редко +3, +2, +4, +5
Или использовать на уроках этот вариант таблицы.

Рис. 2. Таблица степеней окисления.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
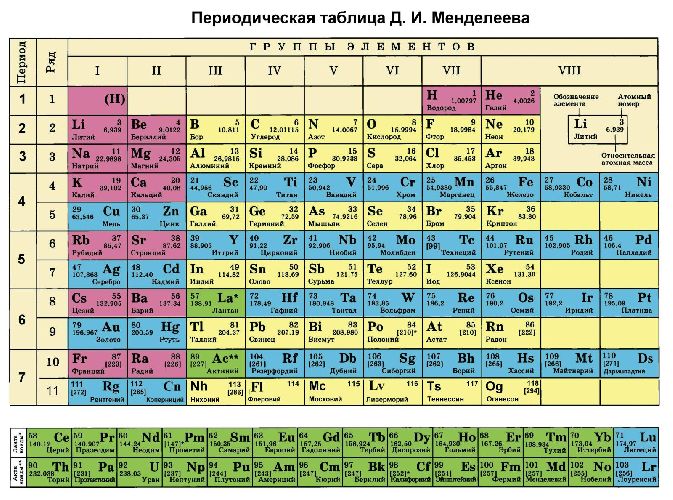
Рис. 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Степень окисления – условная величина, использующаяся для записи окислительно-восстановительных реакций. Для определения степени окисления используется таблица окисления химических элементов.
Значение
Степень окисления основных химических элементов основана на их электроотрицательности. Значение равно числу смещённых в соединениях электронов.
Степень окисления считается положительной, если электроны смещаются от атома, т.е. элемент отдаёт электроны в соединении и является восстановителем. К таким элементам относятся металлы, их степень окисления всегда положительная.
При смещении электрона к атому значение считается отрицательным, а элемент – окислителем. Атом принимает электроны до завершения внешнего энергетического уровня. Окислителями является большинство неметаллов.
Простые вещества, не вступающие в реакцию, всегда имеют нулевую степень окисления.
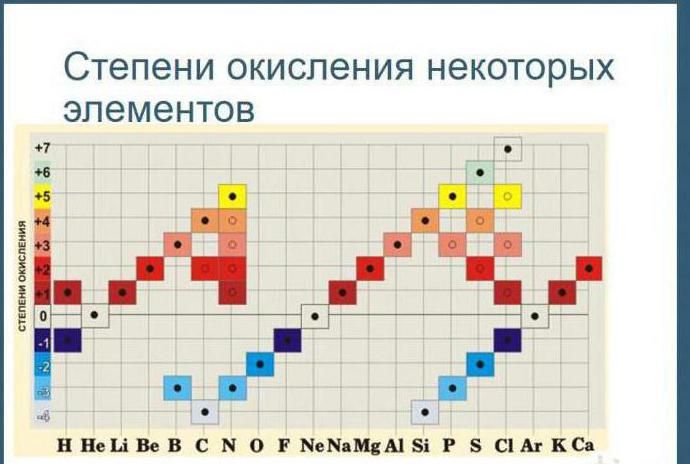
Рис. 1. Таблица степеней окисления.
В соединении положительную степень окисления имеет атом неметалла с меньшей электроотрицательностью.
Определение
Определить максимальную и минимальную степень окисления (сколько электронов может отдавать и принимать атом) можно по периодической таблице Менделеева.
Максимальная степень равна номеру группы, в которой находится элемент, или количеству валентных электронов. Минимальное значение определяется по формуле:
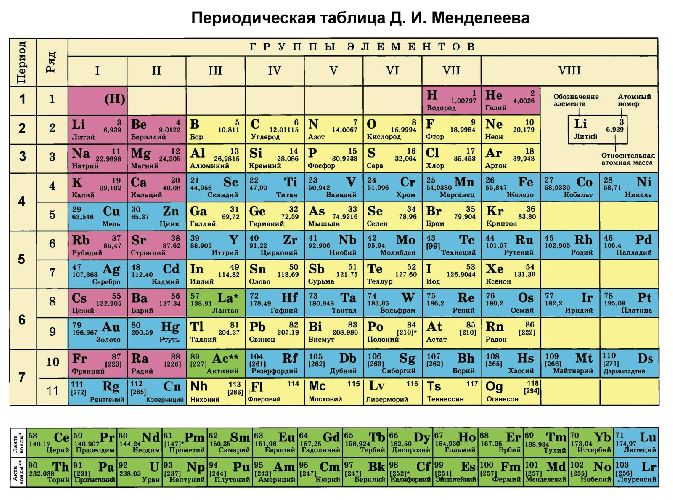
Рис. 2. Таблица Менделеева.
Углерод находится в четвёртой группе, следовательно, его высшая степень окисления +4, а низшая – -4. Максимальная степень окисления серы +6, минимальная – -2. Большинство неметаллов всегда имеет переменную – положительную и отрицательную – степень окисления. Исключением является фтор. Его степень окисления всегда равна -1.
Следует помнить, что к щелочным и щелочноземельным металлам I и II групп соответственно, это правило не применимо. Эти металлы имеют постоянную положительную степень окисления – литий Li +1 , натрий Na +1 , калий K +1 , бериллий Be +2 , магний Mg +2 , кальций Ca +2 , стронций Sr +2 , барий Ba +2 . Остальные металлы могут проявлять разную степень окисления. Исключением является алюминий. Несмотря на нахождение в III группе, его степень окисления всегда +3.

Рис. 3. Щелочные и щелочноземельные металлы.
Из VIII группы высшую степень окисления +8 могут проявлять только рутений и осмий. Находящиеся в I группе золото и медь проявляют степень окисления +3 и +2 соответственно.
Запись
Чтобы правильно записывать степень окисления, следует помнить о нескольких правилах:
- инертные газы не вступают в реакции, поэтому их степень окисления всегда равна нулю;
- в соединениях переменная степень окисления зависит от переменной валентности и взаимодействия с другими элементами;
- водород в соединениях с металлами проявляет отрицательную степень окисления – Ca +2 H2 −1 , Na +1 H −1 ;
- кислород всегда имеет степень окисления -2, кроме фторида кислорода и пероксида – O +2 F2 −1 , H2 +1 O2 −1 .
Степень окисления – условная величина, показывающая, сколько электронов принял или отдал атом элемента в соединении. Величина зависит от количества валентных электронов. Металлы в соединениях всегда имеют положительную степень окисления, т.е. являются восстановителями. Для щелочных и щелочноземельных металлов степень окисления всегда одинаковая. Неметаллы, кроме фтора, могут принимать положительную и отрицательную степень окисления.
Контрольная работа по теме "Металлы"
тест по химии (9 класс) на тему
1 (3 балла). Число электронов на внешнем электронном уровне атома металла главной подгруппы Периодической системы может быть равно:
А. 1. Б. 2. В. 3. Г. Все ответы верны.
2 (3 балла). Электронная формула иона А1 3+ :
A. ls 2 2s 2 2p 6 3s 2 3p 6 . B. ls 2 2s 2 2p 6 3s 2 3p 1
Б. ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 4p 1 . Г. ls 2 2s 2 2p 6
3 (3 балла). Самый тугоплавкий металл:
А. Алюминий. Б. Магний. В. Вольфрам. Г. Свинец.
4 (3 балла). Постоянную степень окисления в соединениях проявляет:
А. Железо. Б. Хром. В. Медь. Г. Натрий.
5 (3 балла). Амфотерный оксид образуется при сгорании в кислороде:
А. Алюминия. В. Кремния.
Б. Кальция. Г. Натрия.
6 (3 балла). Железо взаимодействует с каждым из веществ, формулы которых:
А. НС1, SO 2 , Н 2 O. В. NaOH, Н 3 РO 4 , Вr 2 .
Б. O 2 , Cl 2 , HNO 3(pa36) . Г. СuО, А1С1 3 , O 2 .
7 (3 балла). Формула вещества X в цепочке превращений
А. СаСO 3 . Б. Са(ОН) 2 . В. Ca(NO 3 ) 2 . Г. CaSO 4 .
8 (3 балла). Реактив для распознавания катионов Fe 3+ :
А. Нитрат серебра. Б. Серная кислота. В. Роданид калия. Г. Хлорид бария.
9 (3 балла). Самый пластичный металл:
А. Алюминий. В. Литий.
Б. Золото. Г. Серебро.
10 (3 балла). Металл, проявляющий в соединениях переменную степень окисления:
А. Калий. Б. Хром. В. Цинк. Г. Магний.
Задание 2. Осуществить цепочку превращений:
Ca → CaO → Ca(OH) 2 → Ca(NO 3 ) 2 → Ca 3 (PO 4 ) 2
Задание 3. При растворение цинка в соляной кислоте выделилось 13,44л(н.у) газа. Определите массу прореагировавшего цинка. Определите массу образовавшейся соли.
1 (3 балла). Металл, проявляющий в соединениях переменную степень окисления:
2 (3 балла). Металл, который пассивируется концентрированной серной кислотой:
А. Магний. В. Медь.
Б. Железо. Г. Цинк.
3 (3 балла). Ряд формул веществ, каждое из которых взаимодействует с цинком:
А. НС1, SO 2 , Н 2 O. В. NaOH, Н 3 РO 4 , Вг 2 .
Б. O 2 , NaCl, HNO 3(paзб) . Г. H 2 SO 4 , SO 2 , O 2 .
4 (3 балла). Переход, который нельзя осуществить в одну стадию:
A. Железо→ хлорид железа (III).
Б. Медь→ нитрат меди (II).
B. Натрий→ гидроксид натрия.
Г. Магний→ гидроксид магния.
5 (3 балла). Металл, реагирующий с соляной кислотой при обычных условиях:
А. Алюминий. Б. Серебро. В. Медь. Г. Ртуть.
6 (3 балла). Вещество, взаимодействие которого с магнием отображается сокращенным ионным уравнением Mg° + 2Н + = Mg 2+ + Н 2 0 :
А. Серная кислота. В. Кремниевая кислота.
Б. Вода. Г. Азотная кислота.
7 (3 балла). Число электронов на внешнем электронном уровне атома металла главной подгруппы Периодической системы может быть равно:
8 (3 балла). Электронная формула иона А1 3+ :
9 (3 балла). Самый тугоплавкий металл:
10 (3 балла). Постоянную степень окисления в соединениях проявляет:
Fe → FeCl 3 → Fe(OH) 3 → Fe 2 O 3 → FeO
Задание 3. Кусочек кальция поместили в избыток воды, при этом выделилось 5,6 л(н.у) газа. Определите массу прореагировавшего кальция. Определите массу образовавшегося осадка.
1 (3 балла). Металл, реагирующий с соляной кислотой при обычных условиях:
2 (3 балла). Вещество, взаимодействие которого с магнием отображается сокращенным ионным уравнением Mg° + 2Н + = Mg 2+ + Н 2 0 :
3 (3 балла). Число электронов на внешнем электронном уровне атома металла главной подгруппы Периодической системы может быть равно:
4 (3 балла). Электронная формула иона А1 3+ :
5 (3 балла). Самый тугоплавкий металл:
6 (3 балла). Постоянную степень окисления в соединениях проявляет:
7 (3 балла). Ряд формул веществ, каждое из которых взаимодействует с цинком:
А. НС1, SO 2 , Н 2 O. В. NaOH, Н 3 РO 4 , Вг 2 .
8 (3 балла). Переход, который нельзя осуществить в одну стадию:
9 (3 балла). Металл, реагирующий с соляной кислотой при обычных условиях:
10 (3 балла). Вещество, взаимодействие которого с магнием отображается сокращенным ионным уравнением Mg° + 2Н + = Mg 2+ + Н 2 0 :
Al → Al 2 O 3 → AlCl 3 → Al(OH) 3 → Na 3 AlO 3
Задание 3. Горение натрия на воздухе идет до пероксида натрия. Определить массу пероксида натрия образующегося при горение 2,3 г натрия. Определите объем кислорода который потребуется для сгорания 0,35 моль натрия.
4 (3 балла). Амфотерный оксид образуется при сгорании в кислороде:
5 (3 балла). Железо взаимодействует с каждым из веществ, формулы которых:
6 (3 балла). Формула вещества X в цепочке превращений
Fe → FeCl 2 → Fe(NO 3 ) 2 → Fe(OH) 2 → FeO
Задание 3. Кусочек натрия массой 9,2 г поместили в избыток воды. Определите массу образовавшегося гидроскида натрия. Определите объем выделившегося газа.
По теме: методические разработки, презентации и конспекты

Контрольная работа по природоведению 5 класс; контрольная работа по географии 6 класс "Гидросфера"
Контрольные работы составлены с учётом материалов учебников "Природоведение 5 класс" авторы: Т.С. Сухова, В.И.Строганов и "Землеведение 6 класс" авторы :В.П.Дронов,Л.Е.Савельева.Данные работы ап.
Комплексные числа.Контрольная работа №1 и контрольная работа №2
Контрольная работа №1 и №2 по теме " Комплексные числа" на курсах "Учитель профильной школы".

Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции растениеводства МДК. 04.03Организация малого бизнеса для студентов заочной формы обучения Специальность
Методические указания и контрольные задания для домашней контрольной работы поПМ 04. Управление работами по производству и переработке продукции растениеводства МДК. 04.03Организация малого.
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции растениеводства МДК.04.02. Учет и анализ хозяйственной деятельности для студентов заочной формы обучения
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции растениеводстваМДК.04.02. Учет и анализ хо.
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции животноводства МДК.04.01. Управление структурным подразделением организации для студентов заочной формы
Методические указания и контрольные задания для домашней контрольной работы по ПМ 04. Управление работами по производству и переработке продукции животноводства МДК.04.01. Управление .

Контрольная работа по русскому языку по теме "Наречие" 7 класс, контрольная работа по русскому языку по теме "Частицы" 7 класс
Контрольная работа по теме "Наречие", контрольная работа по теме "Частицы".
Читайте также:
