Металл восстанавливается при электролизе раствора
Обновлено: 21.09.2024
В § 45 вы познакомились с электрохимическим методом промышленного получения металлов, который основан на электролизе, — электрометаллургией.
У этого метода есть две разновидности. Первая — это проведение электролиза расплава соединений металлов. Особенности этого способа вы рассмотрели на примере электролиза расплава хлорида магния.
Вторая разновидность электрохимического метода, называемая гидроэлектрометаллургией, основана на электролизе водных растворов солей металлов. Преимущество этого метода, по сравнению с электролизом расплавов, заключается в том, что он не требует энергетических затрат на расплавление вещества. Ограничение электролитического метода извлечения металлов из водных растворов состоит в том, что он пригоден лишь для металлов, стоящих в ряду активности металлов правее алюминия.
Особенность проведения электролиза водных растворов солей заключается в том, что наряду с процессами восстановления ионов металла на катоде и окисления анионов соли на аноде протекает конкурирующий процесс электролиза молекул воды. В результате на катоде может выделяться водород, а на аноде — кислород.
Процессы на катоде:
2Н + + 2е – = Н2↑ при рН < 7;
Процессы на аноде:
2Н2О – 4е – = О2↑ + 4Н + при рН ≤ 7;
4ОН – – 4е – = О2↑ + 2Н2О при рН > 7.
Процессы на катоде
Способность металлов восстанавливаться на катоде при электролизе водного раствора солей определяется положением металла в ряду активности.
Катионы металлов в левой части ряда активности, заканчивая алюминием (Li + , Na + , K + , . Аl 3+ ), при электролизе не восстанавливаются. Вместо них восстанавливается водород из молекул воды:
Катионы металлов, расположенных в ряду активности правее водорода (Cu 2+ , Ag + , Hg 2+ , Pt 2+ , Au 3+ ), при электролизе восстанавливаются на катоде до металла:
Cu 2+ + 2е – = Cu 0 ;
Au 3+ + 3е – = Au 0 .
Этот процесс доминирует, но если электролит имеет сильно кислую среду, то одновременно с ионами металла могут восстанавливаться ионы водорода:
Катионы металлов, расположенных в ряду активности между алюминием и водородом (Mn 2+ , Zn 2+ , Сr 3+ , Fe 2+ , . Pb), при электролизе восстанавливаются на катоде одновременно с водородом из воды:
Ni 2+ + 2e – = Ni 0 ;
При электролизе водных растворов солей металлов следует учитывать возможность протекания процессов гидролиза, который ускоряется в результате образования гидроксид-ионов в электролите вблизи катода. В результате на поверхности катода могут образовываться нерастворимые основные соли и основания:
Электропроводность электрода уменьшается, и процесс электролиза замедляется или прекращается. Один из способов борьбы с таким явлением — подкисление электролитов.
Процессы на аноде
На аноде протекают процессы окисления компонентов электролита. В процессе окисления может участвовать и материал самого анода. Различают процессы электролиза в растворах с активным и инертным анодами.
Инертные аноды не окисляются под действием электрического тока и не реагируют с веществами раствора. При электролизе они служат лишь передатчиками электронов. Инертными являются электроды из графита, платины, платинированного титана.
К активным относятся аноды, изготовленные из Сu, Ag, Fe, Ni, Sn, Zn. Металл активных анодов в процессе электролиза разрушается и переходит в раствор в виде ионов. Активные аноды обычно применяют в промышленности при получении покрытий путём электрохимического восстановления металлов из растворов, поскольку растворение металлического анода в процессе электролиза восполняет убыль ионов восстанавливаемого металла из электролита. При этом они обеспечивают постоянство состава раствора, скорости процесса электролиза, состава и свойств получаемых металлических покрытий.
Рассмотрим подробнее процессы, протекающие при электролизе растворов на инертных анодах. Можно выделить следующие закономерности (табл. 31.1):
• в растворах бескислородных кислот и их солей (кроме HF и фторидов) на аноде окисляются анионы, например:
• в растворах кислородсодержащих кислот и их солей в случае максимальной степени окисления атомов неметалла в анионе ( , ) окисляются атомы кислорода в молекулах воды с выделением газообразного кислорода:
• в растворах кислородсодержащих кислот и их солей, в анионах которых содержатся атомы неметалла в промежуточной степени окисления ( , ), окисляются именно эти атомы в составе анионов, например:
Таблица 31.1. Способность к окислению на аноде анионов при электролизе водных растворов солей
В водном растворе не окисляются; окислению подвергаются молекулы воды с выделением кислорода:
В водном растворе легко окисляются, например:
В специально созданных условиях в водных растворах может идти процесс окисления и кислородсодержащих анионов с максимальной степенью окисления неметалла. Например, электролизом концентрированного раствора гидросульфата калия получают сильный окислитель — пероксодисульфат калия:
Примеры использования электролиза водных растворов солей металлов в промышленности и в лаборатории
При разработке условий электролиза следует учитывать, что продукты электролиза могут вступать в химические реакции с электродами и водными растворами или между собой.
Промышленный электролиз водного раствора NaCl. Процесс используют для получения водорода, хлора и каустической соды (NaOH). При этом на катоде выделяется водород:
а в растворе накапливается каустическая сода:
Если не разделить продукты электролиза, то между образовавшимися газами произойдёт химическая реакция.
В растворе также возможно взаимодействие хлора со щёлочью:
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Для того чтобы между продуктами электролиза не происходило взаимодействие, катодное и анодное пространство разделяют мембраной (рис. 108.2).
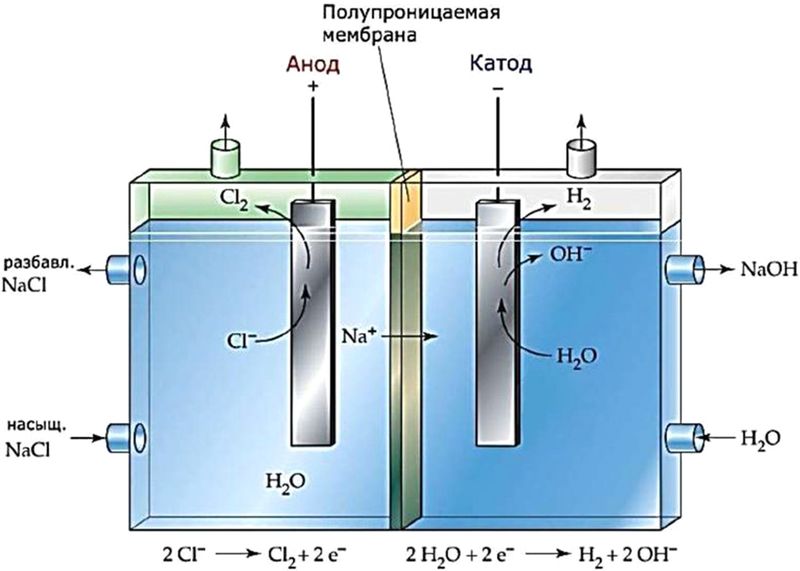
Рис. 108.2. Схема электролизёра с ионообменной мембраной для электролиза раствора хлорида натрия. Мембрана пропускает ионы Na + , но не пропускает ионы Cl – и OH –
С 2015 года в ОАО «Беларуськалий» функционирует цех мембранного электролиза. Продукцией цеха являются: водный раствор гидроксида калия (с массовой долей KOH 46−54 % ); твёрдый гидроксид калия (с массовой долей KOH 9 0−95 % ); соляная кислота (с массовой долей HCl 28−35 % ); гипохлорит натрия NaClO.
Электролиз растворов солей в лаборатории.
Для наглядности при рассмотрении особенностей электролиза водных растворов солей обратимся к химическому эксперименту.
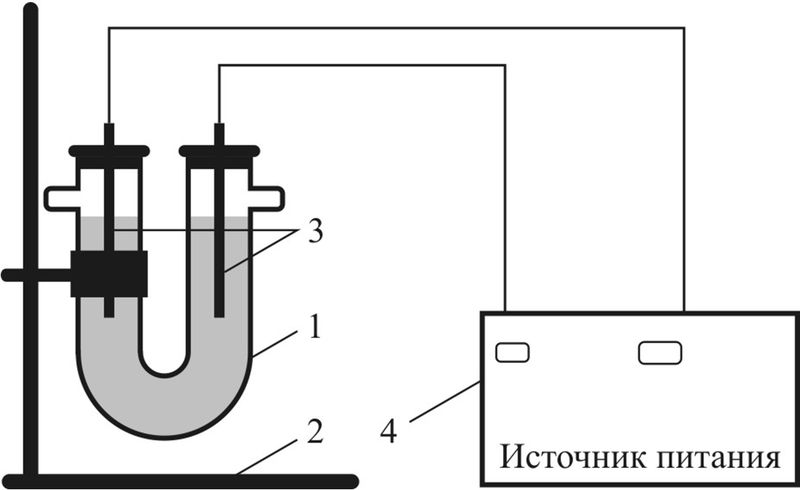
Рис. 108.3. Схема прибора для электролиза:
1 — U-образная трубка (электролизёр);
2 — штатив;
3 — электроды (графитовые стержни);
4 — источник питания постоянного тока
Опыт 1. Проведём электролиз водного раствора CuSO4. Для этого соберём прибор по схеме, представленной на рис. 108.3. В U-образную трубку нальём раствор сульфата меди(II) и опустим два графитовых стержня, закреплённых в резиновых пробках. Стержни с помощью проводов присоединим к источнику тока, на котором поддерживается напряжение постоянного тока до 12 В.
Рис. 108.4. Осаждённая медь на графитовом электроде после проведения электролиза раствора сульфата меди(II)
При пропускании электрического тока через раствор CuSO4 на стержне, присоединённом к положительному полюсу источника тока (анод), можно наблюдать выделение пузырьков газа (это кислород), а на стержне, присоединённом к отрицательному полюсу (катод), — появление красного налёта (это восстановленная медь) (рис. 108.4).
Объяснить наблюдаемое явление можно следующими процессами.
В растворе сульфата меди происходит диссоциация:
При подключении электродов к источнику тока в растворе электролита происходит направленное движение ионов к электродам, имеющим противоположные заряды.
На катоде происходит восстановление меди, которая образует красный налёт на электроде:
Сu 2+ + 2e – = Сu 0
На аноде (положительно заряженном электроде) происходит окисление молекул воды с выделением кислорода:
Суммарное уравнение процессов на электродах в молекулярной форме:
Опыт 2. Проведите электролиз водного раствора йодида калия.
Для проведения электролиза раствора KI воспользуемся установкой из примера 1 (рис. 108.3).
В U-образную трубку нальём раствор KI и пропустим через него электрический ток. Через 3–5 минут, отключив ток и достав электроды, в катодное пространство добавим 2−3 капли фенолфталеина, а в анодное пространство прильём крахмальный клейстер.

Рис. 108.5. Электролизёр после проведения электролиза раствора йодида калия и добавления раствора фенолфталеина (катодное пространство) и крахмального клейстера (анодное пространство)
Раствор в катодном пространстве окрашивается в малиновый цвет, что свидетельствует о щелочной среде. В анодном пространстве наблюдается выделение жёлто-бурого вещества, при добавлении к которому 2–3 капель крахмального клейстера происходит посинение раствора, что указывает на присутствие в растворе йода (рис. 108.5).
Таким образом, продуктами электролиза водного раствора йодида калия являются I2 и щёлочь.
Наблюдаемые явления свидетельствуют о протекании на электродах следующих реакций:
2Н2О + 2e – = Н2↑ + 2ОН – на катоде;
2I – – 2e – = I2 на аноде.
Суммарное уравнение процесса электролиза в молекулярной форме:
Электролиз с активными анодами в промышленности. Помимо электрохимического осаждения металлических покрытий и получения порошков металлов, этот метод применяют для извлечения металлов из растворов, а также для очистки (рафинирования) металлов от содержащихся в них примесей. Так получают чистое золото, медь и многие другие металлы.
Например, при очистке (рафинировании) меди исходный металл, содержащий нежелательные примеси, служит анодом. Анод погружают в раствор сульфата меди(II). При пропускании тока медь на аноде окисляется, её ионы переходят в раствор, перемещаются к катоду и на нём восстанавливаются. Примеси в этом процессе не участвуют из-за их малой концентрации, и поэтому на катоде образуется слой чистой меди.
Процессы электролиза с активными анодами используют для получения покрытий из оксидов металлов. Так, при проведении электролиза с анодом из алюминия его поверхность окисляется, покрываясь слоем оксида. Такой процесс специального наращивания оксида на поверхности металла называют электрохимическим оксидированием (или анодированием). Анодирование применяют для защиты металла от коррозии, придания его поверхности декоративного внешнего вида, повышенной твёрдости.
Методом электролиза растворов солей на поверхность различных изделий наносят покрытия из металлов и их сплавов, композитов с неметаллами, что придаёт изделиям нужные свойства (повышенная коррозионная стойкость, декоративная отделка, электропроводность и др.). К распространённым промышленным процессам относятся цинкование, никелирование, меднение, хромирование, оловянирование, золочение и серебрение.
В НИИ физико-химических проблем Белорусского государственного университета разработаны и внедрены в промышленность процессы электрохимического осаждения покрытий из сплавов металлов и композиционных покрытий металл — оксид металла, например: Ni—B , Ni—P , Ni—Sn , Au—Co , Сu—CuO—Cu2O , Ni — алмаз (алмаз в виде тонко измельчённого порошка). Такие покрытия более твёрдые, износо- и коррозионностойкие, чем покрытия из индивидуальных металлов, обладают декоративным внешним видом (рис. 108.6).
Рис. 108.6. Покрытия на часовых платах, платах кредитных карточек, корпусах транзисторов, фурнитурных изделиях
Электролиз водных растворов используется также в синтезе различных неорганических веществ, в обработке поверхностей металлов (азотирование, борирование, электрополировка, очистка), в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Электролизом получают кислород и водород.
При электролизе водных растворов солей на катоде восстанавливаются катионы металлов, расположенных в ряду активности после водорода.
На катоде не восстанавливаются катионы металлов IA- и IIA-групп , расположенных в начале ряда активности, а также алюминий, вместо них восстанавливается водород из молекул воды.
На катоде одновременно с водородом из воды восстанавливаются катионы металлов, расположенных в ряду активности между алюминием и водородом.
На аноде в растворах солей бескислородных кислот окисляются анионы (кроме фторид-ионов).
На аноде в растворах солей кислородсодержащих кислот с максимальной степенью окисления неметалла ( , ) окисляются молекулы воды с выделением кислорода.
Вопросы, задания, задачи
1. Какие из веществ — каменная соль, сахар, медный купорос, глицерин, серная кислота — могут подвергнуться электролизу в водном растворе?
2. Объясните, почему алюминий нельзя получить электролизом водного раствора его хлорида.
3. Приведите уравнения реакций на электродах при электролизе водного раствора сульфата никеля(II).
4. Сравните продукты электролиза расплава и водного раствора хлоридов натрия, никеля(II) и меди(II). Приведите соответствующие уравнения химических реакций.
5. При электролизе водного раствора хлорида натрия без разделения электродных пространств можно получить гипохлорит натрия. Приведите возможные уравнения электродных процессов и химических реакций в растворе.
6. Продукцией цеха мембранного электролиза ОАО «Беларуськалий» являются водный раствор гидроксида калия и соляная кислота. Приведите уравнения реакций, которые лежат в основе получения этих веществ.
7. Как изменится концентрация катионов и анионов в водных растворах CuCl2, Na2SO4, KI, NaOH, HCl при электролизе? Приведите соответствующие уравнения реакций.
8. В качестве лабораторного способа дезинфекции воды используется электролиз водного раствора хлорида натрия в портативных электролизёрах. Объясните процессы, на которых основан этот способ дезинфекции воды.
9. Сырьём для получения цинка является руда, содержащая цинковую обманку (ZnS). Продукт её обжига растворяют в серной кислоте и после нескольких стадий очистки от примесей (Cu 2+ , Fe 2+ , Fe 3+ и др.) подвергают электролизу. Приведите уравнения химических реакций, иллюстрирующих все основные стадии получения цинка.
10. Оксид марганца(IV) получают электролизом раствора сульфата марганца(II) в присутствии серной кислоты. Предположите, какие процессы протекают на электродах и приведите уравнения соответствующих реакций.
Самоконтроль
1. При электролизе водных растворов солей восстанавливаются ионы:
- а) Li + ;
- б) Mg 2+ ;
- в) Ni 2+ ;
- г) Au 3+ .
2. При электролизе водных растворов солей не восстанавливаются ионы:
- а) K + ;
- б) Са 2+ ;
- в) Cu 2+ ;
- г) Ag + .
3. Продуктами электролиза водного раствора калийной соли являются:
4. На катоде могут протекать процессы:
- а) 2Н2О + 2e – = Н2↑ + 2ОН – ;
- б) 2Н2О – 4e – = О2↑ + 4Н + ;
- в) 2Н + + 2e – = Н2↑;
- г) Ni 2+ + 2e – = Ni 0 .
5. При электролизе водного раствора хлорида натрия выделился водород объёмом 2,24 дм 3 (н. у.). Число электронов, отданных при этом ионами хлора, равно:
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
На аноде окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Электролиз
Электролиз (греч. elektron - янтарь + lysis — разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).

Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.

Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + - 2e = H2
К аноду притягиваются анионы - отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl - , Br - , I - , F - , S 2- , CH3COO - .

При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.

Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись "NaOH", не подвергая его дальнейшему электролизу)
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно :) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.

В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Электролиз расплавов и растворов

Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
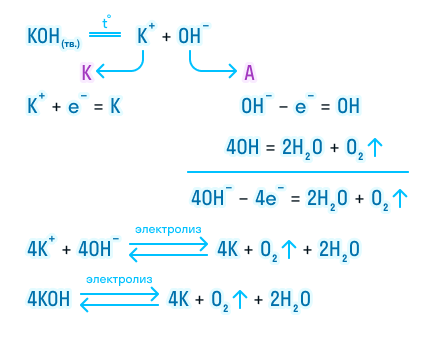
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH - как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
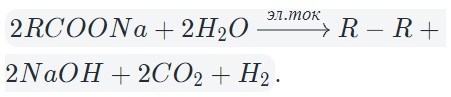
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Под действием электрического тока катионы $Na^$ движутся к катоду и принимают от него электроны:
Анионы $Cl^$ движутся к аноду и отдают электроны:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
Катодные процессы
| $Li K Ca Na Mg Al$ $Li^ K^ Ca^ Na^ Mg^ Al^$ | $Mn Zn Fe Ni Sn Pb$ $Mn^ Zn^ Fe^ Ni^ Sn^ Pb^$ | $H_2$ $2H^$ | $Cu Hg Ag Pt Au$ $Cu^ Hg_2^ Ag^ Pt^ Au^$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^;$ $M^$ не восстанавливается | Восстанавливаются катионы металла и вода: $M^+nē=M^0$ $2H_2O+2ē=H_2↑+2OH^$ | Восстанавливаются катионы металла: $M^+nē=M^0$ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) | |||
2. Процесс на аноде зависит от материала анода и от природы аниона.
Анодные процессы
| Кислотный остаток $Ас^$ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^−nē=M^$ анод раствор | Окисление аниона (кроме $F^$) $Ac^−mē=Ac^0$ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^$ В щелочной среде: $4OH^−4ē=O_2↑+4H^$ | |
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
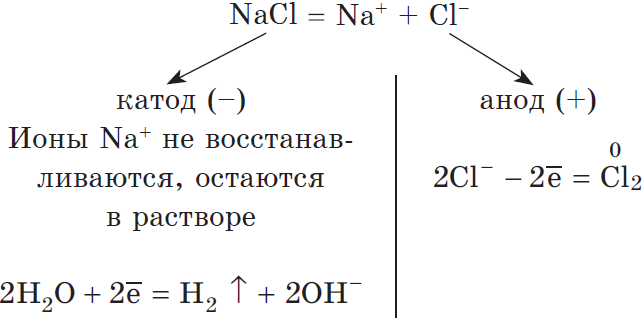
Учитывая присутствие ионов $Na^$ в растворе, составляем молекулярное уравнение:
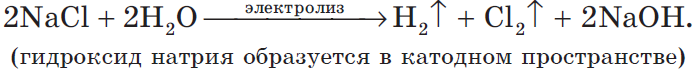
2) Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Катионы $Cu^$ в ряду напряжений стоят после ($Н^$), по этому они и будут восстанавливаться на катоде.
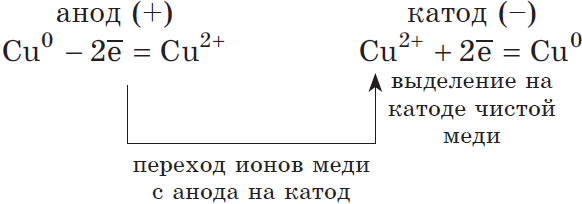
Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
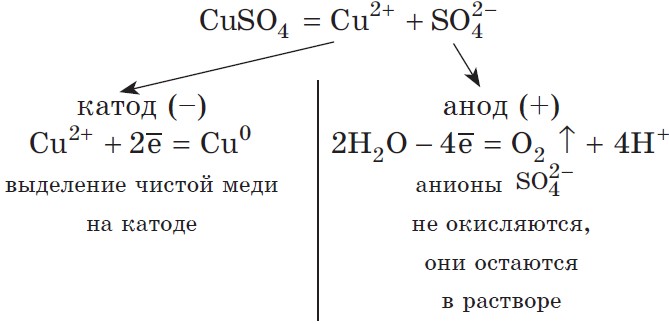
Суммарное ионное уравнение:
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^$ в растворе:
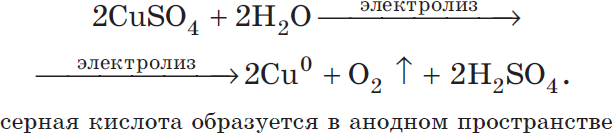
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
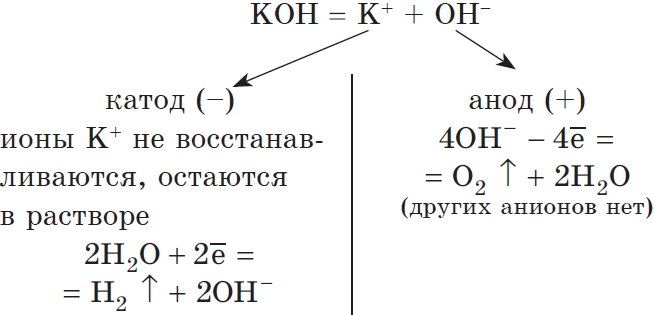
Суммарное молекулярное уравнение:
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
Читайте также:
