Металлическая связь имеется в соединении
Обновлено: 17.05.2024
В этой статье мы подробно рассмотрим металлическую связь, ее характеристики и факты, а также некоторые примеры металлической связи.
- Натрий
- алюминий
- магниевый
- Медь
- Утюг
В одном из геометрических расположений, таких как центральное кубическое расположение тела, гексагональная плотноупакованная или центрально-кубическая плотноупакованная грань, металл состоит из положительных ионов. Отрицательно заряженные делокализованные электроны удерживают положительно заряженные ионы вместе в кристаллической решетке. Следовательно, положительные и отрицательные заряды уравновешиваются.
Согласно теории электронного облака, металлическая связь представляет собой электростатические силы притяжения между положительно заряженными ионами металлов, заключенными в море отрицательно заряженных мобильных электронов. Как показано на рисунке.
Кредиты изображений: Wikimedia
Характеристики металлической связки
- Металлы могут проводить через них тепло. Когда один конец металла нагревается, подвижные электроны поглощают тепловую энергию и быстро движутся к другому концу, поэтому металл проявляет теплопроводность.
- Металлы также являются хорошими проводниками электричества, так как в них присутствуют свободные электроны, которые переносят ток.
- Металлы непрозрачны, и они также имеют металлические кластеры.
- Металлы пластичны и податливы.
- Металлы проявляют свойство блеска, так как подвижные электроны поглощают и излучают видимые световые излучения.
- Металлическая связь возникает в твердом состоянии вещества.
- Металлам требовались высокие температуры для разрыва связей между ними, поэтому они имели высокие температуры плавления и кипения.
Металлическая связка Примеры
Натрий (Na)
Атом натрия имеет один электрон на валентной оболочке. Когда более одного атома натрия располагаются в кристаллической решетке (ОЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другим атомом натрия, образуются молекулярные орбитали. Валентные электроны, находящиеся на внешней оболочке атома, распределяются в пространственной решетке металла. это металлик пример облигации.
Положительно заряженные ионы металла натрия и отрицательно заряженные электроны соединяются вместе, образуя металлические связи.
Кредиты изображений: химик
Алюминий (Al)
Атом алюминия имеет три электрона на валентной оболочке. Когда атомы алюминия располагаются в кристаллической решетке (ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другими атомами алюминия, и образуются молекулярные орбитали. Эти электроны делокализованы в пространственной решетке. По мере увеличения числа валентных электронов становится доступным больше свободных электронов. Это пример металлической связи. Металлическая связь, образованная между положительно заряженными ионами металла алюминия и электронами.
Изображение Кредиты: химик
Магний (Mg)
Атом магния имеет два валентных электрона. Когда атомы магния располагаются в кристаллической решетке (ГПУ), электроны, присутствующие в валентной оболочке, делят пространство с другими атомами магния, и образуются молекулярные орбитали. Электроны, находящиеся на валентной оболочке, могут свободно перемещаться в кристалле. Металлическая связь, образованная между положительно заряженными ионами металлического магния (2 + ) и электроны. следовательно, это пример металлической связи.
Медь (Cu)
Один электрон находится на внешней оболочке атома меди. Когда более одного атома меди располагаются в кристаллической решетке (ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другим атомом меди, образуются молекулярные орбитали. Электроны, находящиеся на валентной оболочке, распределяются в междоузлиях металлического кристалла. Они могут свободно двигаться. Это пример металлической связки. В качестве металлической связи, образованной между ионами металла меди и электронами.
Железо (Fe)
Атом железа имеет восемь электронов в своей электронной оболочке. Когда атомы железа располагаются в кристаллической решетке (ОЦК и ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другими атомами железа, и образуются молекулярные орбитали. Делокализация этих электронов происходит в междоузельном пространстве. Чем больше электронов, не связанных с атомами, становится доступным по мере увеличения числа валентных электронов. Это пример металлической связи. Металлическая связь, образованная между положительно заряженными ионами металла железа и электронами.
Часто задаваемые вопросы:
Вопрос 1. Что такое металлическое соединение?
Ответ: Металлическая связь может быть определена как
Сила притяжения существует между отрицательно заряженными подвижными электронами и положительно заряженными ионами металлов. Эта сила притяжения используется для удержания атомов металла вместе в металлическом кристалле.
Вопрос 2 . Растворяются ли металлические связи в воде?
Ответ: Растворимость металлических связей в воде
Металлические связи не растворяются в воде, но некоторые щелочные металлы, натрий и калий, растворяются в воде.
Вопрос 3. Являются ли металлические связи прочными?
Ответ: Да, металлические связи не являются слабыми связями.
Поскольку металлы требуют высоких температур для плавления и кипения. Для разрыва связей между атомами металла требуется большое количество энергии, поэтому они считаются прочными связями.
Вопрос 4. В чем разница между металлической и ковалентной связью?
Я Смрути Бхосале. Я из Мумбаи. У меня есть степень магистра неорганической химии в колледже Гуру Нанак Хальса в Мумбаи. Я всегда страстно пишу и вдохновляю своими словами как можно больше желающих. Химия - это предмет, который используется всеми в их обычной жизни. Я хочу объяснить предмет максимально понятным и простым способом. Я творческий, трудолюбивый человек и люблю узнавать новое. Я люблю читать книги.
Последние посты
Гидроксид калия или едкий калий является неорганическим компонентом. Его молярная масса составляет 56.11 г/моль. Давайте резюмируем структуру КОН Льюиса и все факты в деталях. КОН представляет собой простой гидроксид щелочного металла.
Слово «еще» в основном служит в значении «до сих пор» или «тем не менее» в предложении. Проверим употребление слова «пока» в значении «союз». Слово "пока" можно обозначить как "координационное.
О НАС
Мы являемся группой профессионалов отрасли из различных областей образования, таких как наука, инженерия, английская литература, и создаем универсальное образовательное решение, основанное на знаниях.
5 примеров металлической связи: объяснение и подробные факты
Металлическая связь имеется в соединении 1)FeO 2)FeCl3 3)Fe3 4)Fe(OH)3?
Металлическая связь имеется в соединении 1)FeO 2)FeCl3 3)Fe3 4)Fe(OH)3.


Выполните цепочку FeO - Fecl - Fe(oh)2 P?
Выполните цепочку FeO - Fecl - Fe(oh)2 P.
S. Заранее спасибо!

Что такое химическая связь и металлическая связь ?
Что такое химическая связь и металлическая связь ?

Ионная связь имеется в соединениях KOH, CH3CL, K2SO4, C5Br?
Ионная связь имеется в соединениях KOH, CH3CL, K2SO4, C5Br.
Химия 8 класс1) Металлическая связь имеет черты сходства с ковалентной связью?
1) Металлическая связь имеет черты сходства с ковалентной связью.
Сравните эти химические связи между собой.
2) Металлическая связь имеет черты сходства с ионной связью.
4)По формулам веществ определите тип химической связи в них : Ba , BaBr2(внизу 2 ) , HBr , Br2(внизу 2 ).

Составьте формулы соединений PH FeCl CrO, зная степень окисления?
Составьте формулы соединений PH FeCl CrO, зная степень окисления.

Металлическая связь, если можно с примерами?
Металлическая связь, если можно с примерами.
Металлическая связь отличается от ионой связи?
Металлическая связь отличается от ионой связи?
Прошу решите цыпочку Fe + feo - fecl - (feoh)2 - feso4 + (feno3)2?
Прошу решите цыпочку Fe + feo - fecl - (feoh)2 - feso4 + (feno3)2.
Написать молекулярные и ионные уравнения к схеме :Fe - - >FeCl₂ - - >Fe(OH)₂ - - >FeSO₄ - - >Fe(OH)₂ - - >FeO - - >Fe?
Написать молекулярные и ионные уравнения к схеме :
Fe - - >FeCl₂ - - >Fe(OH)₂ - - >FeSO₄ - - >Fe(OH)₂ - - >FeO - - >Fe.
Определите валентность элементов в веществах, если хлор в данных соединениях одновалентен FeCl³ FeCl² KCl CrCl³ PCl ^ 5 SiCl⁴ SCl ^ 6?
Определите валентность элементов в веществах, если хлор в данных соединениях одновалентен FeCl³ FeCl² KCl CrCl³ PCl ^ 5 SiCl⁴ SCl ^ 6.
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..

Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.

Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.

В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.
Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
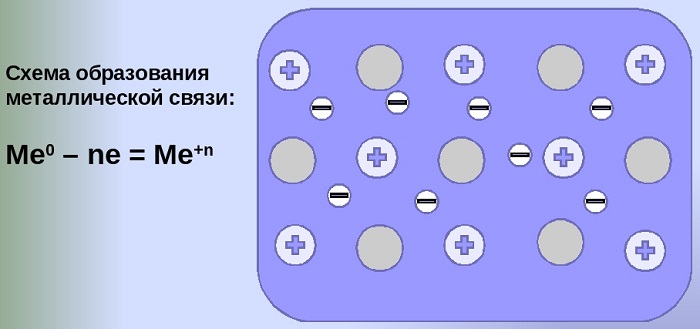
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
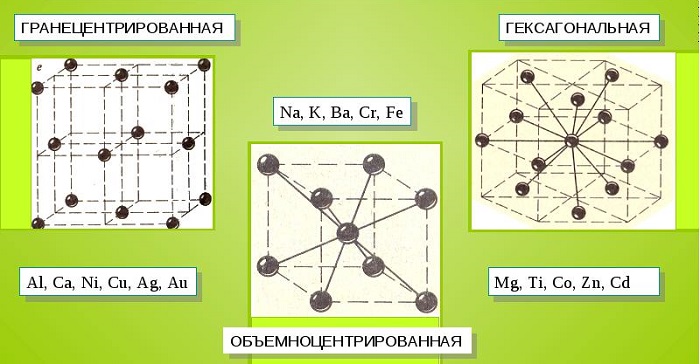
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
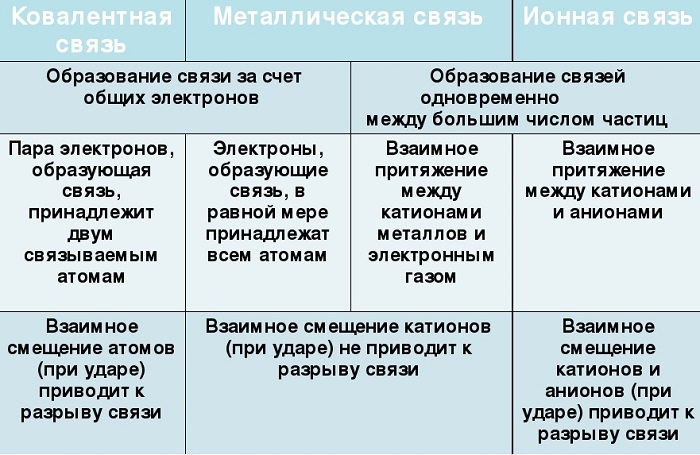
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Читайте также:
