Металлическая связь межмолекулярное взаимодействие
Обновлено: 18.05.2024
Металлы объединяют свойства, имеющие общий характер и отличающиеся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи – металлической связи.
Металлическая связь – связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов.
Именно этим и объясняется, например, пластичность металлов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи.
Металлическая связь отличается от ковалентной ненаправленностью (валентные электроны распределены по кристаллу равномерно) и меньшей прочностью (ее энергия в 3–4 раза меньше энергии ковалентной связи).
Электрически нейтральные атомы и молекулы способны к дополнительному взаимодействию друг с другом.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы (F, O, N, реже Cl, S и др.). Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (Н2О)2, (Н2О)3 и т.д. В растворах же могут возникать длинные цепи ассоциатов (Н2О)n:
Водородные связи возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Так, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями.
Водородная связь имеет промежуточный характер между валентным и межмолекулярным взаимодействием. Она связана с уникальными свойствами поляризованного атома водорода, его малыми размерами и отсутствием электронных слоев.
Ван-дер-ваальсова связь (межмолекулярное взаимодействие). Все вещества в зависимости от внешних условий (температуры и давления) могут существовать в различных агрегатных состояниях. Так, при низких температурах оказывается возможным «согласованное» движение электронов, при котором у молекулы могут возникать наведенные диполи без передачи атомами электронов, и между ними возникают так называемые индукционные силы притяжения. Такой вид взаимодействия называется ван-дер-ваальсовой связью. Энергия такой связи намного (в сотни раз) меньше энергий ковалентных, ионных или металлических. Вандерваальсовы силы обусловливают притяжение молекул и агрегацию вещества, превращение газообразного вещества в жидкое и далее в твердое состояние.
Связь между молекулами может осуществляться как электростатическим, так и донорно-акцепторным взаимодействием, что обусловливает разнообразие сложных соединений и их характерных свойств – так образуются комплексные соединения, рассматриваемые в отдельной главе.
Химическая связь. Типы химической связи

Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ . Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4 .

Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В) , то общая электронная пара не смещается ни к одному из атомов: А : В . Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4 ), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная .
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2 ), то один из электронов практически полностью переходит к другому атому, с образованием ионов . Такая связь называется ионная .
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь , образованная за счет образования общей электронной пары А:В . При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45 о , поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109 о 28′.

Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ .
Пример . Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H . + . H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной .
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент . Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А . + . В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4 + , в ионах органических аминов, например, в ионе метиламмония CH3-NH2 + ;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Длина связи, нм
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например , в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na + , с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4 + , сульфат-ион SO4 2- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na + Cl — , Na2 + SO4 2- .
Наглядно обобщим различие между ковалентными и ионным типами связи:

Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы . Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе , создавая таким образом достаточно прочную металлическую кристаллическую решетку . При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные , индукционные и дисперсионные . Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N . Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом , а также к ислорода с водородом , в меньшей степени азота с водородом .

Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.

А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.

Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные . Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью.
§ 6.2. Металлическая связь
Такая химическая связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов.
Схема образования металлической связи (М — металл):
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск. Вещества с металлической связью имеют металлическую кристаллическую решетку.
Межмолекулярные взаимодействия
Одним из видов межмолекулярных взаимодействий, которые обусловливают притяжение молекул друг к другу в твердом и жидком состояниях, является водородная связь.
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи:

При наличии такой химической связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (этиловый спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
В биополимерах — белках (вторичная структура) имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы:
Молекулы полинуклеотидов — ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны друг с другом водородными связями. При этом действует принцип комплементарности, т. е. эти связи образуются между определенными парами, состоящими из пуринового и пиримидинового оснований: против аде-нинового нуклеотида (А) располагается тиминовый (Т), а против гуанинового (Г) — цитозиновый (Ц).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Помимо водородной связи существуют другие силы межмолекулярного взаимодействия, называемые силами Ван-дер-Ваальса (в честь голландского физика). В основе их лежит электростатическое взаимодействие диполей, но в различных веществах механизм возникновения диполей различен.
Если вещества состоят из полярных молекул (НСl, Н2O, СН3ОН, С2Н5Сl), то молекулярные диполи притягиваются друг к другу противоположно заряженными частями.
Этот вид взаимодействия называют ориентационным.
В смесях веществ, состоящих из полярных и неполярных молекул, под влиянием полярной молекулы в неполярной молекуле возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу.

Такой вид взаимодействия называют индукционным.
Наконец, в любых молекулах (полярных и неполярных) непрерывно изменяется взаимное положение электронов и ядер, что вызывает появление мгновенных диполей, между которыми также действуют силы притяжения. Эти взаимодействия называют дисперсионными.
Ван-дер-ваальсовы силы недостаточны для образования молекул, но способствуют образованию жидкостей и кристаллов при низких температурах. Они имеются в веществах с атомными, ионными и металлическими кристаллическими решетками, но в этих случаях их вклад в общую энергию связи несущественен.
Металлическая и водородная связь

Урок посвящён изучению металлической и водородной связи, принципам и механизмам связи, свойствам веществ с металлической и водородной связью.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Металлическая и водородная связь"
Атомы металлов имеют ряд особенностей:
· На внешнем слое у них от одного до трёх электронов;
· У них сравнительно большие радиусы атомов;
· Атомы металлов имеют достаточное количество свободных орбиталей.
Например, у атома натрия один электрон на третьем энергетическом уровне. А на третьем энергетическом уровне всего девять орбиталей (одна эс, три пэ и пять дэ орбиталей).
Когда атомы металлов сближаются, то их свободные орбитали перекрываются и валентные электроны одного атома могут перемещаться на свободные орбитали другого атома. При этом, в кристалле металла постоянно идут два противоположных процесса: атом, который отдал электроны превращается в катион, а свободные электроны при этом, притягиваясь к положительным ионам металлов вновь превращают их в нейтральные атомы.
Поэтому в металлах постоянно идёт превращение атомов в ионы и наоборот, а частицы, из которых состоят кристаллы металла, называют атом-ионами.
Поэтому в узлах кристаллической решётки металлов находятся как нейтральные атомы, так и катионы металла. Образовавшиеся при этом электроны перемещаются внутри кристалла металла и являются общими для всех атомов и ионов металла, связывая их между собой.
Таким образом, металлическая связь – это химическая связь, между атомами в металлическом кристалле посредством обобществления валентных электронов.
Металлическая связь характерная для металлов и сплавов и объясняет ряд физических свойств металлов: ковкость, пластичность, тепло- и электропроводность металлов, металлический блеск.
Особенностью этой химической связи является то, что она не имеет направленности в пространстве, она является коллективной, как и ионная, потому что в ней принимают участие все атомы металла.
Сходство металлической связи с ковалентной заключается в том, что при её образовании электроны обобществляются, но в металлической связи эти электроны связывают все атомы металла в кристалле, а в ковалентной связи связываются только находящиеся рядом атомы.
Водородная связь осуществляется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Причем, чаще всего отрицательно заряженным атомом являются наиболее электроотрицательные элементы: фтор, кислород, азот, реже хлор и сера.
Схематично водородную связь показывают тремя точками. Образование водородной связи объясняется электростатическим взаимодействием между молекулами. При этом возникает донорно-акцэпторное взаимодействие свободной орбитали атома водорода и орбитали с неподелённой парой электронов электроотрицательного атома. Из-за этого, водородная связь обладает направленностью.
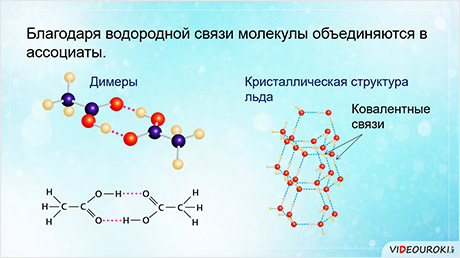
Благодаря водородной связи молекулы объединяются в ассоциаты, как, например, димеры уксусной кислоты.
Водородные связи также определяют кристаллическую структуру льда, в которой каждый атом кислорода связан с четырьмя атомами водорода – двумя ковалентными и двумя водородными связями.
Кристаллическая структура льда
Водородная связь объясняет такое алхимическое правило, как «подобное растворяется в подобном», когда возникают связи между молекулами растворителя и молекулами растворённого вещества. Вещества метиловый спирт, этанол, уксусная кислота, этиленгликоль, глицерин неограниченно растворимы в воде.
Водородная связь в молекуле аммиака обуславливает его возможность легко сжижаться и вновь переходить в газообразное состояние с поглощением теплоты. Поэтому аммиак используют как хладагент в холодильных установках.
Водородная связь слабее ковалентной, поэтому она характерна для веществ в твёрдом и жидком состояниях.
Некоторые аномальные свойства веществ объясняются наличием водородной связи. Например, высокие температуры кипения воды, фтороводорода и аммиака по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов, объясняются образованием ассоциатов за счёт водородных связей.
Водородная связь наиболее распространена в природе. Эта связь объясняет аномальные свойства воды, такие как высокие температуры кипения и плавления, высокую теплоёмкость и диэлектрическую проницаемость. Благодаря своей структуре лёд имеет меньшую плотность, чем жидкая вода, поэтому лёд находится на поверхности воды и глубокие водоёмы не промерзают до дна.
Светло-голубой цвет чистой воды и толстого льда также обусловлен водородными связями. Ещё водородная связь объясняет образование кристаллов в виде изморози и снежинок.
Водородная связь возникает и между атомами одной молекулы. Это так называемая внутримолекулярная водородная связь. Она возникает в молекулах органических веществ, которые имеют группы атомов: о-аш, эн-аш, эн-аш-два и другие.
Внутримолекулярная водородная связь
Водородная связь характерна для большинства органических соединений, например, для белков, нуклеиновых кислот. Вторичная структура молекулы ДНК объясняется наличием внутримолекулярной водородной связи. Благодаря ей полипептидная цепь закручена в спираль, и её витки удерживаются от раскручивания.
Но водородная связь непрочная, поэтому белки разрушаются – денатурируют. Денатурация может быть обратимой и необратимой.
Обратимая денатурация белков обусловлена влиянием механического воздействия. Например, многие работники шахт, дорожных служб, горняки, стекловары, металлурги, врачи-рентгенологи, работники химических производств постоянно подвергаются какому-то механическому воздействию. Поэтому для компенсации вредного воздействия условий труда на организм, им предоставляются определённые льготы.
Необратимую денатурацию вы можете наблюдать при варке яиц, мяса, рыбы и других белковых продуктов. Например, если к раствору куриного яйца прилить этилового спирта или соли тяжёлого металла, то можно будет наблюдать выпадение осадка вследствие денатурации белка. Аналогичным действие обладает и никотин, который воздействует на белковые молекулы.
Денатурацию белка вызывает этиловый спирт, соли тяжёлых металлов.
Таким образом, молекулы могут взаимодействовать между собой и это взаимодействие называется межмолекулярным.
Силы, которые обеспечивают это взаимодействие, называются ван-дэр-ваальсовыми, в честь голландского учёного Ван-дэр-Ваальса.
Межмолекулярное взаимодействие, как и химическая связь, имеет электростатическую природу.
В молекуле возникают противоположные полюса: положительные, где электронная плотность понижена и отрицательные полюса, где электронная плотность повышена. Образовавшиеся полярные молекулы притягиваются друг к другу.
Это межмолекулярное взаимодействие может осуществляться между полярными молекулами, между полярными и неполярными молекулами, а также между неполярными молекулами.
Межмолекулярное взаимодействие объясняет переход вещества из газообразного в жидкое, а затем и в твёрдое. Межмолекулярное взаимодействие слабее, чем ковалентная связь, поэтому связи между молекулами непрочные и легко разрываются. Из-за этого, молекулярные вещества плавятся и кипят при низких температурах.
Энергия межмолекулярного взаимодействия зависит от полярности молекулы и её размера.
Чем сильнее межмолекулярное взаимодействие, тем выше у вещества температуры кипения и плавления. Например, кислород из-за более прочного межмолекулярного взаимодействия кипит при более высокой температуре, чем азот. Углеводороды с большей молярной массой кипят при более высокой температуре, чем низкомолекулярные углеводороды.
Межмолекулярные связи возникают между молекулами в молекулярной кристаллической решётке.
Например, молекулярные кристаллические решётки имеют: водород, азот, кислород, сера, йод, вода, углекислый газ, благородные газы и многие органические вещества.
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления и кипения, небольшая твёрдость и лёгкая сжижаемость.
Нагревание некоторых молекулярных кристаллов, как йода, углекислого газа, приводит к переходу вещества из твёрдого состояния в газообразное, минуя жидкую фазу. Этот процесс называется возгонкой, или сублимацией.
Многие органические вещества вообще не плавятся, потому что прочность связей между молекулами в сумме оказывается выше прочности связей внутри молекулы.
Если попробовать расплавить такие вещества, как крахмал, цэллюлоза или вата, то они начнут разрушать раньше, чем плавиться.
Реакционная способность молекулярных веществ зависит от прочности внутримолекулярных связей, потому что при химическом взаимодействии разрываются внутримолекулярные связи. Парафин – непрочное вещество, связи между молекулами слабые, но это вещество химически устойчиво.
Таким образом, металлическая связь осуществляется за счёт обобществления электронов, межмолекулярное взаимодействие осуществляется между любыми молекулами и объясняет переход вещества из газообразного в жидкое, а затем в твёрдое. Водородная связь осуществляется между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Читайте также:
