Металлическая связь понятие о зонной теории
Обновлено: 27.04.2024
Вещества с металлическими связями - металлы - обладают рядом особых свойств. К ним относятся высокие тепло- и электропроводность, сплошной спектр поглощения света, а также высокая пластичность многих металлов и образование между ними соединений, не отвечающих валентностям. Эти свойства говорят о том, что металлическая связь делокализована, имеет множество близко расположенных электронных состояний и ненаправленна. Некоторые из этих свойств были описаны моделью свободных электронов и методом МО.
Модель свободных электронов.В этой модели металл представляется как совокупность катионов, образующих остов, как бы погруженных в электронную жидкость, частицы которой (электроны) свободно перемещаются между катионами. Энергия связи определяется как кулоновское взаимодействие между катионами и электронами. Эта теория хорошо описывает свойства щелочных металлов. В частности, структура металлов определяется тем, что минимум энергии системы достигается при плотнейшей упаковке катионов, что имеет место при координационных числах 8 и 12; при этом связь оказывается ненаправленной, так как изменения в геометрии расположения атомов и даже изменения координационного числа в указанных пределах мало изменяют энергию связей. Эта модель, однако, плохо объясняет свойства других металлов и спектры металлов.
Теория молекулярных орбиталей (МО) для металлов.Теория МО для металлов объясняет все их свойства. В этой теории кристалл металла рассматривается как гигантская молекула из N атомов, в которой все атомы взаимодействуют друг с другом (а не только соседние). В этом случае МО будут охватывать весь кристалл. Сами МО образуются путем линейной комбинации АО всех N атомов:
При этом из N АО образуются N МО. Расчетным и экспериментальным путем (по спектрам) показано, что разница в энергиях (DЕ) между самой нижней и самой высокой Y составляет величину порядка обычной химической связи (несколько сотен кДж/моль). Тогда расстояние между соседними МО будет очень малой величиной порядка 10 - 18 Дж/моль () (рис. 3.26).
Если взять, например, N атомов Li, имеющих по одному валентному электрону на одной атомной орбитали (2s 1 ), то при их взаимодействии образуется столько же МО. Так как на каждой МО может быть 2ē, то лишь половина МО будет занята. Расстояние между соседними МО - dЕ - чрезвычайно мало, поэтому поглощение любого кванта энергии (даже тепловой или энергии внешнего поля) вызывает возбуждение электрона; это объясняет сплошной спектр и высокую подвижность электронов.
В случае металлов с полностью заполненными подуровнями (Ве: 2s 2 2р 0 ) имеет место перекрывание зон 2s-и 2р-МО и картина, показанная на рис 3.26, сохраняет свой вид (близкое расположение пустых и заполненных мест), так как обычно соседние пустая и заполненная зоны перекрываются (2s2р).
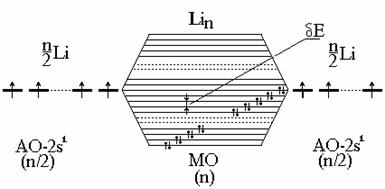
Рис. 4.26. Образование почти сплошной зоны МО в металлах
В случае металлов с незаполненными d-подоболочками d-d-взаимодействие приводит к образованию локализованных и направленных ковалентных МО. Этим объясняются высокая твердость и высокие температуры плавления таких металлов. Аналогичная ситуация и в случае f-металлов.
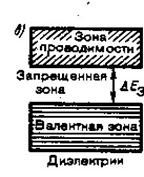
Таким образом, молекулярные орбитали металла образуют почти непрерывную зону разрешенных энергий (этим, в частности, объясняется непрерывный, а не линейчатый, как у атомов, или полосатый, как у молекул, спектр поглощения металлов). Разность между верхней и нижней энергиями (DЕ) зоны называется шириной зоны. Зона, заполненная электронами, называется валентной.Зона, свободная от электронов и находящаяся выше валентной зоны, - зона проводимости. Они могут либо перекрываться, либо не перекрываться друг с другом. Если эти зоны не перекрываются, то между ними существует запрещенная зона с шириной DЕ.
Ширина запрещенной зоны определяет тип кристалла: металл, полупроводник или диэлектрик (рис. 4.27).
а б в
Рис. 4.27. Зонная структура металлов (а), полупроводников (б)
и диэлектриков (в)
(верхняя зона – зона проводимости, нижняя – валентная зона)
Теория, с помощью которой объясняют свойства кристаллов, получила название зонной теории. При ширине запрещенной зоны ниже
4 эВ кристаллические вещества проявляют полупроводниковые свойства. При поглощении энергии электроны валентной зоны возбуждаются и переходят в зону проводимости, а в валентной зоне появляются вакансии электронов, которые имеют эффективный положительный заряд; их называют дырками. Наличие подвижных электронов и дырок обеспечивает собственную проводимость полупроводников. Собственную проводимость имеют, например, кремний и германий.
У диэлектриков ширина запрещенной зоны превышает 4 эВ. Для возбуждения электронов требуется очень значительная энергия, нагреванием такого возбуждения достичь невозможно, так как при этом кристалл либо расплавится, либо разрушится.
К диэлектрикам относятся многие вещества с ионными и молекулярными кристаллами, а также некоторые вещества с ковалентными кристаллами, например алмаз (DЕ = 5,1 эВ) и кварц (DЕ = 5,2 эВ).
4.8. Кристаллические решетки
Если вещество образует молекулы, полярные или неполярные, то его кристаллы обычно построены из молекул, т.е. имеют молекулярную решетку.Силы, действующие между молекулами, сравнительно слабые. Поэтому вещества с молекулярной решеткой имеют малую твердость, низкие температуры плавления, плохую растворимость в воде. При обычных условиях это, как правило, газы или жидкости.
Среди сложных веществ это большинство органических веществ, которые находятся при обычных условиях в твердом состоянии.
Из неорганических соединений это - твердый СО2 (сухой лед), вода (лед), твердые галогеноводороды и многие другие.
Для молекулярных веществ характерна следующая закономерность: вещества с большей молекулярной массой имеют более высокие температуры плавления и кипения.
Вещества с ионным типом связи часто образуют ионные решетки. Это, как правило, ионные проводники, растворяющиеся в полярных растворителях. Они тугоплавки, малолетучи, сравнительно прочны.
Если вещество не является ионным, но и не образует молекул, все связи оказываются одинаково прочными. Образуется атомная кристаллическая решетка. Вещества с атомной решеткой имеют высокие температуры плавления, высокую прочность и твердость. Они практически нерастворимы в воде и других жидкостях. Атомная решетка характерна для бора, углерода, кремния, германия, некоторых соединений этих элементов с другими (BN, SiO2 и др.).
Металлическая связь. Зонная теория.
Металлическая связь - это особый вид химической связи, реализующейся в металлах, сплавах, в соединениях металлов друг с другом (интерметаллидах) и, несколько реже, в соединениях металлов с неметаллами низкой электроотрицательности. Основной особенностью металлической связи является ее электронодефицитность: взаимодействие осуществляется с использованием значительно меньшего числа валентных электронов, чем это необходимо для образования двухцентровых связей. Так, например, в кристалле натрия каждый атом имеет в ближайшем окружении восемь таких же атомов, в то время как единственный валентный электрон позволяет ему образовать лишь одну двухцентровую связь. Совершенно очевидно, что существование кристалла натрия возможно лишь за счет образования делокализованных связей, охватывающих все атомы кристалла.
Таким образом, металлическая связь - это многоцентровая связь с дефицитом электронов, объединяющая большое число атомов за счет обобществления валентных электронов в пределах всего кристалла.
Характерными особенностями металлической связи являются ее ненаправленность и ненасыщаемость. Вследствие этого веществам с металлической связью присущ ряд общих свойств. Кристаллы таких веществ обладают высокой электропроводность и теплопроводностью. Типичным веществам с металлической связью присущи пластичность (ковкость) и характерный металлический блеск.
Наиболее удовлетворительно металлическую связь описывает зонная теория кристаллов, представляющая собой распространение метода молекулярных орбиталей на системы с переменным и очень большим числом атомов (порядка числа Авогадро).
Согласно постулатам Бора, в изолированном атоме энергия электрона может принимать строго дискретные значения (также говорят, что электрон находится на одной из орбиталей).
В случае нескольких атомов, объединённых химической связью (например, в молекуле), электронные орбитали расщепляются в количестве, пропорциональном числу атомов, образуя так называемые молекулярные орбитали. При дальнейшем увеличении системы до макроскопического кристалла (число атомов более 10 20 ), количество орбиталей становится очень большим, а разница энергий электронов, находящихся на соседних орбиталях, соответственно очень маленькой, энергетические уровни расщепляются до практически непрерывных дискретных наборов — энергетических зон. Наивысшая из разрешённых энергетических зон в полупроводниках и диэлектриках, в которой при температуре 0 К все энергетические состояния заняты электронами, называется валентной зоной, следующая за ней — зоной проводимости. В металлах зоной проводимости называется наивысшая разрешённая зона, в которой находятся электроны при температуре 0 К.
В основе зонной теории лежат следующие главные приближения:
Твёрдое тело представляет собой идеально периодический кристалл.
Равновесные положения узлов кристаллической решётки фиксированы, то есть ядра атомов считаются неподвижными (адиабатическое приближение). Малые колебания атомов вокруг равновесных положений, которые могут быть описаны как фононы, вводятся впоследствии как возмущение электронного энергетического спектра.
Многоэлектронная задача сводится к одноэлектронной: воздействие на данный электрон всех остальных описывается некоторым усредненным периодическим полем.
Ряд явлений, по существу многоэлектронных, таких, как ферромагнетизм, сверхпроводимость, и таких, где играют роль экситоны, не может быть последовательно рассмотрен в рамках зонной теории. Вместе с тем, при более общем подходе к построению теории твёрдого тела оказалось, что многие результаты зонной теории шире её исходных предпосылок.
27. Металлическая связь. Особенности. Элементы зонной теории для объяснения особенностей металлической связи.
Металлическая связь – химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решетку, с электронным газом из валентных электронов. В узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно движутся валентные электроны. Эти электроны удерживают вместе положительные ионы. Силы связи не локализованы и не направлены. В большинстве случаев проявляются высокие координационные числа (например, 8 или 12). Щелочные металлы кристаллизуются в кубической объемно-центрированной решетке (8). В кубической гранецентрированной решетке атомы расположены в вершинах куба и в центре каждой грани. Свободное движение электронов в решетке объясняет высокую тепло- и электропроводность металлов. Прочность и пластичность обуславливается строением решетки, т.к. при смещении атомов друг относительно друга не происходит разрыв связей. Катионы металлов не статичны, а колеблются. При повышении температуры возникают столкновения, уменьшающие электропроводность. При взаимодействии двух одинаковых атомов вместо двух энергетически равноценных АО возникают 2 МО, отвечающие разным уровням энергии. При последовательном увеличении числа взаимодействующих атомов добавление каждого из них приводит к образованию еще одного энергетического уровня. С ростом числа атомов возрастает число разрешенных энергетических состояний, а расстояние между соседними энергетическими уровнями уменьшается. При большом числе атомов соседние уровни настолько мало отличаются, что образуется практически непрерывная энергетическая зона, и переход электрона на более высокий уровень может осуществиться при затрате ничтожно малой энергии. В металлах валентная зона (совокупность занятых электронами уровней) и зона проводимости (оставшиеся незаполненными уровни) перекрываются, так что электроны могут свободно переходить на новые уровни.
28. Межмолекулярное взаимодействие. Ориентационный, индукционный и дисперсионный эффекты.
Когда вещество находится в газообразном состоянии, образующие его частицы хаотически движутся и преобладающую часть времени находятся на больших (по сравнению со своими размерами) расстояниях. Вследствие того силы взаимодействия между ними пренебрежимо малы. В жидком или твердом состоянии расстояния между частицами малы и силы взаимодействия существенны. Межмолекулярные взаимодействия обусловлены электромагнитными полями атомных ядер и электронов молекул. Универсальные взаимодействия проявляются во всех без исключения молекулах. Эти взаимодействия часто называют силами Ван-дер-Ваальса. Они являются первой причиной перехода большинства веществ из газообразного состояния в жидкое, устойчивости молекулярных кристаллов, адсорбции газов поверхностями твердых тел.
Среди сил притяжения выделяют ориентационную, индукционную и дисперсионную составляющие.
Ориентационная составляющая связана с полярностью молекул. Молекула, обладающая дипольным моментом, притягивает другую полярную молекулу за счет электростатических сил взаимодействия. Молекулы при этом стремятся расположиться последовательно или антипараллельно. Такой ориентации препятствует тепловое движение молекул, поэтому ориентационное взаимодействие тем больше, чем больше дипольные моменты, меньше расстояние между молекулами и ниже температура.
Индукционная составляющая возникает при взаимодействии полярной и неполярной молекул. При этом полярная поляризует неполярную, в которой появляется дипольный момент. В результате возникает притяжение молекул. Энергия индукционного взаимодействия тем больше, чем больше дипольный момент полярной молекулы и больше поляризуемость неполярной. Ориентационные и индукционные силы зависят от наличия полярных молекул, следовательно не аддитивны.
Дисперсионная составляющая универсальна и присутствует всегда. Наиболее отчетливо это притяжение проявляется при взаимодействии неполярных молекул и взаимодействии атомов благородных газов. Суть возникновения заключается в том, что при движении электронов в молекуле мгновенно появляется асимметрия распределения положительных и отрицательных зарядов. В результате молекулу можно рассматривать как место возникновения мгновенно существующих диполей различной направленности.
22 (Зонная теория твердых тел. Металлы, диэлектрики, полупроводники с точки зрения зонной теории)
Зонная теория твёрдого тела — квантовомеханическая теория движения электронов в твёрдом теле.
В соответствии с квантовой механикой свободные электроны могут иметь любую энергию — их энергетический спектрнепрерывен. Электроны, принадлежащие изолированным атомам, имеют определённые дискретные значения энергии. В твёрдом теле энергетический спектр электронов существенно иной, он состоит из отдельных разрешённых энергетических зон, разделённых зонами запрещённых энергий.
Согласно постулатам Бора, в изолированном атоме энергия электрона может принимать строго дискретные значения (также говорят, что электрон находится на одной из орбиталей).
В случае нескольких атомов, объединенных химической связью (например, в молекуле), электронные орбитали расщепляются в количестве, пропорциональном числу атомов, образуя так называемые молекулярные орбитали. При дальнейшем увеличении системы до макроскопического кристалла (число атомов более 10 20 ), количество орбиталей становится очень большим, а разница энергий электронов, находящихся на соседних орбиталях, соответственно очень маленькой, энергетические уровни расщепляются до практически непрерывных дискретных наборов — энергетических зон. Наивысшая из разрешённых энергетических зон в полупроводниках и диэлектриках, в которой при температуре 0 К все энергетические состояния заняты электронами, называется валентной зоной, следующая за ней — зоной проводимости. В металлах зоной проводимости называется наивысшая разрешённая зона, в которой находятся электроны при температуре 0 К.
Зонная структура различных материалов

В различных веществах, а также в различных формах одного и того же вещества, энергетические зоны располагаются по-разному. По взаимному расположению этих зон вещества делят на три большие группы (см. Рисунок ):
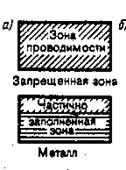
металлы— зона проводимости и валентная зона перекрываются, образуя одну зону, называемую зоной проводимости, таким образом, электрон может свободно перемещаться между ними, получив любую допустимо малую энергию. Таким образом, при приложении к твёрдому телуразности потенциалов, электроны смогут свободно двигаться из точки с меньшим потенциалом в точку с большим, образуя электрический ток. К проводникам относят все металлы.
полупроводники— зоны не перекрываются, и расстояние между ними составляет менее 3.5 эВ.Для того, чтобы перевести электрон из валентной зоны в зону проводимости, требуется энергия меньшая, чем для диэлектрика, поэтому чистые (собственные, нелегированные) полупроводники слабо пропускают ток.
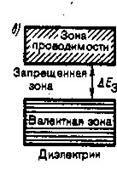
диэлектрики— зоны не перекрываются, и расстояние между ними составляет более 3.5 эВ. Таким образом, для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется значительная энергия, поэтому диэлектрики ток практически не проводят.
Зонная теория является основой современной теории твёрдых тел. Она позволила понять природу и объяснить важнейшие свойства проводников, полупроводников и диэлектриков. Величина запрещённой зоны между зонами валентности и проводимости является ключевой величиной в зонной теории, она определяет оптические и электрические свойства материала.
Поскольку одним из основных механизмов передачи электрону энергии является тепловой, то проводимость полупроводников очень сильно зависит от температуры. Также проводимость можно увеличить, создав разрёшенный энергетический уровень в запрещённой зоне путёмлегирования(добавление в состав материалов примесей для изменения (улучшения) физических и/или химических свойств основного материала). Таким образом создаются все полупроводниковые приборы: солнечные элементы (преобразователи света в электричество), диоды,транзисторы, твердотельныелазерыи другие.
Переход электрона из валентной зоны в зону проводимости называют процессом генерации носителей заряда (отрицательного — электрона, и положительного — дырки), обратный переход — процессомрекомбинации.
Металлы, диэлектрики и полупроводники по зонной теории
Зонная теория позволила с единой точки зрения истолковать существование металлов, диэлектриков и полупроводников, объясняя различие в их электрических свойствах, во-первых, неодинаковым заселением электронами разрешенных зон, и во-вторых, шириной запрещенных зон.
Рассматривая заполнение электронами разрешенных зон необходимо использовать два правила: 1) Электроны стремятся занять самые низкие энергетические уровни. 2) Принцип Паули: на одном энергетическом уровне не может быть более двух электронов. Эти электроны должны иметь разные спины.
Степень заполнения электронами энергетических уровней в зоне определяется заполнением соответствующего атомного уровня. Если уровень атома полностью заполнен, то и зона полностью заполнена. Из незанятых уровней образуются свободные зоны, из частично заполненных – частично заполненные зоны. В общем случае можно говорить о валентной зоне, которая полностью заполнена и образовалась из энергетических уровней внутренних электронов свободных атомов и о зоне проводимости (свободной зоне), которая либо частично заполнена, либо свободна и образована из энергетических уровней внешних коллективизированных электронов изолированных атомов (рис.2).
 | Самая верхняя зона целиком занятая электронами (при Т=0 К) называется валентной. Зона, заполненная электронами частично (при Т = 0 К), называется зоной проводимости. Определим изменение энергии электрона, находящегося на некотором уровне в разрешенной зоне, под действием внешнего поля с напряженностью . Энергия приобретаемая электроном на длине свободного пробега , где - средняя длина свободного пробега электрона в кристалле равная примерно 10 -8 м в электрическом поле с напряженностью В/м, которая соответствует обычным источникам тока, эВ. |
| Рис.2. |
Это означает, что возможны только внутризонные переходы, так как междузонные переходы имеют много большую энергию. Необходимым условием электрической проводимости является наличие в разрешенной зоне свободных энергетических уровней на которые электрическое поле сторонних сил могло бы перевести электроны. В зависимости от степени заполнения зон электронами и ширины запрещенной зоны возможны три случая, изображенных на рис.3.
   |
| (а) (б) (в) |
| Рис.3 |
3а). Зона проводимости заполнена лишь частично., то есть в ней имеются вакантные уровни. В этом случае электроны, получив сколь угодно малую энергетическую добавку (от поля или теплового движения) переходят на более высокий энергетический уровень той же зоны, то есть они участвуют в проводимости. Такой переход возможен, так как 1 К = 10 -4 эВ, что много больше расстояния между уровнями равному 10 -22 эВ. Таким образом, если в твердом теле имеется зона, лишь частично заполненная электронами, то это тело всегда будет проводником электрического тока. Именно это свойственно металлам.
3б). Возможно также такое перераспределение электронов между зонами, возникающими из уровней различных атомов, которое привело к тому, что вместо двух частично заполненных зон кристалла окажется одна целиком заполненная (валентная) зона и одна свободная зона (зона проводимости). Твердые тела, у которых энергетический спектр электронных состояний состоит только из валентной зоны и зоны проводимости, являются диэлектриками или полупроводниками в зависимости от ширины запрещенной зоны. Если ширина запрещенной зоны кристалла порядка нескольких электрон –вольт, то тепловое движение не может перебросить электроны из валентной зоны в зону проводимости и кристалл является диэлектриком, оставаясь им при всех реальных температурах.
3в). Если запрещенная зона достаточно узка ( эВ), то переход электронов из валентной зоны в зону проводимости может быть осуществлен сравнительно легко путем теплового возбуждения, либо за счет внешнего источника, способного передать электронам энергию , и кристалл является полупроводником.
Различие между металлами и диэлектриками с точки зрения зонной теории состоит в том, что при 0 К в зоне проводимости металлов имеются электроны, а в зоне проводимости диэлектриков они отсутствуют. Различие же между диэлектриками и полупроводниками определяется шириной запрещенных зон: для диэлектриков она довольно широка (например для NaCl =6 эВ), а для полупроводников достаточно узка (для германия =0,72 эВ). При температурах близких к 0 К полупроводники ведут себя как диэлектрики, то есть переброс электронов в зону проводимости не происходит.
Сущность зонной теории проводимости заключается в следующем:
1). При объединении атомов в кристалл твердого тела возникают энергетические зоны.
2). Ширина запрещенных зон и характер заполнения электронами разрешенных зон обуславливают электрические свойства твердого тела – оно может быть или металлом, или полупроводником, или диэлектриком.
Читайте также:
