Металлическая связь примеры веществ
Обновлено: 15.05.2024
Химическая связь - это взаимодействие между молекулами вещества, которые отвечают за его устойчивость и цвет. Кроме этого, межмолекулярное соединение - это способ взаимодействия между молекулами, имеющими заряд.
- Типы химических связей
- Одноэлектронная химическая связь
- Ковалентное соединение молекул
- Металлическая связь
- Ионное соединение
- Ван-дер-ваальсово соединение молекул
- Двухэлектронная трехцентровая связь
- Кристаллическая решетка
- Полярность (+ или -).
- Прочность (возможность удерживать вокруг себя определенное количество атомов).
- Длина (количество атомов, соединенных в одну цепочку).
Типы химических связей
- Одноэлектронное межмолекулярное соединение.
- Ковалентная связь.
- Металлическая.
- Ионно-водородная.
- Ван-дер-ваальсова.
- Двухэлектронная трехцентровая.
- Одноэлектронная.
- Ковалентная.
- Металлическая.
- Ионная.
Одноэлектронная химическая связь
- Отсутствие перекрытий атомных орбиталей.
- Отсутствие пары для электронов.
- Отсутствие взаимодействия между спинами электронов.

Ковалентное соединение молекул
- Ковалентной полярной.
- Ковалентной неполярной.
Металлическая связь
Металлическая связь между молекулами появляется среди катионов, имеющих положительный заряд, и находятся они в кристаллической решетке, которая, в свою очередь, образуется при помощи движущегося электрона. Данным химическим соединением обладают многочисленные сплавы металлов и сами металлы.
Важно! За счет того, что катионы и электроны валентного типа передвигаются, в незаполненных ими промежутках создается взаимодействие, обладающее электростатическим характеристиками, что и создает металлическое соединение молекул.
Длина ковалентной связи, например, для Ме2 составляет 2,67 ангстрем, для Na - 3,08 ангстрем. В то время как постоянная решетка составляет 3,502 ангстрем для Me и 4,282 для Na.
- Кубической объемно-центрированной. Такую решетку имеют: Pb, K, Na.
- Кубической гранецентрированной. Данной решеткой обладают: Ni, Ag, Rh.
- Гексагональной. Ее имеют: Mg, Cd, Re.

Ионное соединение
Ван-дер-ваальсово соединение молекул
Химические связи данного типа считаются самыми слабыми из всех существующих. Происходит образование данной связи только в том случае, если между собой связываются молекулы, у которых оболочка атома полностью заполнена - N2, Cl2, NH3. Второе название данной связи - слабые межмолекулярные. Они заметно отличаются от других типов связей. Например: для того, чтобы удерживать молекулы хлора в хлоре, необходима сила, которая почти в 10 раз выше, чем необходимая для удержания Cl2. Расстояние между ядрами почти в 2 раза больше, чем у ковалентной связи.

Двухэлектронная трехцентровая связь
Двухэлектронное трехцентровое соединение относится к классу электронно-дефицитных связей. Характеризуется оно тем, что одна пара валентных электронов локализуется в сфере действия сразу трех атомов. Это соединение является наименее изученным, поэтому много сказать о нем невозможно. О том, как образуются связи данного типа, можно прочитать в теории молекулярных орбиталей.
Металлическая связь: механизм образования и примеры
В одноатомном состоянии при обычных условиях находятся только благородные газы. Остальные же элементы не существуют в виде индивидуальном, так как имеют возможность взаимодействовать между собой или с другими атомами. При этом образуются более сложные частицы.
Совокупность атомов может образовать следующие частицы:
- молекулы;
- молекулярные ионы;
- свободные радикалы.
Типы химического взаимодействия
Взаимодействие между атомами называют химической связью. Основой являются электростатические силы (силы взаимодействия электрических зарядов), которые действуют между атомами, носителями этих сил являются ядро атома и электроны.
Это интересно: полярная и неполярная ковалентная связь — что это?
Электронам, находящимся на внешнем энергетическом уровне, отведена основная роль в образовании химических связей между атомами. Они наиболее удалены от ядра, а, следовательно, связаны с ним наименее прочно. Их называют валентными электронами.
Частицы взаимодействуют между собой различными способами, что приводит к образованию молекул (и веществ) разного строения. Различают следующие типы химической связи:
- ионная;
- ковалентная; ;
- вандерваальсова;
- металлическая.
Говоря о различных типах химического взаимодействия между атомами, стоит помнить о том, что все типы одинаково основаны на электростатическом взаимодействии частиц.
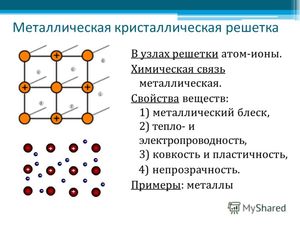
Металлическая химическая связь
Как видно из положения металлов в таблице химических элементов, они, в большинстве своём, обладают небольшим числом валентных электронов. Электроны связаны со своими ядрами достаточно слабо и легко отрываются от них. В результате этого образуются положительно заряженные ионы металла и свободные электроны.
Эти электроны, свободно перемещающиеся в кристаллической решётке, называют «электронным газом».
На рисунке схематично изображено строение вещества металла.
То есть в объёме металла атомы постоянно превращаются в ионы (их называют атом-ионами) и наоборот ионы постоянно принимают электроны из «электронного газа».
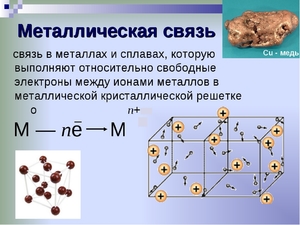
Механизм образования металлической связи можно записать в виде формулы:
атом M 0 — ne ↔ ион M n+
Таким образом, металлы представляют собой положительные ионы, которые расположены в кристаллической решётке в определённых положениях, и электроны, которые могут достаточно свободно перемещаться между атом-ионами.
Кристаллическая решётка представляет «скелет», остов вещества, а электроны перемещаются между её узлами. Формы кристаллических решёток металлов могут быть различными, например:
- объёмно-центрическая кубическая решётка характерна для щелочных металлов;
- гранецентрическую кубическую решётку имеют, например, цинк, алюминий, медь, другие переходные элементы;
- гексагональная форма типична для щёлочноземельных элементов (исключением является барий);
- тетрагональная структура — у индия;
- ромбоэдрическая — у ртути.
Пример кристаллической решётки металла показан на картинке ниже.
Отличия от других видов

Отличается металлическая связь от ковалентной по прочности. Энергия металлических связей меньше, чем ковалентных в 3−4 раза и меньше энергии ионной связи.
В случае с металлической связью, нельзя говорить и о направленности, ковалентная связь строго направлена в пространстве.
Такая характеристика, как насыщаемость также не характерна для взаимодействия между атомами металлов. В то время как ковалентные связи являются насыщаемыми, то есть количество атомов, с которыми может произойти взаимодействие, строго ограничено количеством валентных электронов.
Схема связи и примеры
Процесс, происходящий в металле можно записать с помощью формулы:
Если описывать более подробно, металлическую связь, как образуется этот тип связи, необходимо рассматривать строение внешних энергетических уровней элемента.
В качестве примера можно рассмотреть натрий. Имеющийся на внешнем уровне единственный валентный 3s электрон может свободно перемещаться по свободным орбиталям третьего энергетического уровня. При сближении атомов натрия, происходит перекрывание орбиталей. Теперь уже все электроны могут перемещаться между атом-ионами в пределах всех пререкрывшихся орбиталей.
У цинка на 2 валентных электрона приходится целых 15 свободных орбиталей на четвёртом энергетическом уровне. При взаимодействии атомов эти свободные орбитали будут перекрываться, как бы обобществляя электроны, которые по ним перемещаются.
У атомов хрома валентных электронов 6 и все они будут участвовать в образовании электронного газа и связывать атом-ионы.
Свойства металлов

Особый вид взаимодействия, который характерен для атомов металлов, определяет ряд объединяющих их свойств и отличающих металлы от других веществ. Примерами таких свойств являются высокие температуры плавления, высокие температуры кипения, ковкость, способность отражать свет, высокая электропроводность и теплопроводность.
Высокие температуры плавления и кипения объясняются тем, что катионы металла прочно связаны электронным газом. При этом прослеживается закономерность, что прочность связи увеличивается с увеличением количества валентных электронов. Например, рубидий и калий являются легкоплавкими веществами (температуры плавления 39 и 63 градуса Цельсия, соответственно), по сравнению с, например, хромом (1615 градусов Цельсия).
Равномерностью распределения валентных электронов по кристаллу объясняется, например, такое свойство металлов, как пластичность — смещение ионов и атомов в любых направлениях без разрушения взаимодействия между ними.
Свободное перемещение электронов по атомным орбиталям объясняет и электропроводность металлов. Электронный газ при наложении разности потенциалов переходит из хаотического движения к движению направленному.
В промышленности часто используют не чистые металлы, а их смеси, называемые сплавами. В сплаве свойства одного компонента обычно удачно дополняют свойства другого.
Металлический тип взаимодействия характерен как для чистых металлов, так и для их смесей — сплавов, находящихся в твёрдом и жидком состояниях. Однако, если металл перевести в газообразное состояние, то связь между его атомами будет ковалентная. Металл в виде пара состоит и отдельных молекул (одно- или двухатомных).

Металлическая связь образуется между атомами в кристалле металла, возникающая за счет перекрытия валентных электронов. Так, что же представляет собой этот вид связи, и в каких соединениях она присутствует?
Что такое металлическая связь?
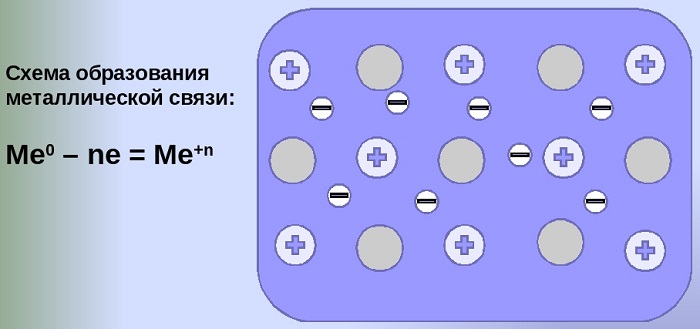
Металлическая химическая связь существует в металлическом кристалле и в жидком расплавленном состоянии. Ее образуют элементы, атомы которых на внешнем уровне имеют мало электронов (1-3) по сравнению с общим числом внешних, энергетически близких орбиталей.

Рис. 1. Схема образования металлической связи.
Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Так, у атома натрия на один валентный электрон (3S1) приходится 9 свободных и энергетически близких орбиталей (одна 3s, три 3p и пять 3d).
Из-за малого значения энергии ионизации валентный электрон слабо удерживается и свободно перемещается не только в пределах 9 своих свободных орбиталей, но при плотной упаковке в кристалле и на свободных орбиталях других атомов, осуществляя связь.
Химическая связь сильно делокализована: электроны обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального, между положительно заряженными ионами.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро- и теплопроводность.
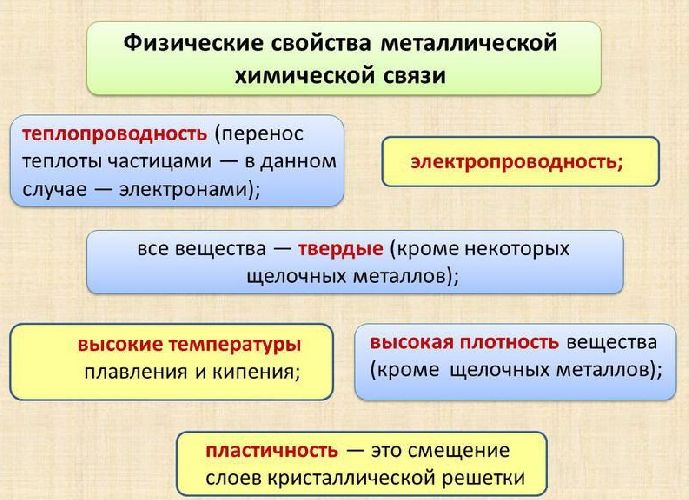
Рис. 2. Свойства металлической химической связи.
Характерные кристаллические решетки
Металлы почти всегда образуют высокосимметричные решетки с плотно приближенными друг к другу атомами. Выделяют три вида кристаллических решеток:
- кубическая объемно центрированная. В таком виде решетки атомы располагаются на вершине куба и один атом в центре объема куба. Такую решетку имеют следующие металлы: натрий, литий, барий, калий, свинец и многие другие.
- кубическая гранецентрированная.
- гексагональная. В таком виде решетки атомы располагаются в вершине и центрах шестигранной оснований призмы, а три атома находятся в средней плоскости этой призмы.
Такой тип кристаллической решетки имеют следующие металлы: магний, кадмий, рений, осмий, рутений, бериллий и многие другие.
Что мы узнали?
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами. В данной статье дается определение понятию «металлическая связь», а также приведены примеры металлической химической связи.
Физические свойства металлов

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
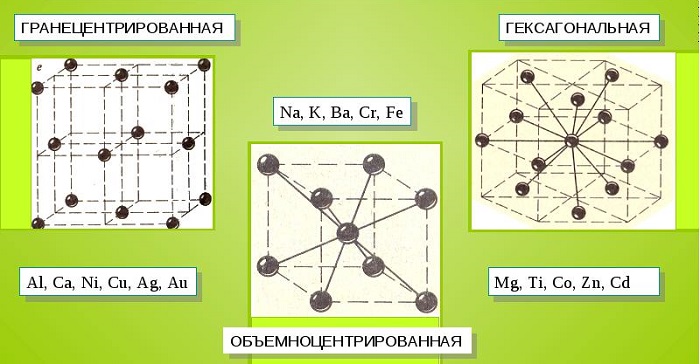
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
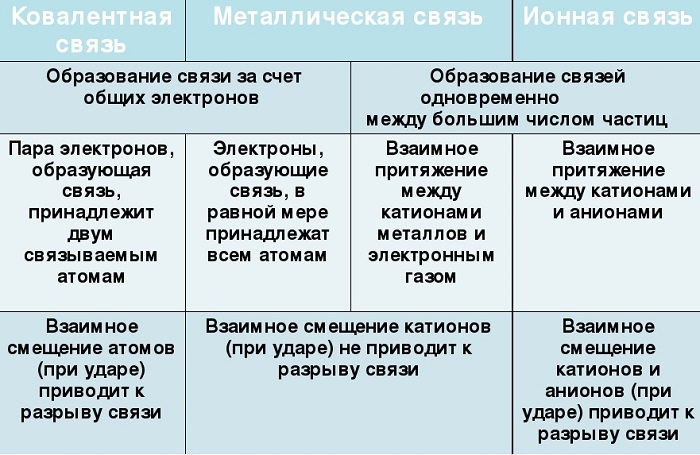
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Читайте также:
