Металлическая связь является ненаправленной локализованной
Обновлено: 27.09.2024
Вещества с металлическими связями - металлы - обладают рядом особых свойств. К ним относятся высокие тепло- и электропроводность, сплошной спектр поглощения света, а также высокая пластичность многих металлов и образование между ними соединений, не отвечающих валентностям. Эти свойства говорят о том, что металлическая связь делокализована, имеет множество близко расположенных электронных состояний и ненаправленна. Некоторые из этих свойств были описаны моделью свободных электронов и методом МО.
Модель свободных электронов.В этой модели металл представляется как совокупность катионов, образующих остов, как бы погруженных в электронную жидкость, частицы которой (электроны) свободно перемещаются между катионами. Энергия связи определяется как кулоновское взаимодействие между катионами и электронами. Эта теория хорошо описывает свойства щелочных металлов. В частности, структура металлов определяется тем, что минимум энергии системы достигается при плотнейшей упаковке катионов, что имеет место при координационных числах 8 и 12; при этом связь оказывается ненаправленной, так как изменения в геометрии расположения атомов и даже изменения координационного числа в указанных пределах мало изменяют энергию связей. Эта модель, однако, плохо объясняет свойства других металлов и спектры металлов.
Теория молекулярных орбиталей (МО) для металлов.Теория МО для металлов объясняет все их свойства. В этой теории кристалл металла рассматривается как гигантская молекула из N атомов, в которой все атомы взаимодействуют друг с другом (а не только соседние). В этом случае МО будут охватывать весь кристалл. Сами МО образуются путем линейной комбинации АО всех N атомов:
При этом из N АО образуются N МО. Расчетным и экспериментальным путем (по спектрам) показано, что разница в энергиях (DЕ) между самой нижней и самой высокой Y составляет величину порядка обычной химической связи (несколько сотен кДж/моль). Тогда расстояние между соседними МО будет очень малой величиной порядка 10 - 18 Дж/моль () (рис. 3.26).
Если взять, например, N атомов Li, имеющих по одному валентному электрону на одной атомной орбитали (2s 1 ), то при их взаимодействии образуется столько же МО. Так как на каждой МО может быть 2ē, то лишь половина МО будет занята. Расстояние между соседними МО - dЕ - чрезвычайно мало, поэтому поглощение любого кванта энергии (даже тепловой или энергии внешнего поля) вызывает возбуждение электрона; это объясняет сплошной спектр и высокую подвижность электронов.
В случае металлов с полностью заполненными подуровнями (Ве: 2s 2 2р 0 ) имеет место перекрывание зон 2s-и 2р-МО и картина, показанная на рис 3.26, сохраняет свой вид (близкое расположение пустых и заполненных мест), так как обычно соседние пустая и заполненная зоны перекрываются (2s2р).
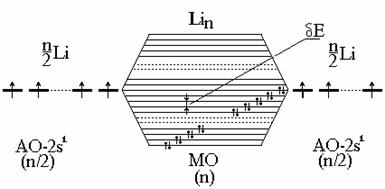
Рис. 4.26. Образование почти сплошной зоны МО в металлах
В случае металлов с незаполненными d-подоболочками d-d-взаимодействие приводит к образованию локализованных и направленных ковалентных МО. Этим объясняются высокая твердость и высокие температуры плавления таких металлов. Аналогичная ситуация и в случае f-металлов.
Таким образом, молекулярные орбитали металла образуют почти непрерывную зону разрешенных энергий (этим, в частности, объясняется непрерывный, а не линейчатый, как у атомов, или полосатый, как у молекул, спектр поглощения металлов). Разность между верхней и нижней энергиями (DЕ) зоны называется шириной зоны. Зона, заполненная электронами, называется валентной.Зона, свободная от электронов и находящаяся выше валентной зоны, - зона проводимости. Они могут либо перекрываться, либо не перекрываться друг с другом. Если эти зоны не перекрываются, то между ними существует запрещенная зона с шириной DЕ.
Ширина запрещенной зоны определяет тип кристалла: металл, полупроводник или диэлектрик (рис. 4.27).
а б в
Рис. 4.27. Зонная структура металлов (а), полупроводников (б)
и диэлектриков (в)
(верхняя зона – зона проводимости, нижняя – валентная зона)
Теория, с помощью которой объясняют свойства кристаллов, получила название зонной теории. При ширине запрещенной зоны ниже
4 эВ кристаллические вещества проявляют полупроводниковые свойства. При поглощении энергии электроны валентной зоны возбуждаются и переходят в зону проводимости, а в валентной зоне появляются вакансии электронов, которые имеют эффективный положительный заряд; их называют дырками. Наличие подвижных электронов и дырок обеспечивает собственную проводимость полупроводников. Собственную проводимость имеют, например, кремний и германий.
У диэлектриков ширина запрещенной зоны превышает 4 эВ. Для возбуждения электронов требуется очень значительная энергия, нагреванием такого возбуждения достичь невозможно, так как при этом кристалл либо расплавится, либо разрушится.
К диэлектрикам относятся многие вещества с ионными и молекулярными кристаллами, а также некоторые вещества с ковалентными кристаллами, например алмаз (DЕ = 5,1 эВ) и кварц (DЕ = 5,2 эВ).
4.8. Кристаллические решетки
Если вещество образует молекулы, полярные или неполярные, то его кристаллы обычно построены из молекул, т.е. имеют молекулярную решетку.Силы, действующие между молекулами, сравнительно слабые. Поэтому вещества с молекулярной решеткой имеют малую твердость, низкие температуры плавления, плохую растворимость в воде. При обычных условиях это, как правило, газы или жидкости.
Среди сложных веществ это большинство органических веществ, которые находятся при обычных условиях в твердом состоянии.
Из неорганических соединений это - твердый СО2 (сухой лед), вода (лед), твердые галогеноводороды и многие другие.
Для молекулярных веществ характерна следующая закономерность: вещества с большей молекулярной массой имеют более высокие температуры плавления и кипения.
Вещества с ионным типом связи часто образуют ионные решетки. Это, как правило, ионные проводники, растворяющиеся в полярных растворителях. Они тугоплавки, малолетучи, сравнительно прочны.
Если вещество не является ионным, но и не образует молекул, все связи оказываются одинаково прочными. Образуется атомная кристаллическая решетка. Вещества с атомной решеткой имеют высокие температуры плавления, высокую прочность и твердость. Они практически нерастворимы в воде и других жидкостях. Атомная решетка характерна для бора, углерода, кремния, германия, некоторых соединений этих элементов с другими (BN, SiO2 и др.).
5 примеров металлической связи: объяснение и подробные факты
В этой статье мы подробно рассмотрим металлическую связь, ее характеристики и факты, а также некоторые примеры металлической связи.
- Натрий
- алюминий
- магниевый
- Медь
- Утюг
В одном из геометрических расположений, таких как центральное кубическое расположение тела, гексагональная плотноупакованная или центрально-кубическая плотноупакованная грань, металл состоит из положительных ионов. Отрицательно заряженные делокализованные электроны удерживают положительно заряженные ионы вместе в кристаллической решетке. Следовательно, положительные и отрицательные заряды уравновешиваются.
Согласно теории электронного облака, металлическая связь представляет собой электростатические силы притяжения между положительно заряженными ионами металлов, заключенными в море отрицательно заряженных мобильных электронов. Как показано на рисунке.
Кредиты изображений: Wikimedia
Характеристики металлической связки
- Металлы могут проводить через них тепло. Когда один конец металла нагревается, подвижные электроны поглощают тепловую энергию и быстро движутся к другому концу, поэтому металл проявляет теплопроводность.
- Металлы также являются хорошими проводниками электричества, так как в них присутствуют свободные электроны, которые переносят ток.
- Металлы непрозрачны, и они также имеют металлические кластеры.
- Металлы пластичны и податливы.
- Металлы проявляют свойство блеска, так как подвижные электроны поглощают и излучают видимые световые излучения.
- Металлическая связь возникает в твердом состоянии вещества.
- Металлам требовались высокие температуры для разрыва связей между ними, поэтому они имели высокие температуры плавления и кипения.
Металлическая связка Примеры
Натрий (Na)
Атом натрия имеет один электрон на валентной оболочке. Когда более одного атома натрия располагаются в кристаллической решетке (ОЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другим атомом натрия, образуются молекулярные орбитали. Валентные электроны, находящиеся на внешней оболочке атома, распределяются в пространственной решетке металла. это металлик пример облигации.
Положительно заряженные ионы металла натрия и отрицательно заряженные электроны соединяются вместе, образуя металлические связи.
Кредиты изображений: химик
Алюминий (Al)
Атом алюминия имеет три электрона на валентной оболочке. Когда атомы алюминия располагаются в кристаллической решетке (ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другими атомами алюминия, и образуются молекулярные орбитали. Эти электроны делокализованы в пространственной решетке. По мере увеличения числа валентных электронов становится доступным больше свободных электронов. Это пример металлической связи. Металлическая связь, образованная между положительно заряженными ионами металла алюминия и электронами.
Изображение Кредиты: химик
Магний (Mg)
Атом магния имеет два валентных электрона. Когда атомы магния располагаются в кристаллической решетке (ГПУ), электроны, присутствующие в валентной оболочке, делят пространство с другими атомами магния, и образуются молекулярные орбитали. Электроны, находящиеся на валентной оболочке, могут свободно перемещаться в кристалле. Металлическая связь, образованная между положительно заряженными ионами металлического магния (2 + ) и электроны. следовательно, это пример металлической связи.
Медь (Cu)
Один электрон находится на внешней оболочке атома меди. Когда более одного атома меди располагаются в кристаллической решетке (ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другим атомом меди, образуются молекулярные орбитали. Электроны, находящиеся на валентной оболочке, распределяются в междоузлиях металлического кристалла. Они могут свободно двигаться. Это пример металлической связки. В качестве металлической связи, образованной между ионами металла меди и электронами.
Железо (Fe)
Атом железа имеет восемь электронов в своей электронной оболочке. Когда атомы железа располагаются в кристаллической решетке (ОЦК и ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другими атомами железа, и образуются молекулярные орбитали. Делокализация этих электронов происходит в междоузельном пространстве. Чем больше электронов, не связанных с атомами, становится доступным по мере увеличения числа валентных электронов. Это пример металлической связи. Металлическая связь, образованная между положительно заряженными ионами металла железа и электронами.
Часто задаваемые вопросы:
Вопрос 1. Что такое металлическое соединение?
Ответ: Металлическая связь может быть определена как
Сила притяжения существует между отрицательно заряженными подвижными электронами и положительно заряженными ионами металлов. Эта сила притяжения используется для удержания атомов металла вместе в металлическом кристалле.
Вопрос 2 . Растворяются ли металлические связи в воде?
Ответ: Растворимость металлических связей в воде
Металлические связи не растворяются в воде, но некоторые щелочные металлы, натрий и калий, растворяются в воде.
Вопрос 3. Являются ли металлические связи прочными?
Ответ: Да, металлические связи не являются слабыми связями.
Поскольку металлы требуют высоких температур для плавления и кипения. Для разрыва связей между атомами металла требуется большое количество энергии, поэтому они считаются прочными связями.
Вопрос 4. В чем разница между металлической и ковалентной связью?
Я Смрути Бхосале. Я из Мумбаи. У меня есть степень магистра неорганической химии в колледже Гуру Нанак Хальса в Мумбаи. Я всегда страстно пишу и вдохновляю своими словами как можно больше желающих. Химия - это предмет, который используется всеми в их обычной жизни. Я хочу объяснить предмет максимально понятным и простым способом. Я творческий, трудолюбивый человек и люблю узнавать новое. Я люблю читать книги.
Последние посты
Гидроксид калия или едкий калий является неорганическим компонентом. Его молярная масса составляет 56.11 г/моль. Давайте резюмируем структуру КОН Льюиса и все факты в деталях. КОН представляет собой простой гидроксид щелочного металла.
Слово «еще» в основном служит в значении «до сих пор» или «тем не менее» в предложении. Проверим употребление слова «пока» в значении «союз». Слово "пока" можно обозначить как "координационное.
О НАС
Мы являемся группой профессионалов отрасли из различных областей образования, таких как наука, инженерия, английская литература, и создаем универсальное образовательное решение, основанное на знаниях.
металлическая связь
химическая связь, обусловленная взаимодействием «электронного газа» (валентные электроны) металлов с остовом положительно заряженных ионов кристаллической решётки. По природе близка к ковалентной связи. Характерна для металлов, их сплавов, металлидов; сохраняется не только в твердых кристаллах, но и в расплавах и аморфном состоянии.
МЕТАЛЛИ́ЧЕСКАЯ СВЯЗЬ, вид химической связи атомов в веществах, обладающих металлическими свойствами.
Кристалл с металлической связью можно представить себе как решетку из положительно заряженных атомных ядер, погруженных в отрицательно заряженный «газ», состоящий из свободных электронов, который удерживает положительно заряженные ионы на определенных расстояниях друг от друга. От каждого атома может оторваться несколько свободных электронов и все эти электроны обобществляются.
Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла, и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри решетки, т. е. они уже принадлежат не одному атому, как в случае ионной связи (см. ИОННАЯ СВЯЗЬ) , и не паре соседних атомов, как в случае ковалентной связи (см. КОВАЛЕНТНАЯ СВЯЗЬ) , а всему кристаллу в целом. Не имея локализованных связей, металлические кристаллы ( в отличие от ионных) не разрушаются при изменении положения атомов, т. е. им свойственна пластичность (ковкость) при деформациях.
Металлическая связь сферически симметрична. Для металлических кристаллов характерны большие координационные числа (см. КООРДИНАЦИОННОЕ ЧИСЛО) , плотные упаковки частиц.. Благодаря наличию свободных электронов металлы обладают высокими электро- и теплопроводностью.
Энциклопедический словарь . 2009 .
Полезное
Смотреть что такое "металлическая связь" в других словарях:
Металлическая связь — Металлическая связь это одновременное существование положительно заряженных атомов и свободного электронного газа. Содержание 1 Механизм металлической связи 2 Характерные кристаллические решётки … Википедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — тип хим. связи атомов в в вах, обладающих металлич. св вами. М. с. обусловлена большой концентрацией в таких кристаллах эл нов проводимости. Отрицательно заряженный «электронный газ» удерживает положительно заряженные ионы на определённых… … Физическая энциклопедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, в химии связь, удерживающая вместе атомы МЕТАЛЛА. Внутри кристаллов металлов положительно заряженные ионы держаться посредством электростатического притяжения облака окружающих электронов, которые могут двигаться под… … Научно-технический энциклопедический словарь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — особый тип хим. связи атомов в металлах и интерметаллических соединениях, обусловленный высокой концентрацией в кристаллах электронов проводимости. Отрицательно заряженное электронное облако удерживает положительно заряженные ионы на определённых … Большая политехническая энциклопедия
металлическая связь — [metal bond] межатомная связь, характерная для металлов с равномерной плотностью электронного газа. Металлическая связь обусловлена взаимодействием отрицательно заряженного электронного газа и положительно заряженных ионных остовов,… … Энциклопедический словарь по металлургии
металлическая связь — metališkasis ryšys statusas T sritis chemija apibrėžtis Delokalizuoto cheminio ryšio tipas, esantis visuose metaluose. atitikmenys: angl. metallic bond rus. металлическая связь … Chemijos terminų aiškinamasis žodynas
металлическая связь — metališkasis ryšys statusas T sritis fizika atitikmenys: angl. metallic bond vok. metallische Bindung, f rus. металлическая связь, f pranc. liaison métallique, f … Fizikos terminų žodynas
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь, возникающая при образовании химического соединения из металлических элементов. Химический состав этих соединений из за нежесткой металлической связи непостоянен и не соответствует стехиометрическому соотношению элементов по формуле данного … Металлургический словарь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель М. с. отвечает образованию частично заполненных валентными электронами металла зон … Химическая энциклопедия
Металлическая связь — тип связи атомов в кристаллических веществах, обладающих металлическими свойствами (металлах (См. Металлы), металлидах (См. Металлиды)). М. с. обусловлена большой концентрацией в таких кристаллах квазисвободных электронов (электронов… … Большая советская энциклопедия
ХИМИЧЕСКАЯ СВЯЗЬ
Свойства химической связи проявляются в свойствах различных типов молекул, кристаллов и других объединений атомов и молекул. Ранее считалось, что и природа различных видов связи (ковалентной, ионной, металлической, водородной и др.) различна. Сегодня можно считать, что известные на сегодня виды химической связи едины по своей природе. Поэтому существует возможность единой их классификации. Химическую связь можно подразделить на различные виды.
В зависимости от расстояния, на котором проявляется химическая связь, ее делят на короткодействующую и дальнодействующую.

Короткодействующая связь проявляется на расстояниях, близких к размерам атомов. Она осуществляется между атомами в молекуле, кристалле в пределах от 74 до 400 пм. Энергия разрыва короткодействующей химической связи находится в пределах от 40 до 1000 кДж/моль. В таблице приведены длины и энергии разрыва отдельных видов таких связей.
Образование большинства известных молекул, существующих в изолированном состоянии, обусловлено наличием короткодействующих связей. Данный вид связи называют также сильной связью.
Дальнодействующая химическая связь проявляется при переходе вещества из газовой фазы в жидкое или твердое состояние. Она возникает между отдельными атомами, молекулами на расстояниях в несколько раз больших, чем длина обычной короткодействующей связи. Например, между молекулами хлора образуется связь длиной 334 пм, а между молекулами воды - 180 пм. Как можно видеть из сравнения этих значений с данными таблицы, подразделение на короткодействующие связи и дальнодействующие довольно условно и носит относительный характер. То есть в талом делении связей на виды нужно подразумевать одинаковые комбинации атомов в связи. Например, короткодействующая связь между атомами хлора имеет длину 199 пм, а длина дальнодействующей - 334 пм. Прочность же дальнодействующей связи в десятки раз меньше прочности короткодействующей связи. Дальнодействующую связь также называют слабой или межмолекулярной связью.
Хотя природа этих двух видов связи одинакова, но отличия имеются. Короткодействующие связи образуются в результате такого взаимодействия, что каждый электрон может быть описан самостоятельной волновой функцией - одноэлектронное приближение. Дальнодействующие же связи являются результатом коллективного движения электронов.
Дальнодействующая химическая связь условно может быть разделена на два типа:
- универсальная межмолекулярная связь;
- специфическая межмолекулярная связь.
Универсальная связь проявляется при взаимодействии между любыми молекулами, а специфическая - между теми, у которых имеются соответствующие друг другу участки. Такие молекулы, которые соответствуют друг другу как «к каждому замку должен быть свой ключ», называются комплементарными.
Самые устойчивые объединения атомов в молекулы осуществляются за счет короткодействующей химической связи. Характерными признаками такой связи обладают четыре ее вида:
- ковалентная;
- ионная;
- делокализованная ковалентная;
- металлическая.
Главное отличие ионной связи от ковалентной заключается в том, что ковалентная связь образуется в чистом виде между совершенно эквивалентными атомами, а ионная - между атомами, резко отличающимися по своим основным характеристикам, таким как энергия ионизации, сродство к электрону, размерам и др.
Степень перераспределения электронной плотности
Каждый из перечисленных видов химической связи может видоизменяться в зависимости от различных признаков. Если в качестве такого признака выбрать степень перераспределения электронной плотности между атомами при образовании химической связи, то можно выделить связи: неполярную, полярную и сильно полярную. Неполярная и полярная короткодействующая химическая связь является тем видом связи, который хорошо известен как ковалентная химическая связь. Сильно полярная химическая связь представлялась независимой от ковалентной связи и исторически получила название ионной.
Степень обобществления электронной плотности
В зависимости от степени обобществления электронной плотности химической связи между несколькими атомами различают локализованную и делокализованную химическую связь.
называется такая химическая связь, электронная плотность которой сконцентрирована (локализована) в пределах двух наиболее близко расположенных друг к другу ядер атомов.
Если электронная плотность химической связи распределена между тремя и более ядрами, то такая связь называется трехцентровой, многоцентровой, а в общем случае - . Характер делокализации электронов химической связи может, в свою очередь, различаться по размерности пространства. Существуют связи, делокализованные в одном измерении, делокализованные в плоскости и делокализованные в трехмерном пространстве. Хорошо известная металлическая связь с позиций изложенной классификации является короткодействующей и дальнодействующей, неполярной, в высшей степени делокализованной (в трех измерениях) связью.
Обеспечение связи
Различают также виды связи по их свойству обеспечивать связь только между ограниченным числом атомов. Такие связи называются насыщаемыми. В противном случае говорят о ненасыщаемости химической связи. Также различают связи направленные и ненаправленные.
- такие связи, энергия которых сильно зависит от расположения данной связи относительно других связей вокруг выбранного атома.
считаются те, которые мало чувствительны к взаимной ориентации связей атома.
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Читайте также:
