Металлические и газовые электроды
Обновлено: 18.05.2024
тенциалом ( ϕ 0 ) и концентрацией (активностью) ионов, участвующих в реакции. В зависимости от особенностей электродных реакций различают несколько типов электродов.
Электроды первого рода . К электродам первого рода относятся металлические электроды, находящиеся в контакте с раствором, содержащим катионы этого же металла. Схематически электрод
первого рода можно представить как Me n + | Me 0 . Электродная реак-
ция, протекающая на нем:
Me n + + nē ↔ Me 0 .
Потенциал электрода первого рода зависит от концентрации ионов металла, которые являются потенциалопределяющими:
ϕ Me n + /Me =ϕ 0 Me n + /Me + RT nF ln C Me n + .
П р и м е р . 1 . Медный электрод погружен в раствор сульфата меди Cu 2+ | Cu 0 :
электродная реакция Cu 2+ + 2 ē Cu 0 ;
электродный потенциал ϕ Cu 2 + /Cu =ϕ 0 Cu 2 + /Cu + RT 2 F ln C Cu 2 + .
2. Серебряный электрод погружен в раствор нитрата серебра
электродная реакция Ag + + ē ↔ Ag 0 ,
электродный потенциал ϕ
Электроды первого рода являются обратимыми: изменение направления тока в цепи изменяет лишь направление реакции Me n + +
+ nē ↔ Me 0 , не изменяя саму реакцию:
(Me n + + nē → Me 0 – процесс восстановления; Me 0 → Me n + + nē – процесс окисления).
П р и м е ч а н и е. Существуют электроды первого рода, обратимые относительно аниона, например, Se 2- | Se 0 :
электродная реакция Se 0 +2 ē ↔ Se 2- ,
электродный потенциал ϕ Se 0 /Se 2- =ϕ Se 0 0 /Se 2- + RT 2 F ln C Se 2- .
Электроды второго рода. К электродам второго рода относятся металлические электроды, покрытые слоем труднорастворимого соединения этого же металла (MeAn), находящиеся в контакте с электролитом, содержащим такие же анионы (An n - ).
Схематически электрод можно представить как
An n - | MeAn,Me 0 .
Электродная реакция, протекающая на нем:
MeAn+ nē ↔ Me 0 + An n - .
Потенциал электрода второго рода определяется равновесием двух процессов:
1) равновесие «труднорастворимое соединение–раствор электролита», которое определяет концентрацию иона металла:
; ПР = C Me n + C An n − → C Me n + =
где ПР – произведение растворимости труднорастворимого соединения MeAn;
2) равновесие «металл−катион металла» Me n + + nē ↔ Me 0 , которое определяет возникновение электродного потенциала:
ϕ Me n + /Me =ϕ 0 Me n + /M e + RT nF ln C Me n + .
Потенциал электрода будет определяться суммарным уравне-
нием MeAn+ nē ↔ Me 0 + An n − :
+ RT lnПР − RT ln C
Таким образом, потенциал электрода второго рода зависит от концентрации аниона (потенциалопределяющий ион An n − ):
ϕ MeA n /Me,An n − =ϕ 0 MeAn/Me,An n − − RT nF ln C An n − ,
где ϕ 0 MeAn/Me,An n − =ϕ 0 Me n + /Me + RT nF lnПР.
П р и м е р. Хлорсеребряный электрод AgCl,Ag 0 | Cl - . Металлический серебряный электрод, на поверхность которого
нанесен тонкий слой труднорастворимой
соли хлорида серебра (ПР AgCl
контактирует с раствором сильного элек-
Рис. 8.5. Схема хлорсе-
AgCl + ē ↔ Ag 0 + Cl - ,
Газовые электроды . Газовый электрод представляет собой металлический проводник, на поверхности которого адсорбированы молекулы газа, который находится в контакте с электролитом, содержащим ионы этого же газа. В системе устанавливается равновесие между молекулами газа, находящимися на поверхности металлического электрода, и ионами этого газа в электролите. Металлический проводник служит только для передачи электронов между внешней цепью и раствором (создает электропроводящий контакт между газом и раствором). При этом материал электрода не должен участвовать в электрохимическом равновесии. Как правило, такими материалами являются металлы платиновой группы, в частности сама платина. Они не принимают непосредственного участия в реакциях с раствором и в то же время, являясь гетерогенными катализаторами, ускоряют установление электродного равновесия.
Наиболее важными с практической точки зрения являются водородный и кислородный электроды.
Водородный электрод (2H + | H 2 0 ,Pt) представляет собой платиновый электрод, помещенный в раствор, содержащий ионы водорода (раствор серной кислоты), через который пропускают газообразный водород (рис. 8.6).
На границе раздела «платина–раствор серной кислоты» устанавливается равновесие 2H + + 2ē↔ H 2 и возникает электродный
потенциал, величина которого зависит от относительного парциального давления газа и концентрации ионов водорода:
Основные типы электродов и расчет их потенциала
В зависимости от природы электродной реакции различают следующие типы электродов.
1) Электроды I рода – представляют собой металл или неметалл, погруженный в раствор, содержащий его ионы.
Металлические электроды I рода схематически можно записать:
В основе работы электрода I рода лежит реакция:
Применим уравнение Нернста (192) для расчета потенциала электрода:
В электрохимии стандартные состояния выбирают таким образом, что активность нейтральных металлов , тогда:
Потенциал металлического электрода I рода определяется термодинамической активностью ионов данного металла в растворе, поэтому электроды I рода обратимы относительно катиона. К металлическим электродам I рода относят цинковый, медный электроды и т.д.
2) Электроды II рода – представляют собой металлическую пластину, покрытую слоем малорастворимой соли данного металла и погруженную в раствор, содержащий анионы малорастворимой соли:
В основе работы электрода II рода лежит реакция:
Применяя уравнение Нернста с учетом выбранного стандартного состояния, получаем:
Как видно, потенциалопределяющими ионами являются анионы малорастворимой соли, поэтому электроды II обратимы относительно аниона. Электроды II рода характеризуются хорошей воспроизводимостью и на практике часто применяются в качестве электродов сравнения, в частности, при измерении растворов. Например, хлорсеребряный и каломельный электроды.
3) Газовые электроды – электроды, состоящие из инертного металла (обычно платины), контактирующего одновременно с газом и раствором, содержащим ионы газообразного вещества.
Например, водородный электрод, представляет собой платиновую пластинку, покрытую слоем электролитической платины (для обеспечения достаточной площади контакта) и погруженную в раствор, содержащий ионы водорода, при этом через раствор непрерывно под давлением пропускают газ, содержащий молекулярный водород. Платина способна адсорбировать молекулярный водород.
В основе работы водородного электрода лежит реакция:
Применим уравнение Нернста
Термодинамическая активность молекулярного водорода определяется уравнением: . Парциальное давление молекулярного водорода при стандартных условиях , тогда термодинамическая активность молекулярного водорода равна его парциальному давлению . Тогда
Как видим, потенциал водородного электрода определяется как активностью ионов водорода, так и парциальным давлением водорода.
Если , и , то такой электрод является стандартным и его потенциал принят равным нулю:
При , учитывая, что , можно записать:
Потенциалы всех остальных электродов определяют по водородному.
4) Окислительно-восстановительные электроды (электроды III рода) – представляют собой пластину из инертного металла (например, платины), погруженную в раствор, содержащий окисленные и восстановленные формы веществ (ионов или молекул).
Уравнение для расчета потенциала электрода имеет вид:
5) Стеклянный электродпредставляет собой сосуд из тонкого стекла, обладающего повышенной электропроводностью, заполненный раствором, содержащим ионы водорода (соляная кислота), в который погружен электрод чаще II рода (обычно хлорсеребряный электрод).
В результате обмена ионов между стеклом и раствором на границе раздела фаз возникает скачок потенциала.
Потенциал электрода рассчитывают по уравнению:
, и , – химический потенциал и активность ионов водорода в растворе и стекле, соответственно.
Стеклянный электрод широко используют при измерении растворов. Стеклянные электроды применяют в качестве индикаторных в большинстве современных метров.
Классификация электродов по типу электродного процесса и назначению
По типу электродного процесса электроды делятся на электроды I рода, электроды II рода и окислительно-восстановительные.
Электроды I рода представляют собой металл или металлоид, погруженный в раствор своей соли.
Например, Cu в CuSO4. Схема записи: Cu 2+ /Cuº.
На этом электроде идет реакция Cu 2+ + 2ē → Cuº, которая определяет потенциал электрода. Потенциалопределяющие ионы – ионы Cu 2+ . Для медного электрода:
Если металл присутствует в чистом виде, а не в виде сплава или амальгамы, то аCu = 1 и z = 2. Тогда
Неметаллические электроды –электроды, состоящие из неметалла, погруженного в раствор, содержащий анионы этого неметалла.
Схематическая запись: Se 2– /Se 0
Электродная реакция:Se + 2e = Se 2–
Уравнение Нернста:
Газовые электроды–электроды, состоящие из инертного металла (обычно Pt), находящегося в одновременном контакте с газом и с раствором, содержащем ионы этого газа.
Схематическая запись: H + / H2 (Pt)
Электродная реакция: Н + + 1е = ½ Н 2
Уравнение Нернста:
Электроды II рода:
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор, содержащий анионы этой соли.
Окисленной формой является труднорастворимая соль, а восстановленной металл и анион соли. Электроды второго рода обратимы по аниону, т.е. их потенциал является функцией активности аниона.
Схему и потенциалопределяющую реакцию записывают следующим образом:
Потенциал электрода второго рода можно представить выражением:
Поскольку в чистых твердых фазах активность веществ МА и М принимают равной единице, то конечное уравнение имеет вид:
Электроды второго рода широко применяются в электрохимических измерениях в качестве электродов сравнения, так как их потенциал устойчив во времени и хорошо воспроизводится.
Примерами электродов второго рода могут служить хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод: Сl ̅ / AgCl, Ag.
Представляет собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор HCl.
Электродная реакция: AgCl + e ↔Ag + Cl – ;
Уравнение Нернста: для твердый фаз а AgCl = 1, a Ag = 1
Стандартный потенциал электрода при 298 К составляет 0,2223 В.
Каломельный электрод состоит из ртути, покрытой пастой, приготовленной из растёртой каломели Hg2Cl2 с ртутью, и раствора хлорида калия: Cl – | Hg2Cl2, Hg.
Электродная реакция: Hg2Cl2 +2е=2Hg+2Cl –
2) Металл, покрытый труднорастворимым гидроксидом или оксидом металла и опущенный в раствор растворимого гидроксида:
OH ̅ / Cd(OH)2, Cd или OH ̅ / HgO, Hg
Окислительно-восстановительные или редокс-электроды, состоят из инертного металла, например, платины, который не участвует в реакции, а является переносчиком электронов между окисленной и восстановленной формами вещества.
В общем виде схема электрода и уравнение потенциалопределяющей реакции записывается так:
Ox, Red│Pt; Ox+ze=Red
Потенциал их определяется:
Окислительно-восстановительные электроды бывают двух типов:
-простые Ох/Red электроды - электроды, в которых электродная реакция состоит в изменении заряда ионов.
Например: Fe 3+ , Fe 2+ / Pt. На этом электроде протекает реакция: Fe 3+ + ē → Fe 2+ .
-сложные Ох/Red электроды. В потенциалопределяющих реакциях сложных систем участвуют ионы Н + и молекулы воды.
Наример, хингидронный электрод.
Хингидрон представляет собой труднорастворимое соединение хинона и гидрохинона в соотношении 1:1, так называемая эквимолекулярная смесь. В растворе между хиноном и гидрохиноном протекает окислительно- восстановительная реакция:

Из последнего уравнения видно, что потенциал окислительно-восстановительного электрода зависит от активности ионов Н + в растворе. При условиях, обеспечивающих постоянство активностей других компонентов потенциалопределяющей реакции, такие окислительно-восстановительные электроды могут быть использованы как индикаторные при потенциометрическом определении рН растворов.
ЭЛЕКТРОДЫ I И II РОДА
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под электродом понимают лишь одну электронно-проводящую фазу. При пропускании тока от внешнего источника через систему из двух электродов, соединенных друг с другом через электролит, на электродах протекают два процесса: заряжение двойного электрического слоя и электрохимическая реакция.
В отличие от фазовых контактов металл-металл, металл-полупроводник, полупроводник-полупроводник и т. п. на фанице фаз, составляющих электрохимическую систему, вид носителей тока меняется, т. к. в электролите ток переносится ионами, а в электронно-проводящей фазе - электронами.
Непрерывность прохождения тока через фаницу фаз в этом случае обеспечивается электродной реакцией. Электрод называется анодом, если на его поверхности преобладает реакция, приводящая к генерированию электронов, т. е. происходит окисление веществ, содержащихся в электролите, либо ионизация металла анода. Электрод называется катодом, если с его поверхности электроны металла переходят на частицы реагирующих веществ, которые при этом восстанавливаются.
Классификация электродов проводится по природе окислителей и восстановителей, которые участвуют в электродном процессе. Электродом 1-го рода называют металл (или неметалл), погруженный в электролит, содержащий ионы этого же элемента. Металл электрода является восстановленной формой вещества, а его окисленной формой - простые или комплексные ионы этого же металла. Например, для системы СuСоответствующее такому электродному процессу Нернста уравнение для электродного потенциала Е имеет вид:
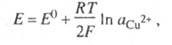
где E° - стандартный потенциал при т-ре Т; Tl(Hg). В такой системе могут изменяться концентрации и окисленной, и восстановленной форм, поэтому уравнение Нернста имеет вид:
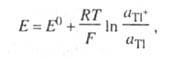
где aтl, - термодинамическая активность таллия в амальгаме.
Электроды 2-го рода - системы из металла М, покрытого слоем его же труднорастворимой соли (или оксида) и погруженного в раствор, содержащий анионы этой соли (для оксида -ионы ОН-). Окисленной формой является соль а восстановленная форма представлена металлом М и анионом A z- :

Уравнение Нернста имеет вид:
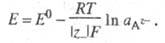
К электродам 2-го рода относятся многие электроды сравнения, например каломельный, хлорсеребряный, оксидно-ртутный.
Металл электрода может не участвовать в реакциях, а служить лишь передатчиком электронов от восстановленной формы вещества к окисленной; такие электроды называют окислительно-восстановительными или редокс-электродами. Например, платиновый электрод в растворе, содержащем ионы [Fe(CN)6] 4- и [Fe(CN)6] 3- , осуществляет перенос электронов между этими ионами в качестве передатчика (медиатора).
Среди окислительно-восстановительных электродов выделяют газовые электроды, состоящие из химически инертного металла (обычно Pt), к которому подводится электрохимически активный газ (например, Н2 или С12). Молекулы газа адсорбируются на поверхности металла, распадаясь на адсорбированные атомы, которые непосредственно участвуют в переносе электронов через границу раздела фаз.
Наиболее распространен водородный электрод, на поверхности которого образуются адсорбированные атомы Надс и устанавливается равновесие: Н2 2Надс 2Н+ + 2е. Различают типы электродов можно объединить в рамках так называемой концепции электронного равновесия на границе металл-электролит, согласно которой каждому равновесному электродному потенциалу соответствует определенная термодинамическая активность электронов в электролите.
Электроды называют идеально поляризуемым, если вследствие термодинамических или кинетических причин переход электронов через межфазную границу невозможен. При изменении потенциала такого электрода происходит только изменение строения двойного электрического слоя, что сопровождается протеканием тока заряжения, спадающего до нуля, когда перестройка двойного электрического слоя заканчивается. Для неполяризуемых, или обратимых, электродов переход электронов через границу фаз, напротив, незаторможен, и при пропускании тока через такой электрод его потенциал практически не изменяется.
По функциям в электрохимической системе электроды подразделяют на рабочие, вспомогательные и электроды сравнения. Рабочим называют электрод, на котором происходит исследуемый электрохимический процесс. Вспомогательный электрод (или противоэлектрод) обеспечивает возможность пропускания тока через электрохимическую ячейку, а электрод сравнения - возможность измерения потенциала рабочего электрода.
Специфика широко используемых в электрохимии жидких электродов (ртуть, амальгамы, галлий, жидкие сплавы на основе Ga -галламы, расплавы металлов и т. п.) связана с идеальной гладкостью их поверхности, истинная площадь которой совпадает с ее геометрической величиной, а также с энергетической однородностью и изотропностью свойств поверхности электродов и возможностью растворения выделяющихся металлов в материале электрода.
На практике электроды классифицируют по химической природе материала (металлические, неметаллические, оксидные, электроды из соединений с ковалентной связью, углеграфитовые и т.д.), форме (сферические, плоские, цилиндрические, дисковые и т. д.), условиям функционирования (неподвижные, вращающиеся и т. п.), размерам (микро- и ультрамикроэлектроды), пористости, гидрофильности, участию электродного материала в электродном процессе (расходуемые и нерасходуемые) и др. признакам.
Использование капельного ртутного электрода лежит в основе полярографии. Вращающийся дисковый электрод представляет интерес как система, для которой существует строгое решение диффузионной кинетические задачи. К особо практически важным электродам следует отнести каталитически активные и высоко коррозионностойкие оксидные рутениево-титановые аноды (ОРТА), применение которых революционизировало самое широкомасштабное электрохимическое производство – электролитическое получение хлора и щелочей.
Модифицирование электроды, получившее широкое распространение в электрокатализе, производстве химических источников тока, электрохимических сенсоров и т. п., основано как на физических (ионная имплантация, разрыхление поверхности, выращивание монокристаллических граней, создание монокристаллических структур, физическая адсорбция ионов и молекул и др.), так и химических методах. В частности, химически модифицированные электроды представляют собой проводящий или полупроводниковый материал, покрытый мономолекулярными (в т. ч. субатомными), полимолекулярными, ионными, полимерными слоями, в результате чего электрод проявляет химические, электрохимические и оптические свойства слоя.
Химическое модифицирование достигается хемосорбцией на поверхности электрода ионов и молекул, ковалентным связыванием различных агентов с поверхностными атомными группами, покрытием поверхности органическим, металлорганическим или неорганическим полимерными слоями, созданием композитов из электродного материала и вещества -модификатора.
Микроэлектроды имеют по крайней мере один из размеров настолько малый, что свойства электродов оказываются размерно зависимыми. Размеры микроэлектродов лежат в интервале 0,1-50 мкм, минимальная площадь составляет 10-14 м 2 (ультрамикроэлектроды), тогда как в большинстве электроаналитических экспериментов применяют электроды с площадью 5 х 10-5м 2 , в лабораторном электросинтезе - 10-2 м 2 . Основное преимущество микроэлектродов - возможность снизить с их помощью диффузионные ограничения скорости электродного процесса и, следовательно, изучать кинетику очень быстрых электродных реакций.
Из-за малой величины токов электрохимической ячейки с микроэлектродами характеризуются незначительным падением потенциала, что позволяет изучать системы с высокими концентрациями реагирующих частиц, обычно используемые в технологических процессах, применять высокие скорости сканирования потенциала при вольтамперометрических измерениях, проводить работы в плохо проводящих средах и т. п. Микроэлектроды используют для анализа ультрамалых проб, исследования процессов в живых организмах, в клинических целях. Ультрамикроэлектроды применяют в туннельной сканирующей микроскопии и в электрохимической нанотехнологии.
30. Классификация электродов (1,2 рода). Металлические электроды. Газовые электроды: водородный, кислородный. Зависимость потенциалов водородного и кислородного электродов от рН.
Система металл, погруженный в раствор электролита, называется электродом.
Электроды подразделяются на обратимые и необратимые. Если изменить направление электрического тока во внешней цепи на противоположное, то на обратимом электроде протекает тот же самый процесс в обратном направлении, а на необратимом – другой процесс.
Серебряная пластинка, находящаяся в растворе нитрата серебра, представляет собой обратимый электрод. Электродный процесс Аg + +е Аg
Протекает в прямом и обратном направлениях.
Серебряная пластинка, находящаяся в растворе кислоты, служит примером необратимого электрода. В зависимости от направления тока во внешней цепи на электроде происходит восстановление катионов водорода 2Н + + 2е Н2
Или окисление атомов серебра Аg ® Аg + +е.
В зависимости от свойств веществ и заряженных частиц, участвующих в электрохимических процессах, и характера равновесия обратимые электроды классифицируют на электроды первого второго рода, окислительно-восстановительные и ионообменные.
Электрод первого рода представляет пластинку, изготовленную из простого вещества (металла или полупроводника) и погруженную в раствор, содержащий его ионы.
В качестве примера можно привести серебряный и селеновый электроды.
Аg + | Аg : Sе 2- | Sе
Для их электродных процессов характерно участие только одного вида ионов:
Электроды второго рода представляют собой металл, покрытый слоем его малорастворимого соединения (соли, оксиды, гидроксиды) и погруженный в раствор, содержащий анионы, одноименные с анионами труднорастворимого соединения. Условная запись электрода второго рода А - | МА, М. в качестве примера можно привести хлоридсеребряный Сl | Аg Сl, Аg
процесс протекающий на электроде Аg Сlт + е Аgт + Сl - р.
В электродах второго рода окисленной формой является малорастворимое соединение (МА), восстановленной – атом металла (М) и анион раствора (А - ).
Среди электродов первого рода в отдельную группу выделяют газовые электроды, к которым относятся водородный, кислородный электроды и др. водородный электрод обратим относительно катиона, кислородный относительно аниона. Все газовые электроды конструктивно устроены одинаково. Они представляют собой инертный металл (Рt) с развитой поверхностью, хорошо проводящей электрический ток и обладающий каталитическими свойствами по отношению к электродному процессу. Платиновая пластинка электролитически покрывается слоем мелкодисперсной платины с целью увеличения адсорбции газа поверхностью металла. Платина одновременно контактирует с газом и раствором, содержащим соответствующие ионы. В стандартном кислородном электроде платиновая пластинка погружена в раствор щелочи (NаОН, КОН), с активностью гидроксид ионов равной 1 моль/л. Давление чистого кислорода (или его парциальное давление в смеси газов над раствором) составляет 101,3 кПа.
В щелочной среде кислородному электроду Н20, ОН - | О2 Рt соответствует уравнение
электродного процесса О2 г + 2Н2О р + 4е D 4ОН - р
схема кислородного электрода в кислотной среде Н2О, Н + | О2 Рt
схема водородного электрода в щелочной и нейтральной средах: Н2О, ОН - | Н2, Рt
уравнения электродных процессов: 2Н2Ор+ 2е D Н2 г + 2ОН - р
Зависимость электродного потенциала водородного электрода от рН
Н+/Н2 = - 0,059 рН - 0,0295 lg рН2 при рН2 =1 Н+/Н2 = - 0,059 рН
(для чистой воды рН = 7 электродный потенциал равен -0,414В)
Зависимость электродного потенциала кислородного электрода от рН
jО2,Н2О/ОН- = 1,229 – 0,059 рН + 0,0147 lg рО2 при рО2 = 1
jО2,Н2О/ОН- = 1,229 – 0,059 рН
Анализируя уравнение электродного потенциала для водородного электрода, можно сделать вывод, что потенциал водородного электрода линейно увеличивается с уменьшением водородного показателя рН (ростом кислотности) среды и уменьшением парциального давления газообразного водорода над раствором.
Потенциал кислородного электрода линейно увеличивается с уменьшением рН раствора и увеличением парциального давления газообразного кислорода над ним.
Читайте также:
