Металлические кристаллы и связь
Обновлено: 12.05.2024
Известно, что вещества в природе могут находиться в четырех агрегатных состояниях, а именно: в твердом, жидком, газообразном и плазменном. Два из этих состояний, жидкое и твердое, называются конденсированными. В этих состояниях возникают ансамбли сильно взаимодействующих частиц, а именно: атомов, ядер, электронов. При этом силы притяжения и отталкивания уравновешиваются, поэтому конденсированные вещества создают большое сопротивление к изменению объема. Те из них, которые оказывают сопротивление изменению формы, называют твердыми телами. Но ощутимой границы между твердыми телами и жидкостями не существует, на их границе имеются, так называемые, аморфные тела.
Главная особенность аморфных тел (смол, стекол, шлаков и т.д.) это отсутствие дальнего порядка во взаимном расположении атомов, т.е. строгой повторяемости одного и того же элемента структуры во всех направлениях. В аморфных телах наблюдается ближний порядок. Эта определенная согласованность расположения ближних частиц при увеличении расстояния быстро уменьшается. Отсутствие дальнего порядка - непосредственная причина полной изотропности физических свойств и отсутствия определенной точки плавления аморфных тел.
Существенной характеристикой кристаллического тела является упорядоченная периодическая внутренняя структура, простирающаяся в трех направлениях, т.е. дальний порядок. Результат этой структуры - внешняя симметрия кристаллов.
Кристаллы анизотропны: их физические свойства (тепло-, электропроводность, оптические свойства, модули упругости и т.д.) меняются в зависимости от направления. Можно отметить особые кристаллографические направления и плоскости, в которых физические свойства кристаллов оказываются вполне определенными. Но обнаружить анизотропность можно не у всяких кристаллов, а только у монокристаллов.
Большинство кристаллических тел, например металлы, являются поликристаллическими. Они представляют собой множество сросшихся мелких кристаллических зерен. Внутри зерна сохраняются неизменными направления кристаллографических осей. В поликристаллах одинаковые кристаллографические направления отдельных кристалликов оказываются повернутыми относительно друг друга на всевозможные углы. Если в ориентации зерен нет никакого порядка, то такое кристаллическое тело будет изотропным. Если же будет наблюдаться какой-то порядок (а он может возникнуть при таких методах обработки металла, как прокатка, протяжка, волочение), то этот материал называется текстурированным и обнаруживает некоторую анизотропность.
В ряде случаев дальний порядок наблюдается и в жидкой фазе. Это так называемое жидкокристаллическое состояние. В жидких кристаллах наблюдается одноосный дальний порядок: дальний порядок наблюдается только по одному направлению, а по другим перпендикулярным направлениям дальнего порядка нет (органические вещества, молекулы которых имеют нитевидную вытянутую форму или форму пластин) .
Термином"твердое тело" мы определим тела, обладающие кристаллической структурой. Следовательно, все аморфные тела, в которых наблюдается типичный для жидкости беспорядок в расположении атомов, не относятся к твердым телам, это сильно охлажденные и очень вязкие жидкости.
Твердые тела можно разделить на группы, основанные на типах связи между кристаллами. Согласно этой классификации все твердые тела условно можно разделить на металлы, ионные кристаллы, валентные кристаллы, молекулярные кристаллы, кристаллы с водородной связью. Различия между этими группами кристаллов не всегда достаточно четко выражены, поэтому, указанный способ классификации может служить для приближенного объединения кристаллов в группы. Например, полупроводники могут относиться и к ионным, и к валентным, и к молекулярным кристаллам.
Основные типы связывающих сил, в соответствии с которыми мы провели классификацию твердых тел это ионная, ковалентная, молекулярная, металлическая и водородная.
Ионная связь возникает в кристалле благодаря электростатическому взаимодействию между противоположно заряженными ионами. Ионная связь возникает, когда сближаются атомы, сильно отличающиеся по величине энергии их валентных электронов. Каждый атом подвергается сильному воздействию электростатического поля другого, при этом электроотрицательный атом отдает часть своих валентных электронов, превращаясь в положительный ион, электроположительный атом приобретает эти электроны и становится отрицательным ионом. При тесном сближении ионов возникает новая сила - сила взаимодействия (отталкивания) электронных оболочек, которая растет быстрее, чем сила электронного приближения. Ионы в кристалле распределяются в таком положении, при котором силы отталкивания уравновешиваются силами притяжения.
1-энергия связи; 2- энергия отталкивания; 3- результирующая энергия взаимодействия; r0 – расстояние между ионами в молекуле; UC – энергия связи
Типичные ионные кристаллы – это твердые тела, образовавшиеся в результате соединения сильно электроположительных металлов с сильно электроотрицательными элементами. Обычно это неорганические соединения (NaCl, KJ и т.д.). Сила ионной связи проявляется в большой твердости, относительно высокой точке плавления, малом коэффициенте теплового расширения.
Ковалентная связь.Если атомы, из которых формируется кристалл, обладают аналогичными свойствами, то невозможен переход электронов от электроположительных атомов к электроотрицательным для создания стабильных конфигураций. Однако, если каждый из двух подобных атомов имеет орбиту с одним только валентным электроном, то при сближении атомов такие орбиты могут объединяться в одну. Возникает общая орбита с двумя электронами, вращающимися вокруг обоих атомов. Эта орбита с двумя электронами более устойчива, чем две независимые орбиты с одним электроном на каждой. Взаимное притяжение двух атомов благодаря общей орбите электронов и образует ковалентную связь, которая обуславливает образование валентных кристаллов. Такая связь наблюдается в молекулах H2, N2, O2 и т.д., а также между элементами средних групп таблицы Менделеева SiC, AlN и т.д. Кристаллы с ковалентной связью наиболее важный полупроводниковый материал.
Рис.1.3. Обобществление электронов сопровождается перераспределением электронной плотности ׀Ψ׀ 2 : 1- плотность электронных облаков изолированных атомов; 2- суммарная плотность, которая получилась бы при простом наложении электронных облаков; 3 – фактически устанавливающаяся плотность.
Ковалентную связь отличает направленность: связь образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированныхх электронов. Кроме того, эта связь характерна насыщаемостью, то есть каждый атом способен образовать ковалентную связь лишь с определенным числом соседей. Эта связь может осуществляться одной парой электронов – одинарная связь, двумя парами и т.д.
Типичный пример - углерод в форме алмаза. Любой атом углерода окружен 4-мя атомами, расположенными в вершинах тетраэдра, с каждым из которых он связан обобщенной парой валентных электронов.
Сила ковалентной связи может быть такой же, как и ионной, так что валентные и ионные кристаллы имеют близкие свойства. Однако валентные кристаллы показывают большее разнообразие своих физических свойств: твердость, точка плавления, коэффициент теплового расширения изменяются в более широких пределах, чем аналогичные характеристики ионных кристаллов.
Молекулярная связь осуществляется силами Ван-дер-Ваальса, она имеет важное значение только в том случае, когда возникает между атомами и молекулами, имеющими заполненные валентные оболочки. Многие атомы и молекулы, являясь нейтральными образованиями, обладают определенным электрическим дипольным моментом, благодаря несимметричному распределению электрических зарядов. Взаимодействие этих моментов и приводит к возникновению сил притяжения (в данном случае сил Ван-дер-Ваальса). Даже в тех атомах и молекулах, в которых дипольный момент равен нулю, возникает изменение дипольного момента, вызванное движением электронов и их мгновенным положением. Мгновенное электронное поле возбуждает дипольные моменты в окружающих атомах и между ними возникают силы Ван-дер-Ваальса. Атомы будут сближаться до тех пор, пока электронное отталкивание внешних электронных оболочек не скомпенсирует силы Ван-дер-Ваальса.
Ван-дер-ваальсова связь включает в себя:
- дисперсионное взаимодействие, возникающее вследствие согласованного движения электронов в соседних атомах. Под влиянием мгновенного электрического диполя первого атома второй атом поляризуется, в нем возникает наведенный диполь, возникает притяжение (рис. а). Оно более вероятно, чем отталкивание (рис б), т.к. энергия системы меньше.
- ориентационное взаимодействие возникает между слабо и средне полярными молекулами. Электростатическое взаимодействие стремится упорядочить расположение молекул так, чтобы энергия системы уменьшалась (рис. в). Энергия системы, определяемая ориентацией молекул, сильно зависит от температуры.
- индукционное взаимодействие - возникает между сильно полярными молекулами. У них может возникать наведенный (индуцированный) момент под действием поля постоянных диполей соседних молекул (пунктир на рис. г)
Обычно эти силы довольно слабы (в сравнении с ионной и ковалентной связью) и обуславливают низкую температуру плавления, высокую сжимаемость, низкую теплоту сублимации молекулярных кристаллов. К молекулярным кристаллам относятся большинство органических кристаллов. Эта связь возникаетмежду молекулами с насыщенными химическими связями (О2, Н2, N2, CН4…), а также между атомами инертных газов.
Металлическая связь.Металлический кристалл в некотором приближении можно представить в виде решетки из положительных ионов, между которыми могут свободно перемещаться электроны. Металлическая связь возникает благодаря взаимодействию между ионами и всей совокупностью обобществленных электронов. Электроны, находящиеся между ионами, "стягивают" их, стремясь уравновесить силы отталкивания, действующие между положительными ионами. Металлические кристаллы обладают высокой ковкостью, теплопроводностью и электропроводностью. Почти все металлы кристаллизуются в наиболее плотных структурах кубической и гексагональной решеток, с наибольшим значением координационного числа, т.е. числа атомов которые составляют ближайшее окружение данного атома.
Водородная связь.Водородная связь возникает в том случае, когда атом водорода связан с очень электроотрицательным атомом (например, атомом кислорода, фтора, натрия, хлора и т.д.). Такой атом притягивает электроны связи и приобретает отрицательный заряд. Атом водорода, от которого оттянут электрон связи, приобретает положительный заряд. Водородная связь обусловлена электростатическим притяжением этих зарядов.
Типичным примером может служить водородная связь, возникающая между молекулами воды. Связь О-Н, устанавливающаяся между атомами кислорода одной молекулы воды и атомом водорода другой, ведет себя как маленький диполь с зарядом -d на О и +d на Н. Притяжение между этими зарядами и приводит к образованию водородной связи (пунктир на рис. 1.6).
Водородная связь вызывает ассоциацию молекул жидкости: воды, кислот, спиртов и т.д., приводящую к повышению их вязкости, увеличению точки кипения, аномальному изменению объема при нагревании и т.д. Показательной в этом отношении является вода: если бы между молекулами воды не действовала водородная связь, то она кипела бы при нормальном давлении не при +100°С, а при -80°С, а ее вязкость была бы почти на порядок меньше.
Важной характеристикой межатомных связей в кристаллах является энергия связи. Под энергией связи понимают энергию необходимую для разъединения твердого тела на отдельные частицы. В зависимости от состава кристалла энергия связи принимает значения: энергия обусловленная силами Ван-дер-Ваальса » 10 4 Дж/моль; ионной связи » 10 6 Дж/моль; энергия ковалентной примерно равна энергии ионной связи.
Необходимо отметить, что обычно атомы в кристалле не связаны каким – либо одним из рассмотренных выше типов связи, большинство кристаллов объединяют в себе несколько типов связи.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Типы связи в кристаллах и их характеристики
Ионная связь возникает в кристалле благодаря электростатическому взаимодействию между противоположно заряженными ионами. Ионная связь возникает, когда сближаются атомы, сильно отличающиеся по величине энергии их валентных электронов. Каждый атом подвергается сильному воздействию электростатического поля другого, при этом электроотрицательный атом отдает часть своих валентных электронов, превращаясь в положительный ион, электроположительный атом приобретает эти электроны и становится отрицательным ионом.
При тесном сближении ионов возникает новая сила - сила взаимодействия (отталкивания) внутренних электронных оболочек, которая растет быстрее, чем сила электронного приближения.
Следует отметить, что механизм возникновения сил отталкивания (взаимодействие внутренних отрицательно заряженных электронных оболочек атомов) аналогичен для всех типов связи.
Ионы в кристалле распределяются в таком положении, при котором силы отталкивания уравновешиваются силами притяжения.
| r |
| U |
| r0 |
| Uс |
1-энергия связи; 2- энергия отталкивания; 3- результирующая энергия взаимодействия;
r0 – расстояние между ионами в молекуле; UC – энергия связи
Типичные ионные кристаллы (Гиперссылка 1.1)– это твердые тела, образовавшиеся в результате соединения сильно электроположительных металлов с сильно электроотрицательными элементами. Обычно это неорганические соединения (NaCl, KJ и т.д.). Сила ионной связи проявляется в большой твердости, относительно высокой точке плавления, малом коэффициенте теплового расширения.
Ковалентная связь.Если атомы, из которых формируется кристалл, обладают аналогичными свойствами, то невозможен переход электронов от электроположительных атомов к электроотрицательным для создания стабильных конфигураций. Однако если каждый из двух подобных атомов имеет орбиту с одним только валентным электроном, то при сближении атомов такие орбиты могут объединяться в одну. Эта орбита с двумя электронами более устойчива, чем две независимые орбиты с одним электроном на каждой. Взаимное притяжение двух атомов благодаря общей орбите электронов и образует ковалентную связь, которая обуславливает образование валентных кристаллов и молекул с валентными связями. Плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1.3).
Такая связь наблюдается в молекулах H2, (гиперссылка 1.2) N2, O2 и т.д., а также между элементами средних групп таблицы Менделеева SiC, AlN и т.д. Кристаллы с ковалентной связью наиболее важный полупроводниковый материал.
| + |
| + |
| 1,2 |
| 1,2 |
| |Ψ| 2 |
| r0 |
| а |
| b |
Ковалентную связь отличает направленность: связь образуется в том направлении, в котором расположена наибольшая часть электронного облака коллективизированных электронов. Кроме того, эта связь характерна насыщаемостью, то есть каждый атом способен образовать ковалентную связь лишь с определенным числом соседей. Эта связь может осуществляться одной парой электронов – одинарная связь, двумя парами и т.д.
Типичный пример - углерод в форме алмаза. (Гиперссылка 1.3). Любой атом углерода окружен 4-мя атомами, расположенными в вершинах тетраэдра, с каждым из которых он связан обобщенной парой валентных электронов.
- дисперсионное взаимодействие, возникающее вследствие согласованного движения электронов в соседних атомах. Под влиянием мгновенного электрического диполя первого атома второй атом поляризуется, в нем возникает наведенный диполь, возникает притяжение (рис. 1.4 а). Оно более вероятно, чем отталкивание (рис 1.4 б), т.к. энергия системы меньше.
| а) |
| + |
| + |
| Атомы гелия |
| Мгновенные диполи |
| Притяжение |
| + |
| _ |
| _ |
| + |
| б) |
| + |
| + |
| Атомы гелия |
| Мгновенные диполи |
| Отталкивание |
| + |
| _ |
| _ |
| + |
| + |
| + |
| _ |
| + |
| + |
| _ |
| г) |
| в) |
| + |
| _ |
| + |
| _ |
| + |
| _ |
| + |
| _ |
| + |
| _ |
| + |
| _ |
- ориентационное взаимодействие возникает между слабо и средне полярными молекулами. Электростатическое взаимодействие стремится упорядочить расположение молекул так, чтобы энергия системы уменьшалась (рис. 1.4 в). Энергия системы, определяемая ориентацией молекул, сильно зависит от температуры.
- индукционное взаимодействие - возникает между сильно полярными молекулами. У них может возникать наведенный (индуцированный) момент под действием поля постоянных диполей соседних молекул (пунктир на рис. 1.4 г)
Обычно эти силы довольно слабы (в сравнении с ионной и ковалентной связью) и обуславливают низкую температуру плавления, высокую сжимаемость, низкую теплоту сублимации молекулярных кристаллов. К молекулярным кристаллам (гиперссылка 1.4) относятся большинство органических кристаллов. Эта связь возникает между молекулами с насыщенными химическими связями (О2, Н2, N2, CН4…), а также между атомами инертных газов.
Металлическая связь.Металлический кристалл в некотором приближении можно представить в виде решетки из положительных ионов, между которыми могут свободно перемещаться электроны. Металлическая связь возникает благодаря взаимодействию между ионами и всей совокупностью обобществленных электронов.
Электроны, находящиеся между ионами, "стягивают" их, стремясь уравновесить силы отталкивания, действующие между положительными ионами (рис. 1.5)
| е -электроны |
| -ионы металла |
| + |
| е |
| е |
| е |
| е |
| е |
| е |
| е |
| е |
| е |
| е |
| е |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
| + |
Металлические кристаллы обладают высокой ковкостью, теплопроводностью и электропроводностью. Почти все металлы кристаллизуются в наиболее плотных структурах кубической и гексагональной решеток, с наибольшим значением координационного числа, т.е. числа атомов которые составляют ближайшее окружение данного атома.
| О |
| Н |
| Н |
| -δ |
| О |
| Н |
| Н |
| -δ |
| +δ |
| Н |
| +δ |
Важной характеристикой межатомных связей в кристаллах является энергия связи. Под энергией связи понимают энергию необходимую для разъединения твердого тела на отдельные частицы. В зависимости от состава кристалла энергия связи принимает значения: энергия обусловленная силами Ван-дер-Ваальса
» 10 кДж/моль; ионной связи » 10 3 кДж/моль; энергия ковалентной примерно равна энергии ионной связи. Это значит, что при образовании 1 моль кристаллического вещества выделяется указанный объём энергии. То же количество энергии расходуется на распад кристалла..
В таблице 1.1 приведены значения энергии связи некоторых типичных кристаллов.
Таблица 1.1 - Энергия связи в кристаллах
| Кристалл | LiF | NaCl | Алмаз | SiC | Fe | Na | Ar | CH4 |
| Тип связи | Ионная | Ковалентная | Металлическая | Молекулярная | ||||
| Энергия связи, кДж/моль | 7,5 |
Необходимо отметить, что обычно атомы в кристалле не связаны каким–либо одним из рассмотренных выше типов связи, большинство кристаллов объединяют в себе несколько типов связи. Например, кристалл метана СН4 образуется за счет молекулярной (Ван-дерВаальсовой) связи, но сама молекула метана образуется за счет ковалентной связи с энергией связи 412 кДж/моль.
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
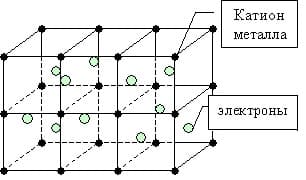
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
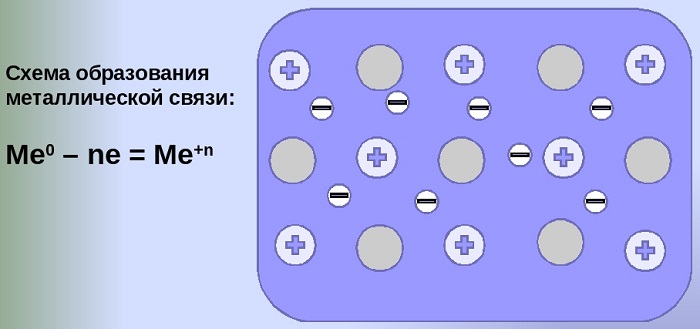
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
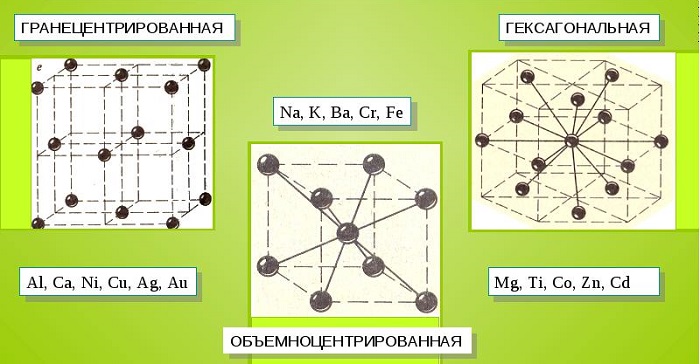
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
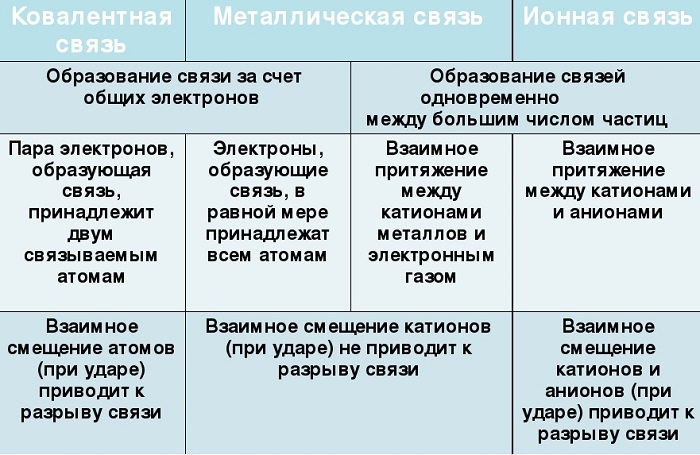
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Читайте также:
