Металлический кальций проявляет свойства окислителя или восстановителя
Обновлено: 06.05.2024
- Свойства простого вещества, образуемого им (металл или неметалл; окислитель, восстановитель или проявляет окислительно-восстановительную двойственность
- Низшая и высшая степени окисления
- Состав и свойства (основные, кислотные или амфотерные) высших оксида и гидроксида
Свойства кальция
Физические
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм) , выше устойчив β-Ca с кубической объемно-центрированной решеткой типа α-Fe (параметр a = 0,448 нм) . Стандартная энтальпия перехода α → β составляет 0,93 кДж/моль.
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является) . При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы) . Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются) [4].
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, хлором, бромом) кальций реагирует при обычных условиях:
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Кроме фосфида кальция Ca3P2 известны также фосфиды кальция составов СаР и СаР5;
Кроме силицида кальция Ca2Si известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са (НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет временную жёсткость воды. Временной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Охарактеризуйте кальций (Ca)
- Свойства простого вещества, образуемого им (металл или неметалл; окислитель, восстановитель или проявляет окислительно-восстановительную двойственность
- Низшая и высшая степени окисления
- Состав и свойства (основные, кислотные или амфотерные) высших оксида и гидроксида
Свойства кальция
Физические
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм) , выше устойчив β-Ca с кубической объемно-центрированной решеткой типа α-Fe (параметр a = 0,448 нм) . Стандартная энтальпия перехода α → β составляет 0,93 кДж/моль.
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является) . При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы) . Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются) [4].
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, хлором, бромом) кальций реагирует при обычных условиях:
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Кроме фосфида кальция Ca3P2 известны также фосфиды кальция составов СаР и СаР5;
Кроме силицида кальция Ca2Si известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са (НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
Так в природе происходит перенос больших масс веществ. В результате под землей могут образоваться огромные провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет временную жёсткость воды. Временной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Урок-обобщение по теме "Металлы"
Обучающая – обобщить знания учащихся об основных свойствах элементов-металлов и образуемых ими простых и сложных веществ.
Воспитательная – воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды тяжелыми металлами), ответственное отношение к собственному здоровью (в связи с необходимостью или вредом поступления в организм некоторых металлов).
Развивающая – совершенствовать умения экспериментально подтверждать химические свойства веществ, на основе теоретических знаний, выполнять практические задания, выявлять существенное, делать выводы, устанавливать межпредметные связи, развивать экспериментальные умения, формировать мировоззренческие понятия о познаваемости природы.
Оборудование: компьютер, проектор, экран, презентация Power Point, периодическая система периодических элементов Д.И. Менделеева, коллекция металлов, Zn, HCl, Ni, CuSO4, Cu, H2SO4 концентрированная, Na, H2O, модели кристаллических решеток.
Тип урока: Урок обобщения и систематизации знаний.
- Орг. начало и постановка целей урока.
Достаточно внимательно осмотритесь вокруг. Где бы вы ни были: дома или в школе, на улице или в транспорте – вы увидите, какое множество металлов трудится вокруг нас и для нас.
На экран выводится слайд “Положение металлов в Периодической системе Д.И. Менделеева.
- Выберите группу элементов, в которой находятся только металлы:
А) 2 электрона на последнем электронном слое;
Б) 1 электрон на последнем электронном слое;
В) одинаковое число электронных слоев.
А) окислителя Б) восстановителя;
В) окислителя или восстановителя в зависимости от условий.
- Дайте общее название приведённым ниже группам веществ:
А) Известняк, гипс, фосфорит; мрамор; (Ответ: Природные соединения кальция)
Б) Литий, натрий, калий, рубидий, цезий; (Ответ: Щелочные металлы, металлы I группы главной подгруппы)
В) CrO, FeO, MnO, Na2O; (Ответ: Основные оксиды)
- Обобщающее повторение. Общие физические свойства металлов.
Используя знания, полученные на уроках физики и химии и в процессе обсуждения заполняем схему № 1
На экран выводятся две схемы – до обсуждения и после обсуждения.
На экран выводятся последовательно 4 слайда, в ходе обсуждения учениками демонстрируются химические реакции, подтверждающие свойства металлов.
Ученикам, выполняющим демонстрационные опыты, напоминаю правила техники безопасности.
Работа в парах. Задания различаются по уровню сложности, т.е. используется дифференцированный подход в соответствии со способностями учеников.
Задание № 1. О физических свойствах какого металла идёт речь: серебристо-белого цвета, режется ножом, легкоплавкий?
1) Кальций; 2) Натрий. (Ответ: 2)
Задание № 2. Какую степень окисления проявляет алюминий в соединениях?
1) +1, +3; 2) +3; 3) -3. (Ответ: 2)
Задание № 3. Какой из металлов наиболее распространён в природе?
1) Ba; 2) Na; 3) Al. (Ответ: 3)
Задание № 1. Какие свойства проявляют щелочные металлы в химических реакциях?
1) Восстановительные; 2) Окислительные и восстановительные. (Ответ: 1)
Задание № 2. К какому типу элементов относится кальций?
1) p-элемент; 2) s-элемент; 3) d-элемент. (Ответ: 2)
Задание № 3. Какие из уравнений химических реакций доказывают свойства алюминия как промежуточного элемента между металлами и неметаллами:
1) а, в; 2) б. (Ответ:2)
Задание № 1. Какая схема строения последнего энергетического уровня соответствует атому алюминия?
1) 3s 1 ; 2) 3s 2 3p 1 ; 3) 4s 2 . (Ответ: 2)
Задание № 2. Какие из указанных реакций характеризуют восстановительные свойства кальция:
1) а, б, в, г; 2) только а и г. (Ответ 1)
Задание № 3. У какого элемента ярче выражены металлические свойства и почему?
1) Na; 2) K; 3) Rb; 4) Cs. (Ответ: 4, больший радиус атома)
VI. Обобщающее повторение. Металлы побочных подгрупп периодической системы.
- Составьте схему распределения электронов по орбиталям в атоме железа. Определите количество валентных электронов.
- Охарактеризуйте свойства простого вещества железа (тип кристаллической решетки, характер связи, физические свойства).
- Какая степень окисления железа в следующих соединениях: Fe(OH)2, FeCl3, K2FeO4, Fe2O3, Fe(OH)3.
- Что является реактивом на катионы Fe 2+ и Fe 3+ .
- Какая степень окисления хрома в следующих соединениях: Cr(OH)3, CrO3, H2Cr2O7, Cr(OH)2, H2CrO4, CrO, Cr2O3.
Характеристика элементов-металлов побочных подгрупп.
- Семейство (тип элемента) – d.
- Число электронов на последнем энергетическом уровне – 1-2.
- Число валентных электронов – как правило, соответствует номеру группы (кроме VIII).
- Степени окисления в соединениях – переменные.
- Свойства соединений элементов – окислительные и восстановительные.
- Характер оксидов и гидроксидов – основной, амфотерный и кислотный.
VIII. Итоговое тестирование
А) Zn 2+ +2Cl - >ZnCl2 ; Б) Zn 2+ +2H + >Zn 0 + H2 0 ; В) Zn 0 +2H + >Zn 2+ +H2 0
А) H2 0 -2e - >2H - ; Б) H2 0 +2e - >2H - ; В) H2 0 - 2e - >2H +
А) Br 2 0 +2e - >2 Br – ; Б) Br 2 0 +2e - >Br2 – ; В) 2Br - - 2e - >Br 2 0
Тайны химии
Положение металлов в периодической системе химических элементов Д. И. Менделеева. Физические и химические свойства металлов. Ряд напряжений металлов.
К металлам относятся все элементы побочных (Б) подгрупп, а также элементы главных подгрупп, расположенные ниже диагонали «бериллий – астат». Кроме того, химические элементы металлы образуют группы лантаноидов и актиноидов.
По сравнению с атомами неметаллов, атомы металлов имеют большие размеры и меньшее число внешних электронов, обычно оно равно 1–3. Следовательно, внешние электроны атомов металлов слабо связаны с ядром, металлы их легко отдают, проявляя в химических реакциях восстановительные свойства.

Рассмотрим закономерности изменения некоторых свойств металлов в группах и периодах.
В периодах с увеличением заряда ядра радиус атомов уменьшается. Ядра атомов все сильнее притягивают внешние электроны, поэтому возрастает электроотрицательность атомов, металлические свойства уменьшаются.
В главных подгруппах сверху вниз в атомах металлов возрастает число электронных слоев, следовательно, увеличивается радиус атомов. Тогда внешние электроны будут слабее притягиваться к ядру, поэтому наблюдается уменьшение электроотрицательности атомов и увеличение металлических свойств.
Металлическая связь– это связь, которую осуществляют свободные электроны между катионами в металлической кристаллической решётке .
а) Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, алюминия, магния и др.
б) Гидрометаллургия – восстановление металлов из солей в растворе.
Например, CuO + H2SO4 = CuSO4 + H2O,
CuSO4 + Fe = Cu + FeSO4.
в) Электрометаллургия (электролиз) – восстановление металлов в процессе электролиза растворов и расплавов солей.
Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
Самый распространённый в земной коре металл – алюминий. Металлы встречаются как в соединениях, так и в свободном виде.
В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Реже – медь, ртуть и некоторые другие. Самородные металлы встречаются в природе в небольших количествах в виде зерен или вкраплений в различных минералах. Лишь изредка они образуют большие куски – самородки. Самый большой самородок золота весил 112 кг.


Иногда металлы практически в чистом виде содержатся в метеоритах. Так, некоторые предметы из высокочистого железа, найденные археологами, объясняются именно тем, что они были изготовлены из метеоритного железа. Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.

Минерал – это химически и физически индивидуализированный продукт природной физико-химической реакции, находящийся в кристаллическом состоянии.
Очень часто это оксиды. Например, оксид железа (III) Fe 2 O 3 – гематит, или красный железняк.
Активные металлы часто присутствуют в природе в виде солей (сульфаты, нитраты, хлориды, карбонаты).

Минералы входят в состав горных пород и руд. Рудами называются природные образования, содержащие минералы в таком количестве, чтоб из этих руд было выгодно получать металлы. Обычно перед получением металла из руды руду обогащают, удаляя пустую породу и различные примеси. При этом образуется концентрат, который и является исходным сырьем для металлургической промышленности.

Важно запомнить, что в химических реакциях металлы выступают в качестве восстановителей: отдают электроны и повышают свою степень окисления. Рассмотрим некоторые реакции, в которых участвуют металлы.
1. Взаимодействие с кислородом
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
Презентация, доклад Металлы
Вы можете изучить и скачать доклад-презентацию на тему Металлы . Презентация на заданную тему содержит 28 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!



























Цели урока: Повторить и закрепить все основные понятия по теме: «Металлы» с помощью разноплановых заданий (традиционных, игровых, логических) 1. Металлы как элементы, их свойства 2. Металлы как простые вещества: их физические и химические свойства 3.Соединения металлов: оксиды, гидроксиды и их свойства. Подготовиться к последующему контролю знаний в виде контрольной работы. Получить дополнительную информацию о некоторых изучаемых объектах.
Ответьте на вопросы и из первых букв соберите название распространенного минерала в земной коре, куда входит алюминий Синтетическое моющее средство для волос Драгоценный белый металл, который называют «королева роскоши» Серебристо-белый легкий металл, используемый для получения легких сплавов Агрегатное состояние металлов (кроме ртути)
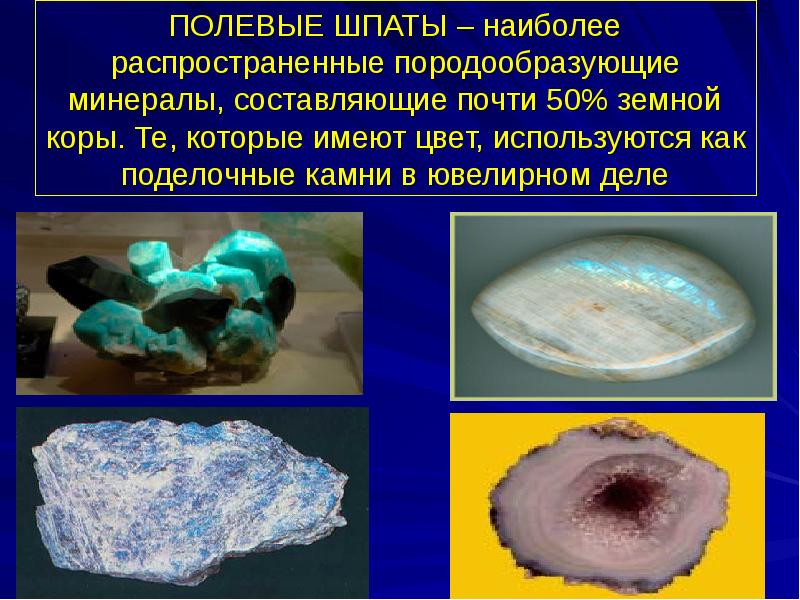
ПОЛЕВЫЕ ШПАТЫ – наиболее распространенные породообразующие минералы, составляющие почти 50% земной коры. Те, которые имеют цвет, используются как поделочные камни в ювелирном деле
Выберите группу элементов, в которой находятся только металлы: А) AL, As, P B) Mg, Ca, Si C) K, Ca, Pb
Укажите общее в строении атомов K и Li А) 2 электрона на последнем электронном слое; В) 1 электрон на последнем электронном слое; С) одинаковое число электронных слоев.
Металлический кальций проявляет свойства: А) окислителя; В) восстановителя; С) окислителя или восстановителя в зависимости от условий;
Дайте общее название приведенным ниже группам веществ: Li, Na, K, Rb, Cs, Fr Na2O, CaO, BaO, FeO 3. ZnO, Al2O3, Fe2O3
М Е Т А Л Л Ы Ответьте на вопросы: Главная характеристика элементов-металлов по строению их атомов? Физические свойства простых веществ-металлов? Какая степень окисления металлов может быть в сложных соединениях и почему?
Читайте также:
