Металлы химические элементы и простые вещества
Обновлено: 25.04.2024
Определение понятия
Металлы – ковкие, пластичные тягучие вещества, которые имеют металлический блеск, тепло- и электропроводны.
87 элементов Периодической системы Д.М. Менделеева образуют в свободном состоянии простые вещества с металлической связью.
Расположение ионов в кристалле щелочного металла
Свойства металлов:
Пластичность (ковкость) – свойство металлов изменять свою форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку.
Золото – самый пластичный металл.
Свойства металлов:
2) металлический блеск – способность отражать свет за счёт плотной упаковки ион-атомов, которые занимают 80% от всего объёма кристалла.
Свойства металлов:
3) твердость – свойство материала сопротивляться внедрению в него другого, более твёрдого тела (исключение ртуть).
4)тепло- и электропроводность – из-за наличия свободных электронов.
Свойства некоторых металлов:
Ag Pt – самые блестящие
Ag Cu Au Al – лучшие проводники
Аu – лучший по ковкости и пластичности
Os – самый тяжёлый ( 22.48 г/мл)
Li – самый лёгкий (0.52 г/ мл)
Hg – самый легкоплавкий (Тпл = -38.87 С)
W – cамый тугоплавкий (3370 С)
К- самый мягкий
Cr – самый твёрдый
История
М.В.Ломоносов определял металл «как Светлое тело, которое ковать можно».
АЛХИМИЯ (позднелат. alchimia) донаучное направление в развитии химии.
Способы получения металлов:
Пирометаллургия - восстановление металлов из руд при высоких температурах с помощью восстановителей (углерода, оксида углерода(II), водорода, магния, алюминия).
2. Гидрометаллургия – растворение природного соединения металла с последующим восстановлением его из раствора.
3. Электрометаллургия - способ получения металла с помощью электрического тока (электролиз).
Краткое описание документа:
Презентация по учебной теме «Простые вещества – металлы».
1. Простые вещества – металлы Подготовил: Сергей Огородников
2. Положение металлов в классификации веществ Вещества Простые Металлы Неметаллы Сложные Оксиды Основания Кислоты Соли
3. Определение понятия Металлы – ковкие, пластичные тягучие вещества, которые имеют металлический блеск, тепло- и электропроводны. 87 элементов Периодической системы Д.М. Менделеева образуют в свободном состоянии простые вещества с металлической связью. Расположение ионов в кристалле щелочного металла
4. Свойства металлов: 1) Пластичность (ковкость) – свойство металлов изменять свою форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку. ЗоЗлоолтоото – самый пластичный металл.
5. Свойства металлов: • 2) металлический блеск – способность отражать свет за счёт плотной упаковки ион-атомов, которые занимают 80% от всего объёма кристалла.
6. Свойства металлов: • 3) твердость – свойство материала сопротивляться внедрению в него другого, более твёрдого тела (исключение ртуть). • 4)тепло- и электропроводность – из-за наличия свободных электронов. Ртуть
7. Свойства некоторых металлов: Ag Pt – самые блестящие Ag Cu Au Al – лучшие проводники Аu – лучший по ковкости и пластичности Os – самый тяжёлый ( 22.48 г/мл) Li – самый лёгкий (0.52 г/ мл) Hg – самый легкоплавкий (Тпл = -38.87 С) W – cамый тугоплавкий (3370 С) К- самый мягкий Cr – самый твёрдый
8. История М.В.Ломоносов определял металл «как Светлое тело, которое ковать можно». АЛХИМИЯ (позднелат. alchimia) донаучное направление в развитии химии.
9. Простые вещества:
10. Способы получения металлов: 1. Пирометаллургия - восстановление металлов из руд при высоких температурах с помощью восстановителей (углерода, оксида углерода(II), водорода, магния, алюминия). 2. Гидрометаллургия – растворение природного соединения металла с последующим восстановлением его из раствора. 3. Электрометаллургия - способ получения металла с помощью электрического тока (электролиз).
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Открытый урок по химии на тему «Химические элементы – металлы и простые вещества – металлы»
Цель Урока: на видеоуроке сформировать у учащихся целостную картину восприятия знаний о металлах.
Образовательные цели: Познакомить учащихся с особенностями строения атомов металлов, их нахождением в П.С.Х.Э., изменение металлических, то есть восстановительных свойств по периодам и группам; роль простых веществ – металлов и сложных металлосодержащих веществ в минеральной и органической «жизни» Земли. Закрепить знания о металлических кристаллических решетках, металлической связи, физических свойствах отдельных металлов.
Воспитательные цели: сформировать умение наблюдать, слушать, участвовать в обсуждении проблем, воспитывать ответственность и аккуратность при работе с реактивами.
Развивающие: формировать умение работать в коллективе, слушать и уважительно относиться к ответам других, саморазвитие и самообразование на основе мотивации к обучению.
Оборудование: коллекция «Металлы», таблица «П.С.Х.Э.» Таблица «Ряд активности металлов». Кристаллические решетки металлов, компьютер и проектор.
1. Изучение новой темы « Металлы»
1. Положение металлов в «П.С.Х.Э.» и особенности строения их атомов.
а) Малое количество электронов на внешнем уровне и большие радиусы.
б) Небольшие значения электроотрицательности и только восстановительные свойства, то есть способность отдавать электроны.
2. Закономерности в изменении металлических, а значит восстановительных свойств атомов элементов. Используя таблицу П.С.Х.Э., учащиеся сами разбирают закономерности в изменении металлических свойств.
а) В главной подгруппе число электронов на внешнем слое не изменяется.
б) Радиус атома увеличивается
в) Электроотрицательность уменьшается.
г) Восстановительные свойства усиливаются.
д) Металлические свойства увеличиваются.
Изменение этих свойств в периодах.
а) Заряды ядер атомов увеличиваются.
б) Радиусы атомов уменьшаются.
в) Число электронов на внешнем уровне увеличивается.
г) Электроотрицателтьность увеличивается.
д) Восстановительные свойства ослабевают.
е) Металлические свойства ослабевают.
3. В побочных подгруппах восстановительные свойства металлов уменьшаются. Используя таблицу «Электрохимический ряд напряжения металлов» Cu , Ag , Au .
Почему? Находят учащиеся ответы на вопрос сами ( стр. 203)
Ответ: на прочной связи валентных электронов с ядром влияет величина заряда ядра, а не радиус атома.
4. Металлы ( ионы металлов) в организме человека, макроэлементы и микроэлементы.
Самостоятельно работают учащиеся с учебником (стр.203)
Знакомятся в таблице 17с влиянием недостатка и избытка ионов металлов на состояние растений и животных .
5. Простые вещества металлы, их использование в промышленности, социальной сфере.
Учащиеся смотрят и слушают видеоролики.
6. Строение кристаллической решетки металлов.
Используем таблицу и кристаллическую решетку натрия. Обращаем внимание, что в узлах находятся катионы и анионы металлов, обобществленные электроны являются носителями тока, они притягивают катионы металлов, обеспечивают прочность кристаллической решетки, образуется металлическая связь.
7. Физические свойства металлов.
Б) Металлический блеск
В) Механическая прочность, температура плавления и плотность.
Д) Взаимодействие металлов с магнитным полем – ферромагнетики (железа, кобальт, никель, гадолиний) – сильно намагничиваются ( видеоуроки смотрим и слушаем)
8. Классификация металлов.
А) Легкие и тяжелые
Б) Легкоплавкие и тугоплавкие
В) Благородные металлы (серебро, золото, платина)
Г) Железо и его сплавы – черные металлы, все остальные - цветные
Д) Щелочные, щелочно-земельные, редкоземельные ( скандий, лантаноиды, актиноиды)
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
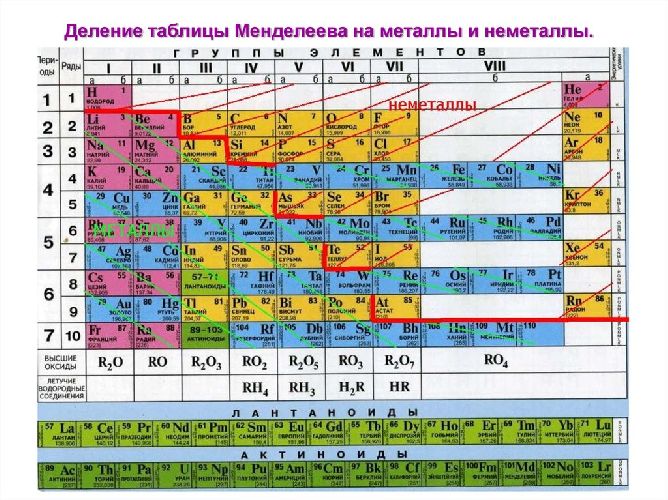
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Неметаллы

Неметаллы – элементы, которые обладают неметаллическими свойствами и занимают положение в правом верхнем углу в таблице Менделеева. Каков же характер неметаллов, а также чем они отличаются от других соединений узнаем в этой статье.
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
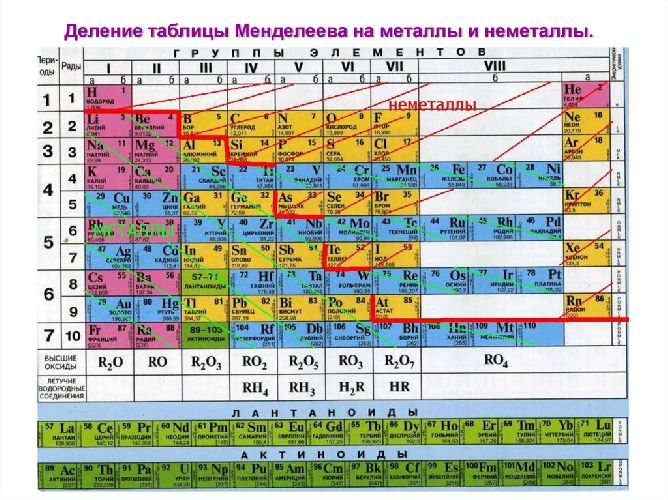
Рис. 1. Группа неметаллов в периодической системе.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Физические свойства
Для большинства неметаллов простых веществ в твердом агрегатном состоянии характерна молекулярная кристаллическая решетка. То есть эти неметаллы являются кристаллическими веществами. Поэтому при обычных условиях они имеют вид газов, жидкостей или твердых веществ с низкими температурами плавления. Примерами таких веществ являются газы: водород H2 , неон Ne, жидкость – бром Br2 , твердые вещества йод I2, сера S8, фосфор P4 (белый фосфор). Существуют неметаллы (бор, углерод, кремний), которые имеют атомные кристаллические решетки.

Рис. 2. Неметаллы – жидкости, газы, твердые.
Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера.
Химические свойства и соединения
Водородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
В результате получается натриевая соль соляной кислоты

Рис. 3. натриевая соль соляной кислоты.
соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы находят применение в разных отраслях промышленности. Вот список отраслей, где их использование является наиболее востребованным.
| Область применения | Примеры, перечень неметаллов, применяемых в той или иной промышленности |
| промышленность | Сера, азот и фосфор часто используют для получения кислот. Серу также используют на производстве резины. |
| транспорт | важным неметаллом в транспортной промышленности является водород. Его используют в качестве топлива. При сгорании такой вид топлива не загрязняет окружающую среду. |
| аграрная отрасль | сера используется для борьбы с вредными насекомыми и болезнями растений |
| медицина | Кислород используют для восстановления дыхания (кислородные подушки), уголь в форме активированного угля, который способен выводить из организма вредные вещества. |
| пищевая промышленность | азот используют для продления срока годности продуктов |
В этой статье за 9 класс химии кратко излагается основная информация о неметаллах, их строении, и о том, с чем реагируют неметаллы. Неметаллами могут быть газы, жидкости и твердые вещества с кристаллической решеткой. Самым активным неметаллом является фтор, который имеет степень окисления-1.
Читайте также:
