Металлы и неметаллы химия 7 класс
Обновлено: 05.07.2024
Простые вещества. Атомы способны соединяться с такими же или другими атомами. Это обуславливает большое разнообразие в мире веществ.
Вещество, образованное одним химическим элементом, называют простым веществом.
Простые вещества делят на металлы и неметаллы. Такую классификацию простых веществ предложил в конце XVIII в. выдающийся французский ученый А. Л. Лавуазье.
Металлы. Каждый из вас, не раздумывая, назовет несколько металлов. Они отличаются от остальных веществ особым «металлическим» блеском (рис. 41). Эти вещества имеют много других общих свойств. Металлы в обычных условиях твердые (лишь ртуть является жидкостью), хорошо проводят электрический ток и теплоту, имеют в основном достаточно высокие температуры плавления (свыше 500 °С). Они пластичны; их можно ковать, вытягивать из них проволоку.
Это интересно
До нашей эры людям были известны простые вещества 11 элементов — Au, Ag, Cu, Hg, Pb, Fe, Sn, S, C, Zn и Sb.

Рис. 41. Металлы
Благодаря своим свойствам металлы уверенно вошли в жизнь людей. Об их значении свидетельствуют названия исторических эпох: медный век, бронзовый 1 век, железный век.
Сходство металлов обусловлено их внутренним строением. Атомы размещены в металле очень плотно, и часть электронов постоянно переходит от одних атомов к другим. Благодаря этим электронам металлы проводят электрический ток, способны быстро нагреваться и охлаждаться.
Неметаллы. Простых веществ этого типа значительно меньше. К неметаллам относятся азот, кислород, графит, алмаз, сера, иод и др. (рис. 42).
Неметаллы отличаются от металлов прежде всего отсутствием металлического блеска. Лишь графит, иод, кристаллические бор и силиций имеют такой блеск. Неметаллы не проводят электрический ток (исключение — графит). В обычных условиях часть неметаллов находится в газообразном состоянии (металла-газа не существует), другие являются твердыми веществами, и только бром — жидкостью.
Между собой неметаллы существенно различаются.
1 Бронза — сплав меди с оловом.

Рис. 42. Неметаллы
Часть неметаллов состоит из атомов. В алмазе, графите, боре, силиции, красном фосфоре все атомы соединены друг с другом, а в инертных газах — гелии, неоне, аргоне, криптоне, ксеноне и радоне — они разъединены.
Другие неметаллы образованы молекулами. Атомы в каждой молекуле прочно соединены между собой, а молекулы лишь слабо притягиваются друг к другу. Поэтому вещества молекулярного строения имеют невысокие температуры плавления и кипения.
Из молекул состоят простые вещества Оксигена — кислород и озон. Молекула кислорода содержит два атома, а молекула озона — три (рис. 43).
Рис. 43. Модели молекул: а — кислорода; б — озона
Не только Оксиген, но и немало других элементов образуют по два и более простых веществ. Поэтому простых веществ существует больше, чем химических элементов.
Названия простых веществ. Большинство простых веществ называют так, как и соответствующие химические элементы. Если названия разные, то они приведены в периодической системе, причем название простого вещества расположено ниже названия элемента (рис. 44).

Рис. 44. Клетка периодической системы
- Назовите простые вещества элементов Лития, Гидрогена, Магния, Нитрогена.
Названия простых веществ внутри предложения записывают с маленькой буквы; они не являются именами собственными. Пример такого предложения: «Неметалл бор состоит из атомов элемента Бора».
Металлические и неметаллические элементы. Химические элементы, от которых происходят металлы, называют металлическими, а те, которые образуют неметаллы, — неметаллическими. В длинном варианте периодической системы (форзац II) они разделены диагональной ломаной линией. Металлические элементы размещены слева от нее; их значительно больше, чем неметаллических элементов.
Элементы Германий, Стибий, Полоний, клетки которых находятся у диагональной линии, образуют простые вещества, напоминающие по некоторым свойствам металлы, а по другим свойствам — неметаллы.
Выводы
Каждое простое вещество образовано одним элементом.
Простые вещества делят на металлы и неметаллы, а химические элементы — на металлические и неметаллические.
Металлы имеют немало общих свойств благодаря сходству внутреннего строения.
Неметаллы состоят из атомов или молекул и по свойствам отличаются от металлов, а нередко — и друг от друга.
73. Какое вещество называют простым? Назовите несколько таких веществ.
74. Какие типы простых веществ существуют? Как называют соответствующие элементы?
75. Укажите правильное окончание предложения «Каждое простое вещество образовано. »:
- а) одинаковыми молекулами;
- б) одним химическим элементом;
- в) одним металлическим элементом;
- г) одним неметаллическим элементом.
76. По каким физическим свойствам металл можно отличить от неметалла?
77. Заполните пропуски, вставив в соответствующих падежах слова «Нитроген» или «азот», и объясните ваш выбор:
- а) . — газ, которого в воздухе содержится наибольшее количество;
- б) молекула . состоит из двух атомов . ;
- в) соединения . поступают в растения из почвы;
- г) . плохо растворяется в воде.
78. Заполните пропуски, вставив слова «элемент», «атом» или «молекула» в соответствующем падеже и числе:
- а) . белого фосфора содержит четыре . Фосфора;
- б) золото — простое вещество . Аурума.
79. Какие элементы образуют следующие простые вещества: фтор, золото, цинк, фосфор, ртуть?
80. Назовите простые вещества элементов Pb, Са, Не, Ag, В.
81. Какая ошибка допущена в утверждении «В яблоках есть железо»? Исправьте ее, используя правильное химическое название.
82. Найдите соответствие, воспользовавшись длинным вариантом периодической системы:
Алюминий и цинк как амфотерные элементы
Среди химических веществ выделяют три группы веществ, исходя из основных химических свойств. Если первые две группы понятны – металлы и неметаллы, то третья группа воспринимается с трудом – амфотерные. С физической точки зрения они могут быть неотличимы от обычных металлов, но химически, могут быть как восстановителями, так и окислителями. На данном уроке разберемся с особенностями амфотерных элементов.
План урока:
Основное понятие амфотерности
Что такое металлы и неметаллы – понять нетрудно. Металлы обладают восстановительными свойствами и в химической реакции отдают электроны. При этом, гидроксиды металлов – это основания. Неметаллы, напротив, являются окислителями и забирают электроны. Гидроксиды неметаллов – это кислоты.
Амфотерные соединения могут проявлять как окислительные, так и восстановительные свойства в зависимости от реакционной среды. Гидроксиды таких атомов могут выступать в качестве кислот или оснований.
Расположение амфотерных элементов в таблице Менделеева
В таблице Менделеева положение того или иного атома сообщает значительную часть информации о строении атома этого элемента и его химических свойствах. Периодической эта система называется, потому что в разных периодах (горизонтальные строчки) и группах (вертикальные столбцы) повторяется определенное качество элементов. Так, вся первая группа является щелочными металлами, а седьмая – галогенами (неметаллами), восьмая – инертными газами. Но, это характерно только для главной подгруппы. В побочной группе располагаются амфотерные элементы.
Строение атома амфотерных элементов
Особенность химических свойств амфотерных элементов связана со строением их атомов. У них происходит предзаполнение s-подуровня, из-за этого, незаполненным оказывается всегда d-подуровень. Все представители побочных подгрупп являются p- или d-элементами. В различных условиях может происходить перескок электронов с подуровней и увеличение неспаренных электронов.
Таблица. Строение атомов некоторых амфотерных элементов
Для некоторых из них характерен проскок электрона. Это состояние, при котором электрон с последнего уровня перескакивает на следующий. По этой причине оказывается неспаренным s-электрон.
Представители амфотерных элементов
Все элементы побочных групп являются амфотерными и проявляют сходные химические свойства. Наиболее распространены в природе три элемента: Al, Zn и Cr.
Цинк как амфотерный элемент
Цинк — это относительно мягкий светло-серый металл. Является одним из самых распространенных амфотерных элементов. В природе цинк встречается в составе 66 минералов, наиболее распространенные представлены в таблице.
Таблица. Минералы, в состав которых входит Zn
Цинк является d-элементом.
Химические свойства цинка обусловлены наличием незаполненной p-обитали. С s-подуровня происходит перескок электрона, за счет чего появляется два неспаренных электрона: Zn* 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 4p 1 .
Алюминий как амфотерный элемент
Al является самым распространенных элементом не только среди металлов, но и во всей таблице Менделеева. Он занимает 3 место после кислорода (O2) и кремния (Si).
Это мягкое вещество серебристо-серого цвета с низкой температурой плавления. В природе встречается как в виде минералов, так и в виде самородков. Является примесью многих минералов.
Наиболее распространенные минералы, содержащие Al:
Последний минерал в зависимости от примесей имеет разный окрас. Применяется в ювелирном деле и считается полудрагоценным камнем.
Его атом содержит 13 электронов, распределенных по 3 электронным уровням: 1s 2 2s 2 2p 6 3s 2 3p 1 . Это р-элемент, у которого может происходить переход электрона с s-подуровня на свободную р-орбиталь. За счет этого, металл приобретает 3 неспаренных электрона: Al* 1s 2 2s 2 2p 6 3s 1 3p 2
Свойства металлов Al и Zn как простых веществ
Цинк – довольно плотный металл. Сохраняет свои качества в небольшом диапазоне температур: при низких значениях (до -30) становится хрупким, при температурах выше 100 0 С очень пластичен. Это используется в металлургии, прокатывая цинковые листы толщиной несколько миллиметров (цинковая фольга). Некоторые примеси резко повышают хрупкость металла, поэтому используется очищенный материал.
Al – сильно пластичный легкий металл с низкой температурой плавления. Обладает высокой ковкостью и электропроводностью.
На воздухе он покрывается оксидной пленкой поэтому практически не подвергается коррозии. Благодаря этому он используется при изготовлении проводов и корпусов машинной техники.
Получение алюминия и цинка
Основной способ получения металлов – выделение их из состава руды. Для этого используется наиболее богатая металлом горная порода. Алюминий получают из боксита. Этот процесс состоит из трех этапов:
- Добыча горной породы;
- Обогащение (увеличение концентрации метала за счет очистки от примесей);
- Выделение чистого вещества путем электролиза.
Получение цинка производится несколькими методами – электролитическим (так же как и Al) и пирометаллургический. Второй способ основан на восстановлении цинка из его оксида углеродом или оксидом углерода II (угарным газом):
ZnO + CO ⇄ Zn + CO2
Достоинство этого метода в том, что продукты первой реакции могут использоваться во второй, что снижает количество выбросов в атмосферу.
Химические свойства алюминия и цинка
Оба вещества способны реагировать как обычные металлы. Так же, есть ряд специфических реакций.
Взаимодействие с неметаллами
С неметаллами и оба вещества взаимодействуют с образованием бинарных соединений – солей. Как правило, скорость течения реакции и условия зависят от активности неметалла. Так, с кислородом реакция идет реакция образования оксида при нагревании с цинком:
с алюминием в обычных условиях:
Оксид алюминия покрывает изделие плотной пленкой (оксидная пленка) и доступ кислорода прекращается, поэтому, для полной реакции его нужно брать в порошке.
Zn не реагирует с Br, N2, Si, C, H2.
Al не вступает в реакцию только с H2.
Взаимодействие с металлами
С восстановителями оба металла образуют сплавы:
Это не является химической реакцией, так как не происходит передачи электронов или изменения химических свойств веществ.
Взаимодействие с кислотами и щелочами
С кислотами и алюминий, и цинк взаимодействуют при обычных условиях с образованием солей:
Результат реакции со щелочами зависит от условий реакции: если реакция идет в растворе (в присутствии воды), то образуются комплексные соли:
В безводной среде (сплавление) образуются соли металлических кислот:
2Al + 6KOH = 2KAlO2 + 2K2O + 3H2 (KAlO2 – алюминат калия).
Взаимодействие с водой
Алюминий активно взаимодействует с водой, если очистить оксидную пленку. Реакцию нужно проводить быстро, так как пленка образуется практически мгновенно:
Zn реагирует с водой при очень высокой температуре (при накаливании до красного состояния):
Оксиды цинка и алюминия
ZnO – оксид, широко используемый в химической промышленности. Он применяется для получения солей. В реакции со щелочами образуются комплексные соли, легко разрушаемые кислотами.
Al2O3 –глинозем. Имеет очень плотную кристаллическую решетку, из-за чего практически не реагирует при обычных условиях. При экстремально высоких температурах вступает в реакцию со щелочами:
Может вступать в реакцию с кипящими кислотами с образованием комплексных солей.
Применение алюминия и цинка
Al как самый распространенный элемент широко используется в химической промышленности. Он способен вытеснять восстановители из соединений, поэтому применяется для получения металлов. Такой метод называется алюмотермия.
Благодаря оксидной пленке и низкой плотности используется в автомобиле-, самолето- и ракетостроении для снижения массы изделия. В строительстве алюминий применяется для изготовления каркасов высотных зданий.
Zn применяется для снижения коррозии металлических изделий –цинкование. Порошок этого металла используется для изготовления масляных красок с металлическим блеском. Также, оксид служит в качестве антисептика. Мази на основе цинкового порошка используются в лечении лишаев и других инфекционных поражений кожи.
Сплавы алюминия и цинка
В металлургии практически не применяются в чистом виде из-за высокой пластичности. Для того чтобы сохранить достоинства металлов, но убрать недостатки осуществляют сплавление с другими металлами.
Сплавы алюминия
Сплавы алюминия делятся на две группы:
- Литейные (без сохранения пластичности);
- Конструкционные (деформируемые).
Таблица. Характеристика основных сплавов алюминия
Сплавы цинка
Самый используемый сплав цинка – латунь (Cu — Zn). Он обладает хорошими сварными свойствами, поэтому применяется в изготовлении кухонной утвари и различных изделий интерьера.
Если к этому сплаву добавляют свинец, этот сплав называется мунц-металл. Оба сплава применяются при литье труб и каркасов.
Металлы и неметаллы
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Разработка урока на тему: " Простые и сложные вещества. Металлы и неметаллы"

На данном уроке учащиеся познакомятся с классификацией веществ на простые и сложные, ознакомятся с делением простых веществ на металлы и неметаллы, научатся различать металлические и неметаллические элементы по их положению в периодической системе.
Просмотр содержимого документа
«Разработка урока на тему: " Простые и сложные вещества. Металлы и неметаллы"»
Класс: Дата:
Тема: Простые и сложные вещества. Металлы и неметаллы.
образовательная: сформировать понятие о простых и сложных веществах; ознакомится с делением простых веществ на металлы и неметаллы; научить различать металлические и неметаллические элементы по их положению в периодической системе; показать существенную разницу химических свойств металлов и неметаллов;
развивающая: развивать память, логическое мышление, внимание, умение сравнивать;
воспитательная: воспитывать аккуратность, усидчивость, внимательность, коммуникативность.
Оборудование и материалы: ПСХЭ Д .И. Менделеева; карточки с названиями повторяемых понятий; карточки с формулами простых и сложных веществ; карточки-задания для проверки домашнего задания; образцы простых и сложных веществ, карточки с заданиями для работы в группах.
І Организационный момент
II. Проверка домашнего задания
Несколько учеников получают карточки-задания ( Приложение 1)
Используя метод «Горячий стул», проверяется домашнее задание у остальных учащихся. Проверяемые понятия: атом, молекула, ион, катион, анион, ядро атома, электрон.
(Приложение 2)
Фронтальный опрос
-Какие частицы входят в состав ядра атома?
-Как определить количество протонов в ядре атома?
-Как определить количество электронов в атоме?
- Определите количество протонов, количество электронов, заряд ядра и атомную массу элементов: хлор, магний, олово, цинк; элементов № 35, 13, 52.
ІІІ. Определение темы и целей урока
- Что такое вещества?
-Итак, ребята, из каких частиц могут состоять вещества? (из атомов, молекул , ионов)
Сегодня мы узнаем на какие группы делятся вещества, по какому признаку их делят и какими свойствами обладают эти группы веществ .Тема урока: «Простые и сложные вещества. Металлы и неметаллы»
IV.Изучение нового материала
1.Понятие о простых и сложных веществах
На доске таблички с формулами простых и сложных веществ.(Приложение 3) Учитель предлагает желающим разделить эти вещества на 2 группы и объяснить по какому признаку произошло деление.
Рассказ учителя с элементами беседы
Все вещества можно разделить на 2 большие группы, в зависимости от того, какие элементы входят в его состав.
Состоят из атомов одного хим. элемента Состоят из атомов разных хим. элементов
Простые вещества могут быть металлами или неметаллами.
-Давайте вспомним, какие физические свойства характерны для металлов:
1) металлический блеск;
2) серый цвет (кроме меди);
3) твёрдые ( кроме ртути);
4) проводят электрический ток и тепло;
Металлы- вещества немолекулярного строения.
Демонстрация картинок простых веществ-неметаллов. Неметаллы имеют молекулярное или немолекулярное строение и следующие физические свойства:
1)имеют матовую поверхность ( сера, уголь, графит)
2)окрашены в различные цвета;
3)твёрдые, газообразные, жидкие;
4)плохо проводят электрический ток и теплоту;
Простые вещества металлы и неметаллы состоят из элементов металлов или неметаллов.
Na, Ca, Al, Mg S,P,N,C
Демонстрация периодической системы химических элементов Д.И.Менделеева.
Посмотрим в периодическую систему. Условная диагональ от бора к астату разделяет периодическую систему на 2 части: в нижней части таблицы- элементы металлы, а в верхней правой части находятся элементы-неметаллы( кроме элементов побочных подгрупп. Известны элементы, которые проявляют как свойства металлов, так свойства неметаллов( элементы железо, германий). Отдельная группа элементов- это элементы главной подгруппы 8 группы: гелий, неон, аргон, криптон, ксенон и радон. Их называют инертными газами или благородными элементами, поскольку они не проявляют ни свойств металлов, ни свойств неметаллов.
V.Физкультминутка
VI.Закрепление материала
1.Работа с раздаточным материалом ( Приложение 4)
Поработайте в парах
1.Выпишите отдельно формулы простых и сложных веществ: Cu ; CaSO3 ; S; H2 SO4 ; KNO3; Cl 2 ; HPO3 ; KH ; H2 ; SO3 ; Al ; B r2 .
2.Выпишите отдельно символы элементов-металлов и элементов-неметаллов, которые имеют такие порядковые номера: 5, 7, 11,12,17,19,20,35.
Металлы и неметаллы – в чем разница и как понять, когда металлические свойства усиливаются, а когда ослабевают

Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Итак. В атоме есть три частицы: протоны, нейтроны и электроны. У протонов заряд +1, у электронов -1. У нейтронов заряда нет.
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.

Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:

Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
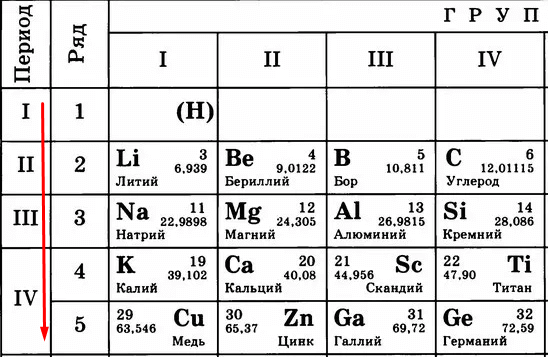
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Еще про радиус
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
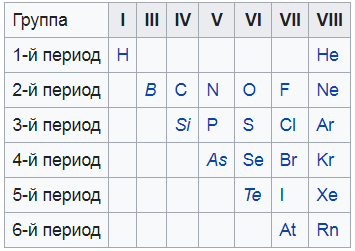
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
- Плавятся.
- Их можно ковать.
- Обладают металлическим блеском.
- Проводят электрический ток. Это происходит благодаря металлической связи, которая соединяет их атомы.
- Проводят тепло.
- Твердые – это касается всех, кроме ртути.
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Читайте также:
