Металлы и сплавы строение полиморфизм
Обновлено: 17.05.2024
Многие вещества могут образовывать кристаллические формы, имеющие различные структуру и свойства, но одинаковый состав (полиморфные модификации). Полиморфизм - способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и свойствами при одном и том же химическом составе. Это слово происходит от греческого «полиморфос» - многообразный. Явление полиморфизма было открыто М. Клапротом, который в 1798 г. обнаружил, что два разных минерала - кальцит и арагонит - имеют одинаковый химический состав СаСОз.
Полиморфизм простых веществ обычно называют аллотропией, в то же время понятие полиморфизма не относится к некристаллическим аллотропным формам (например, газообразным Ог и Оз). Типичный пример полиморфных форм - модификации углерода (рис. 5.1), которые резко различаются по свойствам. Наиболее стабильной формой существования углерода является графит, однако и другие его модификации при обычных условиях могут сохраняться сколько угодно долго. При высоких температурах они переходят в графит. В случае алмаза это происходит при нагревании выше 1000 °С в отсутствие кислорода.

Рис. 5.1. Аллотропные формы углерода: а - лонсдейлит; 6 - алмаз; в - графит; г - аморфный углерод; д - С60 (фуллерен); е - графен; ж - однослойная нанотрубка
Обратный переход осуществить гораздо труднее. Необходима не только высокая температура (1 200-1 600 °С), но и гигантское давление - до 100 тысяч атмосфер. Превращение графита в алмаз проходит легче в присутствии расплавленных металлов (железа, кобальта, хрома и других).
В случае молекулярных кристаллов полиморфизм проявляется в различной упаковке молекул в кристалле или в изменении формы молекул, а в ионных кристаллах - в различном взаимном расположении катионов и анионов. Некоторые простые и сложные вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция - шесть, нитрат аммония - четыре. Полиморфные модификации принято обозначать греческими буквами а, р, у, 8, в. начиная с модификаций, устойчивых при низких температурах.
При кристаллизации из пара, раствора или расплава вещества, имеющего несколько полиморфных модификаций, сначала образуется модификация менее устойчивая в данных условиях, которая затем превращается в более устойчивую. Например, при конденсации пара фосфора образуется белый фосфор, который в обычных условиях медленно, а при нагревании быстрее превращается в красный фосфор (рис. 5.2). При обезвоживании гидроксида свинца вначале (около 70 °С) образуется менее устойчивый при низких температурах желтый р-РЬО, около 100 °С он превращается в красный а-РЬО, а при 540 °С - снова в р-РЪО.
Переход одной полиморфной модификации в другую называется полиморфными превращениями. Эти переходы происходят при изменении температуры или давления и сопровождаются скачкообразным изменением свойств.

Рис. 5.2. Аллотропные модификации фосфора: а - белый фосфор; б - красный фосфор; в - черный фосфор; г - металлический фосфор
Процесс перехода одной модификации в другую может быть обратимым или необратимым. Так, при нагревании белого мягкого графитоподобного вещества состава BN (нитрид бора) при 1 500-1 800 °С и давлении в несколько десятков атмосфер образуется его высокотемпературная модификация - боразон, по твердости близкий к алмазу. При понижении температуры и давления до значений, отвечающих обычным условиям, бо- разон сохраняет свою структуру. Примером обратимого перехода могут служить взаимные превращения двух модификаций серы (ромбической и моноклинной) при 95 °С.
Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует, например, при переходе a-Fe в p-Fe при 769 °С структура железа не меняется, однако исчезают его ферромагнитные свойства.
В табл. 5.1 показан интервал температур существования различных аллотропических форм некоторых имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.
Интервал температур существования различных аллотропических форм
некоторых металлов
Интервал температур устойчивого состояния, °С
менее 911 от 1392 до 1539 от 911 до 1392
Кубическая объемно центрированная Кубическая гранецентрированная
менее 450 от 450 до 1480
менее 18 от 18 до 232
Тетрагональная объемно центрированная
менее 700 от 700 до 1079 от 1079 до1143 от 1143 до 1244
Кубическая сложная многоатомная Кубическая сложная многоатомная Тетрагональная гранецентрированная Кубическая объемно центрированная
менее 882 от 882 до 1660
Кубическая объемно центрированная
менее 867 от 867 до 1860
от 668 до 720 от 720 до 1132
Рис. 5.3. Кривые охлаждения и нагрева металла, имеющего аллотропические превращения
Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой (в координатах температура-время) превращение отмечается горизонтальным участком (рис. 5.3). При охлаждении происходит выделение тепла (выделение скрытой теплоты превращения) теоретически при такой же температуре, что и при нагреве, но практически при несколько более низкой вследствие переохлаждения.
Явление полиморфизма основано на приведенном едином законе об устойчивости состояния с наименьшим запасом энергии.
Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация а, а в другом - модификация р и т. д. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного ( Рис. 5.5. Диаграммы состояний систем Ti-легирующий элемент (схемы): а - Ti-a-стабилизаторы; б - Ti-изоморфные (3-стабилизаторы; в - Ti-эвтектоидообразующие (3-стабилизаторы; г - нейтральные элементы
Нейтральные элементы (Zr, Sn) не оказывают существенного влияния на температуру полиморфного превращения и не меняют фазового состава титановых сплавов (рис. 5.5, г).
Аллотропия олова. Олово существует в двух модификациях. Ниже температуры 18 °С устойчиво так называемое серое а-олово. При охлаждении а-олово появляется на обыкновенном белом олове ((3-модификация) в виде отдельных бугорков на поверхности (так называемая оловянная чума) (рис. 5.6). Решетка белого олова с координационным числом 6 в полтора раза компактнее решетки серого олова, имеющего решетку алмаза с координационным числом 4. Поэтому превращение белого олова в серое сопровождается увеличением объема примерно на 25 %. Серое олово представляет собой серый порошок, не обладающий металлическими свойствами. Хотя температура равновесия Sna -Snp равна плюс 18 °С, превращение при этой и немного более низкой температуре происходит с весьма малой скоростью. Максимальное значение скорости кристаллизации получается при переохлаждении п - 50 °С (т. е. при минус 32 °С), когда скорость превращения рва равняется 0,004 мм/ч. Ввиду столь малой скорости превращения р-олово весьма склонно к переохлаждению и сравнительно длительное время может сохраняться при температурах ниже 18 °С.
Изучение явлений полиморфизма имеет громадное практическое значение. Это необходимо учитывать в науке и технике при создании и использовании материалов. Ярким примером в этом отношении является болезнь белого олова - так называемая оловянная чума. Переход из белой разновидности в серую сопровождается резким увеличением объема (на 25,6 %), и белое олово рассыпается в серый порошок.

Рис. 5.6. Аллотропные модификации олова: (3-форма (белое олово в виде металлической гантели); a-форма (серое олово в виде порошка)
Это случилось в конце XVIII в. в Петербурге на одном из неотапливаемых складов военного обмундирования, когда зимой под воздействием низких температур большие запасы начищенных белых пуговиц, изготовленных из олова, рассыпались в порошок. То же самое произошло с брусками белого олова, отправленного однажды из Голландии в Москву. Вместо слитков поезд привёз серый порошок.
Если серое олово обдать кипятком, оно, от сильного нагревания перейдёт обратно в белую разновидность. Конечно, при этом не восстановятся ни слитки, ни пуговицы, а получится лишь порошок белого цвета.
Известны также трагические последствия «болезни» белого олова. Так, антарктическая экспедиция английского полярного исследователя Роберта Скотта к Южному полюсу, достигнув его 18 января 1912 г. (на 33 дня позже норвежского полярного исследователя Р. Амундсена), погибла на обратном пути. Одна из причин - разрушение «чумой» паянных оловом сосудов с жидким топливом.
Полиморфизм металлов
Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры материала. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения.
Различные кристаллографические модификации одного материала принято обозначать буквами греческого алфавита α, β, g, δ, ε, σ и т.д. Модификацию, наблюдаемую при самых низких температурах, обозначают буквой α, при более высоких температурах – β, и т.д.
Ярким примером полиморфизма у неметаллических материалов является наличие двух кристаллографических модификаций чистого углерода, известных как алмаз и графит. Оба материала являются идентичными по химическому составу и отличаются лишь кристаллической структурой. В результате свойства алмаза и графита оказываются существенно различными. Графит это мягкий, хрупкий и непрозрачный материал, в то время как алмаз является одним из наиболее твёрдых минералов, встречающихся в природе, и, как правило, прозрачен.
Полиморфизм достаточно распространённое явление в мире металлов. Многие из металлов обладают полиморфизмом. Например, у Со с повышением температуры ГПУ-структура перестраивается в ГЦК-структуру, а у Ti ГПУ-структура перестраивается в ОЦК-структуру.
Наиболее ярко полиморфизм проявляется у железа, которое при нагреве два раза меняет свою кристаллическую структуру (рис. 11).
ОЦК ГЦК ОЦК жидкость
α-Fe β-Fe γ-Fe δ-Fe
768 911 1392 1539 Т, °С.
Рис. 11. Кристаллографические модификации железа.
При температурах ниже 768°С железо является ферромагнитным материалом, а при температурах выше 768°С – парамагнитным. Ранее считали, что изменение магнитных свойств железа связано с изменением его кристаллической структуры и поэтому ферромагнитное железо стали обозначать α-Fe, а парамагнитное – β-Fe. Позже выяснилось, что это не так. И то и другое железо имеют одинаковую ОЦК-структуру. Однако исторически сложившееся подразделение железа на α-Fe и β-Fe сохранили. В настоящее время железо с ОЦК-структурой, наблюдаемое в интервале температур до 911 ° С, называют α-железом.
В интервале температур от 911 до 1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК-структуры более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение размера (объёма) образца.
В интервале температур от 1392 до 1539°С железо вновь имеет ОЦК-структуру. Однако период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe.
При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав.
Другим ярким примером полиморфизма металлов является полиморфизм олова. При температурах ниже -30°С белое и пластичное β-олово (β –Sn) превращается в свою α-модификацию, т.е. в α-Sn, которое является серым порошком. Не имея никакого представления о природе данного явления, его, в своё время, назвали «оловянной чумой».
Явление полиморфизма в очередной раз подчёркивает, что свойства материалов определяются не только их химическим составом, но и в значительной степени их структурой.
3. ФОРМИРОВАНИЕ МИКРОСТРУКТУРЫ МЕТАЛЛОВ
И СПЛАВОВ ПРИ ЗАТВЕРДЕВАНИИ
Процесс перехода вещества из жидкого состояния в твёрдое кристаллическое состояниеназывают кристаллизацией. Обратный процесс называют плавлением. Рассмотрим подробно процесс кристаллизации металлов.
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
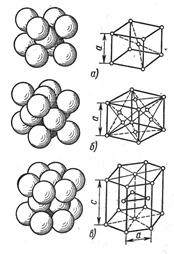
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Строение металлов
В технике под металлами понимают вещества, обладающие комплексов металлических свойств: характерным металлическим блеском, высокой электропроводностью, хорошей теплопроводностью, высокой пластичностью.
Кристаллические решетки. Все вещества в твердом состоянии могут иметь кристаллическое или аморфное строение. В аморфном веществе атомы расположены хаотично, а в кристаллическом — в строго определенном порядке. Все металлы в твердом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой,
На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток. В кубической объемно-центрированной решетке (рис. 2, а) атомы расположены в ушах ячейки и один атом в центре куба.
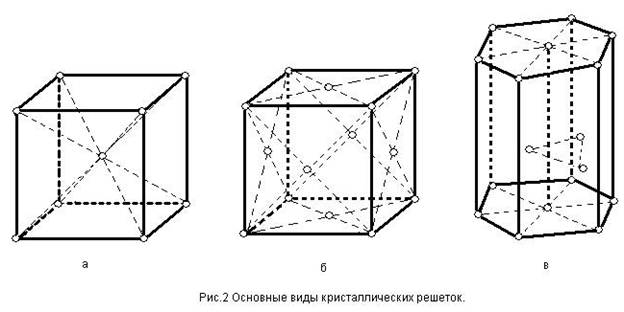
Такую решетку имеют хром, вольфрам, молибден и др. В кубической гранецентрированной решетке (рис. 2, б) атомы расположены в вершинах куба и в центре каждой грани. Эту решетку имеют алюминий, медь, никель и другие металлы. В гексагональной плотноупакованной решетке (рис. 2, в) атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома в середине призмы. Такой тип решетки имеют магний, цинк и некоторые другие металлы.
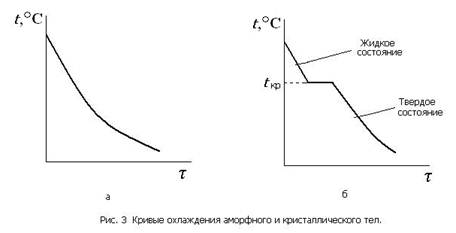
Кристаллизация металлов. Процесс образования в металлах кристаллической решетки называется кристаллизацией. Для изучения процесса кристаллизации строят кривые охлаждения металлов, которые показывают изменение температуры (t) во времени (τ). На рис. 3 приведены кривые охлаждения аморфного и кристаллического веществ. Затвердевание аморфного вещества (рис. 3, а) происходит постепенно, без резко выраженной границы между жидким и твердым состоянием- На кривой охлаждения кристаллического вещества (рис. 3, б) имеется горизонтальный участок с температурой tкр, называемой температурой кристаллизации. Наличие этого участка говорит о том, что процесс сопровождается выделением скрытой теплоты кристаллизации. Длина горизонтального участка — это время кристаллизации.
Кристаллизация металла происходит постепенно. Она объединяет два процесса, происходящих одновременно: возникновение центров кристаллизации и рост кристаллов. В процессе кристаллизации когда растущий кристалл окружен жидкостью, он имеет правильную геометрическую форму. При столкновении растущих кристаллов их правильная форма нарушается (рис. 4). После окончания кристаллизации образуются кристаллы неправильной
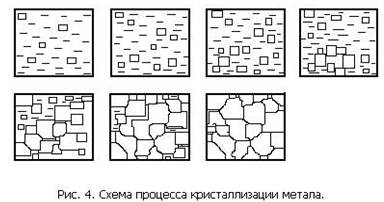
формы, которые называются зернами или кристаллитами. Внутри каждого зерна имеется определенная ориентация кристаллической решетки, отличающаяся от ориентации решеток соседних зерен.
Полиморфизм. Некоторые металлы в зависимости от температуры могут существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением. Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре. Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Важное значение имеет полиморфизм железа. На рис. 5 изображена кривая охлаждения железа.
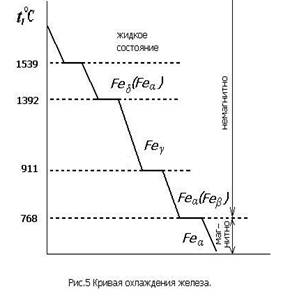
Полиморфные превращения характеризуются горизонтальными участками на кривой охлаждения, так как при них происходит полная перекристаллизация металла. До 911°С устойчиво Feα, имеющее кубическую объемноцептрированную решетку. В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ. Остановка на кривой охлаждения при 768 °С связана не с полиморфным превращением, а с изменением магнитных свойств. До 768 °С железо магнитно, а выше — немагнитно.
Дефекты кристаллического строения. Реальный металлический кристалл всегда имеет дефекты кристаллического строения. Они подразделяются на точечные, линейные и поверхностные (рис. 6).
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а), а также замещенные атомы примеси (рис. 6, б) и внедренные атомы (рис. 6, в) которые могут быть как примесными, так и атомами основного металла.
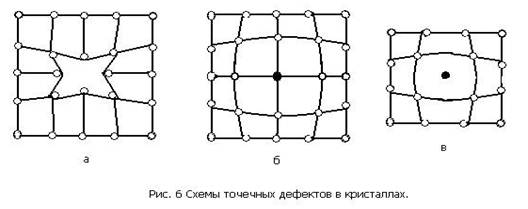
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями. Краевая дислокация (рис. 7) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости.
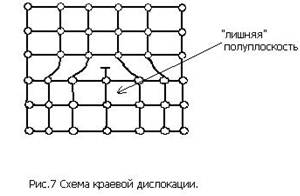
Поверхностные дефекты малы только в одном измерении. К ним относятся, например, границы между отдельными зернами или группами зерен.
Наклеп и рекристаллизация. При пластической деформации изменяется не только форма и размеры металла, но также его внутреннее строение и механические свойства. Зерна разворачиваются, деформируются и сплющиваются, вытягиваясь в направлении деформации. Образуется волокнистая структура. При этом прочность и твердость металла повышаются, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом.
Волокнистое строение и наклеп могут быть устранены при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве (до 300…400 °С для железа). Но волокнистая структура при этом сохраняется. При нагреве до более высокой температуры в металле происходит образование новых равноосных зерен. Этот процесс называется рекристаллизацией. Наклеп при этом снимается полностью.
Температура, при которой начинается процесс рекристаллизации называется температурой рекристаллизации. Абсолютная температура рекристаллизации Тp связана с абсолютной температурой плавления простой зависимостью:
где а — коэффициент, зависящий от состава и структуры металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3…0,4, для сплавов а = 0,5…0,6.
Если деформирование металла происходит при температуре, которая выше температуры рекристаллизации, то наклеп после деформации не возникает. Такая деформация называется горячей. При горячей деформации идут одновременно процессы упрочнения и рекристаллизации. Деформация, которая происходит ниже температуры рекристаллизации называется холодной.
Полиморфные превращения в металлах
Для ряда металлов характерно явление полиморфизма — способность иметь различные типы кристаллической решетки. Так, при разных температурах, железо может иметь ОЦК или ГЦК решетку, кобальт — ГЦК или ГПЦ решетку, полиморфизм характерен и для других металлов.
Различные кристаллические формы одного и того же вещества называются полиморфными или аллотропными модификациями. Низкотемпературную модификацию обозначают а, а высокотемпературные — (3, у, 5 и т. д. Превращение одной модификации в другую с изменением кристаллической решетки называется полиморфным превращением. Полиморфные превращения происходят в результате нагрева или охлаждения, в чистых металлах при постоянной температуре, в сплавах — в интервале температур.
Строение реальных металлов
Реальное строение металлов значительно отличается от идеального. Под идеальным строением кристаллов подразумевается такое, при котором все атомы находятся строго в узлах кристаллической решетки (см. подразд. 1.2.1). Теоретическая прочность такого металла чрезвычайно высока. Теоретическую прочность при сдвиге (под действием касательных напряжений) можно определить по формуле G — модуль сдвига (Юнга).
В соответствии с этой формулой теоретический предел прочности железа должен составлять примерно 13 000 МПа (для железа G = 80000 МПа). В действительности же, прочность железа примерно в 100 раз меньше — 150 МПа. Такое несоответствие объясняется различием теоретического и реального строения металлов.

Рис. 1.7. Схема точечных дефектов: а — дислоцированный атом; б — вакансия
Во-первых, технические металлы состоят из большого количества кристаллов (зерен), т. е. являются поликристаллическими. При этом кристаллы (зерна) в реальном металле не имеют правильной формы и идеально правильного расположения атомов. Во-вторых, даже в самих поликристаллах имеются различного рода несовершенства. Различают точечные, линейные и поверхностные несовершенства кристаллического строения.
Точечные несовершенства малы во всех трех измерениях. К ним относят вакансии, междоузельные (дислоцированные) атомы (рис. 1.7). Образование точечных несовершенств связано с диффузионным перемещением атомов под действием тепловых колебаний. С повышением температуры металла число вакансий растет. Точечные дефекты оказывают влияние на некоторые физические свойства металлов (электропроводность, магнитные свойства и т. д.), а также на фазовые превращения в металлах и сплавах.
Линейные несовершенства имеют малые размеры в двух измерениях и большую протяженность в третьем измерении. Эти несовершенства называются дислокациями. Дислокации образуются в процессе кристаллизации и, главным образом, при деформации металла. Различают краевые, винтовые и смешанные дислокации.

Рис. 1.8. Линейный дефект кристаллической решетки (дислокация)
Рассмотрим краевую дислокацию. Она представляет собой искажение строения в виде лишней полуплоскости атомов (экстраплоскость) в верхней части кристаллической решетки (рис. 1.8). Краевая дислокация простирается в длину на тысячи атомных рядов, может быть прямой, а также изгибаться в ту или другую сторону. Наличие дислокаций определяет, главным образом, прочность металлов.
В идеальном металле для сдвига одной его части относительно другой необходимо одновременно разрушить (разорвать) все межатомные связи. При наличии дислокаций это достигается не одновременным разрушением всех межатомных связей, а последовательным — одна за другой, при этом происходит перемещение дислокации (рис. 1.9). Естественно, что это требует значительно меньших затрат энергии. Дислокации могут перемещаться при очень малых напряжениях, меньших 10 4 Па.

Рис. 1.9. Схема скольжения краевой дислокации: а — г — этапы перемещения дислокации

Рис. 1.10. Зависимость прочности металла от искажений кристаллической решетки
Поскольку пластическая деформация облегчается за счет скольжения дислокаций, то повышение прочности может быть достигнуто либо получением металла идеального строения, либо за счет создания препятствий на пути движения дислокаций. Препятствиями могут служить другие дислокации, атомы примесей, границы зерен, т. е. дефекты строения решетки (рис. 1.10).
Прочность, близкую к теоретической, получают на очень тонких бездислокаци- онных кристаллах, получивших название усы, на реальных деталях ее получить пока невозможно. Поэтому реально увеличить прочность удается путем повышения плотности дефектов за счет различных механизмов упрочнения (наклепа, дисперсионного твердения, перекристаллизации).
Поверхностные несовершенства малы только в одном измерении. Такими дефектами являются поверхности раздела между отдельными зернами. Граница зерна представляют собой переходную область шириной до 10 межатомных расстояний, в которых решетка одного зерна с определенной кристаллографической ориентацией переходит в решетку другого зерна с другой кристаллографической ориентацией. Переходный слой имеет сложное строение, в нем нарушено правильное расположение атомов (рис. 1.11), повышена концентрация примесей, имеются скопления дислокаций.

Рис. 1.11. Размещение атомов внутри зерна и по границе зерен
Границы зерен препятствуют перемещению дислокаций. Дислокация не может перейти границу зерна, так как в новом зерне плоскость скольжения не совпадает с плоскостью движения этой дислокации. Протяженность границ тем больше, чем меньше величина зерна. Поскольку увеличение протяженности границ зерен создает больше барьеров перемещению дислокаций, измельчение зерна приводит к повышению пределов прочности и текучести металлических материалов. Зависимость предела текучести от величины зерна описывается формулой Петча—Холла и имеет следующий вид:
где о0 и к — постоянные величины материала; d — размер зерна.
Читайте также:
