Металлы не образующие карбидов
Обновлено: 16.05.2024
В обычных условиях углерод (особенно алмаз) очень инертен и вступает во взаимодействие только с очень энергичными окислителями. При нагревании химическая активность углерода повышается. В аморфном виде уголь и кокс легко горят на воздухе, образуя углекислый газ CO2. При недостатке кислорода углерод окисляется только до СО. Алмаз способен гореть лишь в чистом кислороде при 700 - 800ºС. Эта способность углерода окисляться при нагревании используется при восстановлении многих металлов из их оксидов.
C другими галогенами углерод непосредственно не соединяется, а соответствующие соединения получают косвенным путем. Четыреххлористый углерод получают пропусканием хлора через сероуглерод при 60ºС в присутствии катализатора FeS: CS2 + 2Cl2 = CCl4 + 2S.
При высокой температуре углерод взаимодействует с серой, азотом и кремнием:
С металлами углерод реагирует при высоких температурах, образуя карбиды. Карбиды также можно получить при взаимодействии угля с оксидами металлов:
3C + CaO = CaC2 + CO.
Углерод взаимодействует, как восстановитель, и с оксидами других металлов при нагревании: C + 2PbO = 2Pb + CO2.
Углерод растворяется только в кислотах-окислителях при нагревании:
Углеводороды являются достаточно стабильными, так как перекрывание малых по размеру валентных орбиталей велико, различие в электроотрицательностях углерода и водорода мало, поэтому образуются прочные ковалентные связи С−Н.
Прямой синтез метана (простейшего углеводорода) можно осуществить только в присутствии катализатора, например мелкодисперсного никеля. Разнообразие углеводородных соединений объясняется способностью углерода к образованию бесконечных линейных и разветвленных цепочек (−С−С−, >С=С< и −C≡C−) замыканию их в циклы с одинарными или кратными связями между атомами углерода как в гомоатомных, так и в гетероатомных соединениях (ароматические соединения с делокализованными π-связями).
Сам метан не реагирует с водой, кислотами и щелочами, с кислородом взаимодействует только при поджигании. Ненасыщенные углеводороды являются более реакционноспособными, чем углеводороды ряда метана. Их примеси могут служить причиной самовоспламенения болотного газа (метана) в природных условиях.
С менее электроотрицательными элементами углерод образует соединения, которые называют карбидами. Их можно разделить на 3 группы.
Ионно-ковалентные карбиды (солеподобные) –к ним относят метаниды и ацетилениды. Метаниды можно рассматривать как производные метана, содержащие ион С −4 , например карбид бериллия Be2C или карбид алюминия Al4C3. Это тугоплавкие кристаллические вещества, которые реагируют с разбавленными кислотами с выделением метана:
Ацетилениды- производные ацетилена состава М +1 2С2, М +2 С2 и М +3 2(С2)3, содержат ион С2 −2 (где М – это s- и d-металлы I и II группы периодической системы или Al +3 ). Ацетилениды детонируют даже в сухом виде, разлагаются водой и разбавленными кислотами:
Солеподобные карбиды получают при взаимодействии оксидов металлов с графитом при высокой температуре:
Ацетилениды можно получить обменным взаимодействием ацетилена с солью соответствующего металла.
Металлоподобные карбиды – это карбиды d-металлов IV – VIII групп нестехиометрического состава, который изменяется в широких пределах; проявляют металлические свойства: металлический блеск, высокую твердость, высокие температуры плавления. Карбиды титана, ванадия, ниобия, молибдена и вольфрама характеризуются еще и высокой коррозионной устойчивостью.
Металлоподобные карбиды получают непосредственным взаимодействием металлов или их оксидов с углеродом в электропечах при высокой температуре:
Карбиды состава M3C (где металл имеет небольшой радиус) термически и химически менее устойчивы, например, разлагаются разбавленными кислотами, выделяя смесь углеводородов с достаточно длинными цепями.
Ковалентные карбиды с атомной кристаллической решеткой – B4C и SiC – продукты частичного замещения атомов углерода в структуре алмаза на атомы бора или кремния. Карбид бора очень тверд, царапает алмаз, химически достаточно инертен. Карборунд по твердости близок к алмазу, но более хрупок, химически стоек и окисляется кислородом только при температуре свыше 1000ºС. При сплавлении со щелочью в присутствии кислорода карборунд разрушается с образованием карбоната и силиката. SiC растворяется только в смеси концентрированных плавиковой и азотной кислот, в царской водке.
Такие карбиды получают в электропечах при очень высокой температуре из смесей соответственно SiO2 или B2O3 с коксом, графитом или сажей.
Применение. Металлические карбиды придают сталям и чугунам твердость, износоустойчивость. Карбиды вольфрама и тантала используют для изготовления режущих инструментов и получения сверхтвердых сплавов. Карборунд используют как абразивный материал, как компонент огнеупорных материалов, в качестве стержней сопротивления в электронагревательных приборах.
Свойства и особенности карбидов металлов
В природе металлы активно вступают в химические реакции с кислотами, щелочами и атмосферным кислородом. В большинстве случаев для этого не требуется дополнительная обработка (химическая, термическая). При сильном нагреве металлы начинают активно вступать в реакцию с углеродом, что приводит к образованию сложных соединений под названием карбиды. Эти соединения отличаются рядом необычных свойств — высокая прочность, тугоплавкость, химическая инертность. Какие бывают карбиды металлов? Как эти соединения применяются в промышленности? Какие вещества получили наибольшее применение?

Краткие сведения
Карбиды — это химические соединения, которые состоят из углерода (C) и другого элемента. Обычно в качестве второго элемента выступают металлы — это может быть железо (Fe), титан (Ti), хром (Cr), гафний (Hf) и другие. В карбидных соединениях углерод более высокой электроотрицательностью (в сравнении со вторым элементом). Поэтому карбиды нельзя отнести к оксидам, галогенидам и другим химическим соединениям. Карбиды металлов — в основном твердые тугоплавкие вещества, которые отличаются очень высокой прочностью и почти не вступают в реакции с химически активными веществами.
Благодаря этим необычным свойствам карбиды часто применяют в качестве абразивов для обработки различных сплавов (это может быть чугун, сталь, соединения на основе алюминия). Из них делают электроды для сварки, огнеупорные стержни, элементы электрических систем. Первые карбиды на основе калия, железа и магния были открыты и получены совсем недавно — в XIX веке. Однако со временем были получены и новые карбидные соединения — на основе хрома, титана, гафния, вольфрама, кальция.
Физические свойства, особенности
- Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. Поэтому с помощью ударов разрушить карбидные вещества будет крайне сложно. Благодаря высокой твердости материалы нашли широкое распространение в различных технических сферах (от военного машиностроения до строительства).
- Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. Поэтому такой материал без проблем выдержит длительное воздействие экстремальных температур (скажем, его можно использовать в печах, металлургических ковшах для расплавления других материалов).
- Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). Вещества не вступают в реакцию с водой и атмосферным кислородом, поэтому они не покрываются ржавчиной, что обеспечивает их высокий срок годности.
- Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур. Поэтому они обладают повышенной износоустойчивостью, что делает их срок годности большим. Благодаря повышенной устойчивости материал часто применяют для изготовления абразивных и шлифовальных изделий, которыми можно пользоваться в течение большого срока.
Стоит обратить внимание, что далеко не все карбидные соединения обладают перечисленными свойствами. Скажем, карбид золота (I) чрезвычайно взрывоопасен (тогда как большинство других карбидов металлов — нет). Он может взорваться даже в случае неаккуратного пересыпания вещества на бумажную поверхность. Поэтому при рассмотрении физических и химических свойства карбидов нужно по отдельности рассматривать каждое соединение, поскольку карбидные материалы могут обладать уникальными необычными свойствами.

Разновидности карбидов
- Материалы с ковалентной решеткой. Вещества с таким способом связи возможны только в том случае, если в качестве второго элемента выступает бром или кремний. На атомарном уровне соединение образуется за счет sp, sp-2 или sp-3 гибридизации. В веществе атомарный металл заменяет собой углерод, что позволяет формировать прочное устойчивое вещество, которое устойчиво к механическим ударам, высоким температурам, химическим веществам. С точки зрения электропроводности вещество является полупроводником (хотя использование карбидов в качестве полупроводниковых элементов невыгодно с практической точки зрения).
- Металлоподобные материалы. В эту группу входят соединения, у которых металлических элемент является железом, кобальтом, никелем либо относится к переходной группе (IV-VII). У таких карбидных соединений металлические атомы располагаются не на месте атомов углерода, а в различных пустотах кристаллических решеток (поэтому часто такие вещества называют карбидами внедрения). Такое необычное расположение делает вещество устойчивым, крепким, надежным, оно не будет разрушаться под воздействием высоких температур или при воздействии химически активных веществ (кислоты, щелочи, соли и другие).
- Материалы с ионной связью. В эту группу входит множество карбидов, у которых в качестве металлического элемента выступает алюминий, редкоземельные металлы либо элементы I или II группы периодической таблицы. По химической структуре вещества похожи на соединения с ковалентной решеткой с той лишь разницей, что здесь металлы обычно теряют один или несколько электронов на внешнем уровне, что приводит к образованию веществ-ионов. По химико-физическим свойствам ионные карбиды аналогичны стандартным соединениям — отличная прочность, высокая температура плавления. Единственное крупное отличие — вещества активно взаимодействуют с кислотами (обычно с образованием металла или подобных веществ).

Применение материалов
Карбиды металлов применяются производстве (в основном — в тяжелом). Перечислим основные варианты применения:
- Простые карбидные соединения на основе железа могут добавлять в металлический сплав (чугун, сталь, чистое железо), чтобы улучшить его физико-химические свойства. Дополнительные компоненты улучшают прочность, повышают химическую инертность, минимизируют риск коррозии под действием воды или атмосферного воздуха. Еще одно полезное свойство — увеличение температуры плавления, что удобно в случае изготовления тугоплавких запчастей или деталей.
- Карбиды на основе титана или вольфрама отличаются сверхвысокой прочностью, а плавятся они при сверхвысоких температурах. Поэтому из них делают режущие и абразивные инструменты, которые отличаются высоким сроком годности. Подобные соединения можно использовать в качестве огнеупорных материалов (скажем, при производстве печей), для изготовления сварочных стержней.
- Карбид кальция обладает необычным свойством — при контакте с водой происходит ряд химических реакций, что в конечном счете приводит к образованию ацетилена. Это вещество широко применяется для кислородной сварки, резки или напайки. Поэтому такое карбидное соединение может использоваться для изготовления соответствующих деталей (электроды для сварочных инструментов, напайка и другие). Ацетилен при горении выделяет большое количество тепла, поэтому к работам нужно подойти осторожно.
Основные металлические карбиды
На практике широко применяется множество карбидных соединений. Рассмотрим основные из них.
Карбид гафния
Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться).

Карбиды хрома
Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6.
Карбид титана
Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом.
Карбиды вольфрама
Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах.
Карбид кальция
Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека).
Карбид циркония
Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения.

Заключение
Подведем итоги. Карбиды металлов — соединения, в состав которых входит углерод и какой-либо дополнительный металл. Это может быть железо, хром, цирконий, вольфрам и другие. Соединение может образовывать сложную прочную кристаллическую решетку (ковалентную, металлическую, ионную). Карбиды из-за особенностей своего строения отличаются высокой прочностью, устойчивостью к механической деформации, химической инертностью. Вещества обычно не вступают в реакцию с кислотами, щелочами, солями, атмосферными газами (кислород, азот, углекислый газ).
Из карбидов делают абразивные или шлифовальные инструменты, поскольку они не деформируются, не портятся со временем, могут деформировать другие прочные соединения. Из них делают электроды для сварочных инструментов, термоустойчивые стержни, элементы электрических инструментов. Некоторые виды карбидов могут проявлять необычные свойства. Скажем, карбид золота взрывается при легком контакте, а карбид кальция может вступать в реакцию с водой при комнатной температуре с образованием ацетилена.
Карбиды и их применение в промышленных целях
Карбиды (от лат. carbo – уголь) – химические вещества, образуемые путем соединения с углеродом ряда металлов или таких неметаллических элементов таблицы Менделеева, как бор (B) и кремний (Si). Важнейшими физико-химическими свойствами карбидов являются твердость, способность противостоять механическим деформациям и тугоплавкость. Так, например, карбид вольфрама (WC), карбид тантала (TaC), карбид титана (TiC), карбид молибдена (MoC), карбид циркония (ZrC), а также карбид бора (B4C) и карбид кремния (SiC) не подвержены разложению даже при белом калении и нейтральны в химическом отношении, имеют степень твердости, близкую к твердости алмазов.
Рисунок 1. Фрезы из карбида вольфрама
Карбиды – вещества нелетучие и не растворяющиеся в самых агрессивных растворителях, включая “царскую водку” (смесь серной и соляной кислот). Их получают как непосредственно из чистых элементов, так и с применением метода восстановления оксидов углеродом. Промышленные партии карбидов выпускаются в виде порошков (спеченные карбиды) и специальных отливок (литые карбиды).
Классификация по группам
Согласно современной классификации карбиды, исходя из особенностей межатомной связи в молекулярной решетке, подразделяют на 3 группы, существенно различающиеся по набору функциональных характеристик.
В состав 1-й группы входят так называемые карбиды солеобразного типа с ионной связью. Их основой служат щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиниды – торий (Th), уран (U), плутоний (Pu) и другие. Многие из таких карбидов вступают с Н2О и кислотами в бурную реакцию и начинают разлагаться с обильным выделением газообразной фракции в виде метана (метаниды) или ацетилена (ацетилениды) и осаждением металлических гидроксидов. Карбиды данной группы используют для управления химическими реакциями как раскислители, восстановители, катализаторы и т.д. Наиболее востребованными метанидами являются карбиды магния (MgС2, Mg2C), алюминия (Al4C3) и бериллия (Be2C). Среди ацителенидов самым известным считается карбид кальция CaC2, широко используемый в газосварочных технологиях.
Ко 2-й группе причисляют ряд карбидов, именуемых металлоподобными. Их образуют в связке с углеродом переходные металлы IV–VII гр. Периодической таблицы Д.И. Менделева, а также кобальт, железо и никель. Карбиды металлоподобной группы, помимо твердости и тугоплавкости, имеют высокие показатели электропроводности и устойчивости к воздействию химически активных реагентов. Вот почему, в частности, карбиды железа (Fe3C), хрома (Cr3C2), молибдена (MoC) востребованы для цементации чугунных и стальных поверхностей, а карбиды вольфрама (WC), титана (TiC), тантала (TaC), ванадия (VC) – для производства твердых сплавов, для изготовления полупроводниковых диодов, различных жаростойких покрытий, рабочих кромок металлорежущего инструмента и породоразрушающего оборудования.
3-ю группу составляют так называемые ковалентные карбиды кремния (SiC) и бора (B4C, B12C3), отличающиеся высочайшей твердостью и используемые для выпуска сверхтвердых сплавов, не уступающих по твердости корундам. Из них также производят абразивы для шлифовки и полировки поверхностей металлических изделий, огнеупоры и нагревательные элементы для высокотемпературных производственных процессов.
Карбиды тугоплавких металлов в производстве твердосплавных материалов
И все же самой обширной сферой применения является использование карбидов тугоплавких металлов для изготовления металлокерамических сплавов.
К категории твердых сплавов относят ряд износостойких металломатериалов на основе карбидов WC, TiC, VC, TaC, NbC, CrC и других металлов, имеющих Т° плавления от 860 до 1320°C, прочность связи которых в молекулярной структуре обеспечивают включения более мягких кобальта, никеля, железа с гораздо меньшей температурой плавления. Сплав становится менее хрупким и более упругим и пластичным, чем выше в нем процентное содержание связующего включения.
По технологическому критерию твердые сплавы подразделяют на спеченные (металлокерамику) и литые (наплавляемые).
- Сначала в определенных соотношениях тщательно смешиваются дисперсные порошки тугоплавких металлов и металлов-связок (кобальтовый порошок, никелевый порошок и др.), а по мере необходимости – также порошков легирующих добавок.
- Затем готовую смесь подвергают прессованию под высоким давлением (1250-4550 кгс/см 2 и выше).
- На заключительном этапе производится спекание получаемого полуфабриката в специальной электропечи в температурном режиме, близком к Т плавления металлического связующего, до тех пор, пока не будет сформирован сплав, имеющий показатель твердости не ниже HRA = 86 и термостойкости до 1320°C.
Твердые сплавы практически не поддаются традиционным способам механической обработки (резание, давление, строгание, шлифовка и др.). С этой целью применяют такие современные методы, как лазерное/ультразвуковое шлифование либо кислотное травление.
Производство литых твердых сплавов базируется на таких технологических методах, как плавка и литье. Их применяют для наплавления защитного покрытия на быстроизнашиваемые поверхности и, сообразно химическому составу, подразделяют на 3 типа.
К первому типу относят релит – композицию вольфрамовых карбидов (WC и W2C), характеризуемую особенно высокими значениями показателей твердости и стойкости к износу. Т° плавления релита составляет 3520°C, что также является ценным критерием.
Ко второму типу причисляют стеллиты – литые сплавы, являющие собой карбидную композицию W-Co-Cr. Им присуща более низкая, чем у релита, Т° плавления (близкая к Т° плавления сталей) на фоне, стойкости к износу и коррозии – качеств, обусловленных высокой твердостью. Изготавливаются в виде прутков. В России выпускаются стеллиты марок ПР-В3К и ПР-В3К-Р (ГОСТ 21449-75).
Третий тип литых твердосплавных материалов представлен сормайтами – соединениями композиции Fe-Cr-Mn-Ni, имеющие более низкую твердость и Т° плавления в сравнении со стеллитами. Отечественная промышленность производит прутки сормайта марки Пр-С (ГОСТ 21449-75). Сормайт бывает 2-х типов: сормайт №1 и сормайт №2, характеризующийся способностью подвергаться термообработке, а также более высокими характеристиками прочности и вязкости по сравнению с сормайтом №1. Торцевые оконечности прутков сормайта №1 окрашивают в зеленый цвет, а сормайта №2 – в красный.
Применение твердых сплавов в промышленных целях
В настоящее время трудно представить себе промышленную отрасль, в которой не использовались бы твердосплавные материалы на основе карбидов тугоплавких металлов и связующих металлокомпонентов.
- производства металлорежущего и породоразрушающего инструмента в металлообрабатывающей и горнодобывающей отраслях;
- изготовления штамповочного оборудования;
- изготовления хирургических инструментов;
- обустройства точных поверхностей в различном измерительном инструментарии;
- маркирования рабочей поверхности клейм;
- производства рабочих элементов подшипников качения;
- других целей, когда использование твердосплавных материалов является целесообразным либо вовсе не имеет альтернатив.
Промышленная значимость карбидов в развитии технического прогресса побуждает исследователей и инженеров-практиков к созданию все новых продуктов на их основе. Так, сегодня особенно пристальное внимание уделяется разработке новейших типов карбидо-содержащих твердосплавных материалов с широким спектром полезных свойств для авиакосмической, судостроительной, радиоэлектронной отраслей и ядерной энергетики.
телефоны:
8 (800) 200-52-75
(495) 366-00-24
(495) 504-95-54
(495) 642-41-95
Взаимодействие легирующих элементов с углеродом и азотом в стали. Карбиды и нитриды в стали
Добавленные в сталь легирующие элементы могут образовывать твердые растворы или химические соединения с железом и между собой. В большинстве случаев для сталей важную роль имеет взаимодействие ЛЭ с углеродом и азотом. Способность ЛЭ к образованию карбидов или нитридов в стали, где основу составляет железо, определяется их сродством к С и N. Если сродство ЛЭ к С и N больше, чем у железа, то будет образовываться карбид на основе ЛЭ, а не цементит.
Так как закономерности образования карбидов и нитридов в стали имеют одинаковый характер и углерод чаще применяется при легировании, чем азот, обычно рассматривают закономерности карбидообразования.
Все легирующие элементы можно разделить на две группы: карбидообразующие и не образующие карбидов в стали.
Карбиды и нитриды относятся к фазам внедрения, которые и образуются между d-переходными металлами и соответственно углеродом и азотом. Активность карбидообразующих элементов тем больше и устойчивость карбидных фаз тем выше, чем менее достроена d-электронная оболочка у данного металла. На рис. 77 приведен фрагмент таблицы Д. И. Менделеева, где расположены карбидо- и нитридообразующие элементы.
Co и Ni, представленные на рис. 77, не образуют карбиды и нитриды в стали, так как они имеют более совершенное электронное строение, чем железо.
В периодах сродство к углероду возрастает справа налево (Fe Ti), а в группах – сверху вниз (Cr W). Таким образом, самым активным из представленных в таблице элементов будет Hf. С увеличением содержания легирующего элемента в стали образуется карбид более высокого класса (с бóльшим содержанием ЛЭ). Например, для хрома: (Cr,Fe)3C Cr7C 3Cr23C6.
Рис. 77. Структуры d–переходных металлов, карбидов и нитридов, образуемых в стали
В некоторых карбидах легирующих элементов может растворяться железо. Так, например, в карбидах Cr3c и Мn3С железо растворяется неограниченно. Карбиды Cr7C3 и Mn23C6 образуют ограниченные твердые растворы с железом.
Прочность связи между атомами металла и неметалла в карбидах и нитридах характеризуются теплотой образования 298К, кДж/(г-атом) и свободной энергией образования фаз ( 298к, кДж/(г-атом), температурой их плавления и структурно-нечувствительными упругими свойствами. Наиболее высокие значения из указанных свойств имеют карбиды и нитриды элементов IV и V групп. По мере увеличения номера группы свойства изменяются в сторону уменьшения прочности связи атомов в карбиде и нитриде или, как говорят, прочности или стойкости карбидов и нитридов.
Следовательно, переходные металлы по их сродству к углероду и азоту, прочности и стойкости карбидов и нитридов, их устойчивости к распаду можно расположить в следующий убывающий ряд: Hf, Zr, Тi, Та, Nb, V, Мо, Сr, Мn, Fе.
Карбид Сr7С3 образуется чаще всего в конструкционных сталях с относительно невысоким содержанием хрома (до 3 – 4%). Этот карбид имеет сложную гексагональную решетку с 80 атомами на одну элементарную ячейку (56 атомов металла и 24 атома углерода).
В сталях этот карбид может содержать от 30 до 50 % Сr, т. е. его формула должна быть в пределах Fе4Сr3С3 и Fе2Сr5С3. Обычно такой карбид обозначают (Сr, Fе)7С3 или Me7C3.
Карбид Сr23С6 образуется в высоколегированных хромистых сталях при большом содержании хрома (выше 5 – 8 %). Он имеет сложную г. ц. к. решетку, элементарная ячейка которой содержит 116 атомов, в том числе металла 92 атома и углерода – 24. В сталях карбид Сr23С6 в чистом виде не встречается, часть атомов хрома в нем замещается карбидообразующими элементами, входящими в состав стали (Fе, Мо, W).
В зависимости от характера легирования атомы металла могут содержать два или несколько элементов. Так, в высокохромистых сталях содержание железа в карбиде может повышаться до 35 %, т. е. часть атомов хрома замещается железом, при этом формула карбида имеет, например, вид Fе8Сr15С6. При меньшем содержании хрома возможно образование карбида Fе12Сr11С6. В общем виде такой карбид в сталях принято обозначать формулой (Сr, Fе)23С6 или Me23C6. В сталях с молибденом формула карбида будет Fе20Мо2С6, а в сталях с несколькими легирующими элементами (Сr, Мо, W и др.) все они могут входить в состав карбида.
Железо широко замещает в этом карбиде хром, но так как размер атомов железа несколько меньше размера атомов хрома, то начиная с определенного момента (после замещения ~30% Сr) эти узлы становятся слишком “просторными”, и для устойчивости решетки необходимо присутствие крупных атомов W (или Мо). Атомы W (Мо) занимают также определенные позиции в решетке карбида Ме23С6, поэтому их максимальное число в элементарной ячейке составляет 8 из 92 атомов металла. Дальнейшее увеличение в стали концентрации вольфрама и молибдена в выделяющейся фазе сверх этого предела приводит к переходу Ме23С6 Þ Ме6С, как к следующему карбиду, который может вместить большее количество W и Mo.
Этот карбид образуется только при сложном легировании, поэтому он является комплексным карбидом. Его преимущество перед другими карбидами на основе Mo, W и других тугоплавких элементов заключается в том, что он имеет более низкую температуру диссоциации, что позволяет переводить Мо и W при нагреве при закалке в твердый раствор (аустенит).
Однако этот карбид метастабильный и при высокой температуре и длительных выдержках он превращается в стабильные карбиды типа МеС или Ме2С. По этой причине высоколегированные стали, содержащие в больших количествах Cr, W, Mo и V не подвергают смягчающему отжигу с нагревом и длительной выдержкой при температурах 1100. 1200 о С. При закалке из этой области температур длительность выдержки строго регламентирована.
Л 5.2. Влияние легирующих элементов на С–образные кривые.
Влияние легирующих элементов на критические точки и свойства стали
Легирующие элементы значительно влияют на температурное положение критических точек в сталях. В частности, они могут интенсивно смещать точку Ас1. Подобное влияние легирующих элементов связано с двумя факторами.
| Рис. 78. Влияние легирующих элементов на положение критической точки Ас1 (а) и содержание углерода в эвтектоиде (б) |
Как известно, критическая температура Ас1 в углеродистой стали отвечает превращению эвтектоидной смеси перлита +Fе3С в аустенит путем фазового перехода a®g, диссоциации карбида и растворению углерода в g-железе. С одной стороны, легирующие элементы изменяют температуру –прeвращения для феррита, входящего в состав эвтектоида (перлита), и, с другой стороны, влияют на температуру диссоциации эвтектоидных карбидов и последующее растворение углерода и легирующих элементов в g-железе. Как правило, карбидообразующие элементы повышают температуру диссоциации карбидов, и, если при этом они также повышают температуру -превращения, то влияние их на точку Ас1 сказывается особенно сильно (рис. 78).
Некарбидообразующие элементы, растворяясь в цементите, несколько понижают температуру диссоциации карбида. При этом никель и марганец понижают температуру -перехода и, следовательно, снижают точку Ас1. Своеобразно влияние хрома на точку Ас1. Он до 12–13 % сравнительно слабо повышает точку Ас1, а при содержании его более 14 % наблюдается резкое повышение температуры Ас1. Подобное влияние объясняется тем, что при содержании хрома до 12 – 13 % он понижает температуру -перехода, а наблюдаемое при этих содержаниях хрома повышение точки Ас1 обусловлено более сильным влиянием диссоциации эвтектоидных карбидов при этих температурах. Закономерности влияния элементов на критические точки в основном сохраняются и в сталях, содержащих одновременно несколько легирующих элементов.
Легирующие элементы значительно влияют и на положение эвтектоидной точки S (рис. 79), и на предельную концентрацию углерода в аустените (точку Е). Некарбидообразующие элементы (никель, кобальт, кремний), растворяясь в феррите и замещая часть атомов железа в его решетке, тем самым уменьшают содержание железа в эвтектоиде и смещают точку S в сторону меньших концентраций углерода. Аналогично влияют и карбидообразующие элементы, которые в большом количестве растворяются в феррите. Их карбиды участвуют в образовании эвтектоида (например, Мп и Сr). Такие элементы, как Мо и W, сначала уменьшают, а затем увеличивают содержание углерода в эвтектоиде.
Имеются сведения, что сильные карбидообразующие элементы Тi, Nb и V, незначительно растворяющиеся в феррите и образующие стойкие карбиды, которые не участвуют в образовании эвтектоида, уменьшают количество эвтектоида в стали и увеличивают содержание углерода в эвтектоиде, т. е. смещают точку S в сторону больших концентраций углерода. В то же время, если Тi, Nb и V растворены в аустените, то они снижают содержание углерода в эвтектоиде.
Большинство легирующих элементов понижает предел растворимости углерода в -железе и, следовательно, смещает точку Ена диаграмме Fе–Fе3С в сторону меньших концентраций углерода.
| Рис. 79. Изменение содержания углерода в эвтектоиде и эвтектике при легировании |
Легирующие элементы смещают не только критические точки равновесных систем, но и изменяют кинетику распада аустенита. Кинетика распада аустенита определяет поведение стали при термической обработке. Влияние же легирующих элементов на кинетику превращения аустенита очень велико.
Элементы, которые только растворяются в феррите или цементите, не образуя специальных карбидов, оказывают лишь количественное влияние на процессы превращения (изменяют длительность инкубационного периода). Они или ускоряют превращение (к таким элементам относится только кобальт), или замедляют его (большинство элементов, в том числе марганец, никель, медь и др.).
| Рис. 80. Диаграммы изотермического превращения аустенита: доэвтектоидной (а), эвтектоидной (б) и заэвтектоидной (с) углеродистой стали |
Карбидообразующие элементы вносят не только количественные, но и качественные изменения в кинетику изотермического превращения. Так, легирующие элементы, образующие растворимые в аустените карбиды, при разных температурах по-разному влияют на скорость распада аустенита: при 700 – 500 о С (образование перлита) – замедляют превращение, а при 500 – 400 о С – весьма значительно замедляют превращение; при 400 – 300 о С (образование бейнита) – ускоряет превращение при малых концентрациях и замедляют при больших.
Таким образом, в сталях, легированных карбидообразующими элементами (хром, молибден, вольфрам), наблюдаются два максимума скорости изотермического распада аустенита, разделенных областью высокой устойчивости переохлажденного аустенита. Изотермический распад аустенита имеет два явно выраженных интервала превращений – превращение в пластинчатые кристаллиты (перлитное превращение) и превращение в игольчатые кристаллиты (бейнитные превращения).
Диаграммы изотермического распада представлены на рис. 80 и 81. Видно, что увеличение содержания углерода понижает температуры начала и конца мартенситного превращения; форма кривых начала и конца перлитного превращения принципиально не изменяется.
При легировании карбидообразующими элементами диаграмма приобретает другой вид (рис. 81). Причины изменения формы диаграммы подробно изучаются в дисциплине “Теория термической обработки”. Следует обратить внимание на тот факт, что положение бейнитной области зависит от содержания углерода и ЛЭ-карбидообразователя.
В легированных сталях в зависимости от положения линий начала перлитного превращения и точки Мн можно получить стали перлитного, мартенситного, бейнитного или аустенитного классов. Увеличение инкубационного периода при легировании позволяет создавать стали с высокой прокаливаемостью.
| Рис. 81. Схемы диаграмм изотермического распада аустенита, легированного карбидообразующими элементами: а – малоуглеродистая сталь; б – высокоуглеродистая сталь |
Легирующие элементы не влияют на кинетику мартенситного превращения, которая, по-видимому, похожа во всех сталях. Их влияние сказывается исключительно на положении температурного интервала мартенситного превращения, а это в свою очередь отражается и на количестве остаточного аустенита, которое фиксируется в закаленной стали.
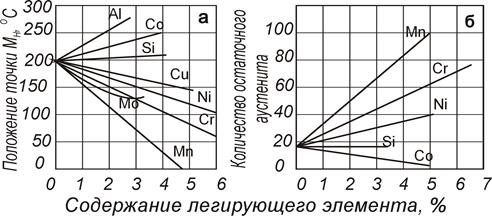 Рис. 82. Влияние ЛЭ на Мн и содержание остаточного аустенита в стали с 1 % углерода |
Некоторые элементы повышают мартенситную точку и уменьшают количество остаточного аустенита (алюминий, кобальт), другие не влияют на нее (кремний), но большинство снижает мартенситную точку и увеличивает количество остаточного аустенита (рис. 82). Из диаграммы видно, что 5% Мn снижает мартенситную точку до 0 о С, следовательно, при таком (или большем) содержании этого легирующего элемента можно зафиксировать аустенитное состояние посредством быстрого охлаждения..
Л 5.3. Влияние легирования на вязкость, прочность, Тх , размер зерна.
Взаимодействие легирующих элементов с железом и углеродом
По взаимодействию с железом, легирующие элементы делятся на три группы:
1. Легирующие элементы, отличающиеся слабым взаимодействием с железом (влияние на полиморфные (a-Fe —> g-Fe) превращения). Такие легирующие элементы либо вообще не взаимодействуют с железом, либо образуют твердые растворы очень малых концентраций.
Например, Pb, K, S. Такие легирующие элементы располагаются, как правило, по границам зерен, ухудшая тем самым связь между ними. В результате прочностные свойства падают, но улучшается обрабатываемость резанием (автоматная сталь).
2. Легирующие элементы, отличающиеся образованием с железом твердых растворов. Как правило, увеличивается прочность и твердость, но вместе с этим одновременно понижается пластичность и вязкость. Образование твердых растворов может идти по типу замещения или внедрения. Растворы замещения образуют легирующие элементы – металлы, а твердые растворы внедрения образуют легирующие элементы – неметаллы (B, N). Образование твердых растворов внедрения особенно сильно увеличивает твердость и понижает пластичность. Лишь один легирующий элемент увеличивает прочность, пластичность, вязкость и одновременно снижает порог хладноломкости – это Ni.
3. Образование интерметаллидов. При образовании легирующими элементами химических соединений с железом, образуются интерметаллидные фазы: FeCr, FeAl, Fе7Мо6; Fe3Nb и др. Это приводит к резкому увеличению прочности и твердости, но одновременно снижает вязкость и пластичность.
По взаимодействию с углеродом,легирующие элементы делятся на две группы:
Карбидообразующие. К ним относят Cr, W, Ti, Mo.
К не карбидообразующим относят Ni, Al, Cu, Si, Mn.

Карбидообразующими легирующими элементами называют элементы, обладающие большим, чем железо, сродством к углероду. По возрастанию сродства к углероду и устойчивости карбидных фаз карбидообразующие элементы располагаются в следующий ряд: Fе-Мn-Сг-Мо-W-Nb-V-Zr-Ti. Чем устойчивее карбид, тем труднее он растворяется в аустените и выделяется при отпуске.
Легирующие элементы влияют на положение критических точек в сталях и основных линий на диаграмме Fe-C. Введение карбидообразующих элементов повышает точки А1 и А3, т.к. карбиды легирующих элементов более устойчивы и растворяются в железе при более высоких температурах, чем обычный цементит.
Смещение точки Е влево может приводить к тому, что при содержании углерода 1,3-1,5 % в структуре могут наблюдаться выделения эвтектики – ледебурита. В обычных углеродистых сплавах ледебурит присутствует только в чугуне.
При введении сравнительно небольших количеств легирующего карбидообразующего элемента в сталь он сначала растворяется в цементите, замещая часть атомов железа, например (Fе, Мn)3С. При этом образуется легированный цементит.
С увеличением содержания легирующего элемента сверх предела растворимости образуются специальные карбиды типа Сr7С3, Мn3С и др.
По строению кристаллической решетки карбиды бывают двух типов.
К карбидам первой группы относятся поликарбиды Fe3C, Мn3С, Сr7Сз, Сr23С6,имеющие сложные кристаллические решетки. Такие карбиды недостаточно прочны и при нагреве до высоких температур распадаются с образованием твердого раствора легирующих элементов в аустените.
Карбиды второй группы Мо3С, WС, VС, TiС - монокарбиды - имеют простые кристаллические решетки, которые отличаются большой прочностью и не распадаются при нагреве. Все карбиды обладают высокой твердостью, но твердость карбидов второй группы несколько выше. С повышением дисперсности карбидов растет твердость и прочность стали.
Изменение размеров решетки вызывает изменение свойств феррита – прочность повышается, пластичность уменьшается.
Хром, молибден и вольфрам упрочняют меньше, чем никель, кремний и марганец. Молибдени вольфрам, а также кремний и марганец в определенных количествах, снижают вязкость.
В сталях карбиды образуются металлами, расположенными в таблице Менделеева левее железа (хром, ванадий, титан), которые имеют менее достроенную d – электронную полосу.
Все карбиды обладают высокой твердостью и температурой плавления.
2.5. Влияние легирующих элементов на превращения в стали
2.5.1. Влияние легирующих элементов на превращение перлита в аустенит
Легирующие элементы в большинстве случаев растворяются в аустените, образуя твердые растворы замещения. Легированные стали требуют более высоких температур нагрева и более длительной выдержки для получения однородного аустенита, в котором растворяются карбиды легирующих элементов.
Малая склонность к росту аустенитного зерна – технологическое преимущество большинства легированных сталей. Все легирующие элементы снижают склонность аустенитного зерна к росту, кроме марганца и бора. Элементы, не образующие карбидов (кремний, кобальт, медь, никель), слабо влияют на рост зерна. Карбидообразующие элементы (хром, молибден, вольфрам, ванадий, титан) сильно измельчают зерно.

2.5.2. Влияние легирующих элементов на превращение переохлажденного аустенита
По влиянию на устойчивость аустенита и на форму С-образных кривых легирующие элементы разделяются на две группы.
Элементы, которые растворяются в феррите и цементите (кобальт, кремний, алюминий, медь, никель), оказывают только количественное влияние на процессы превращения. Замедляют превращение (большинство элементов), или ускоряют его (кобальт) (рис.4 а).
Рис. 4. Влияние легирующих элементов на превращение переохлажденного аустенита: а – некарбидообразующие элементы;
б — карбидообразующие элементы
Карбидообразующие элементы (хром, молибден, вольфрам, ванадий, титан) вносят и качественные изменения в кинетику изотермического превращения. При разных температурах они по-разному влияют на скорость распада аустенита: при температуре 700-500 o С — замедляют превращение в перлитной области, при температуре 500-400 o С (образование троостита) – очень сильно замедляют превращение, при температуре 400-300 o С (промежуточное превращение) – замедляет превращение аустенита в бейнит, но меньше, чем образование троостита. Это отражается на форме С-образных кривых: наблюдаются два максимума скорости изотермического распада, разделенных областью высокой устойчивости переохлажденного аустенита (рис. 4. б).
Температура максимальной устойчивости аустенита зависит от карбидообразующего элемента: хром – 400-500 o С, вольфрам – 500-550 o С, молибден – 550-575 o С, ванадий – 575-600 o С. Время максимальной устойчивости при заданной температуре возрастает с увеличением степени легированности (очень велико для высоколегированных сталей).
Важным является замедление скорости распада. Это способствует более глубокой прокаливаемости и переохлаждению аустенита до интервала мартенситного превращения при более медленном охлаждении (масло, воздух). Увеличивают прокаливаемость хром, никель, молибден, марганец, особенно при совместном легировании.
2.5.3. Влияние легирующих элементов на мартенситное превращение
При нагреве большинство легирующих элементов растворяются в аустените. Карбиды титана и ниобия не растворяются. Эти карбиды тормозят рост аустенитного зерна при нагреве и обеспечивают получение мелкоигольчатого мартенсита при закалке. Остальные карбидообразующие элементы, а также некарбидообразующие, при нагреве растворяются в аустените и при закалке образуют легированный мартенсит.
Некоторые легирующие элементы (алюминий, кобальт) повышают мартенситную точку и уменьшают количество остаточного аустенита, другие не влияют на эту точку (кремний). Большинство элементов снижают мартенситную точку и увеличивают количество остаточного аустенита.

2.5.4. Влияние легирующих элементов на превращения при отпуске
Легирующие элементы замедляют процесс распада мартенсита: никель, марганец – незначительно; хром, молибден, кремний – заметно. Это связано с тем, что процессы при отпуске имеют диффузионный характер, а большинство элементов замедляют карбидное превращение. Легированные стали сохраняют структуру мартенсита отпуска до температуры 400-500 o С. Так как в легированных сталях сохраняется значительное количество остаточного аустенита, то превращение его в мартенсит отпуска способствует сохранению твердости до высоких температур.
Таким образом, легированные стали при отпуске нагревают до более высоких температур или увеличивают выдержку.
3. Легированные стали
Легированными или специальными называют такие стали, которые в своем составе кроме углерода содержат еще дополнительные добавки, введенные в состав с целью направленного изменения ее свойств. Такие добавки называются легирующими элементами (добавками).
Около 10 % всей выплавленной стали является легированной. Легированные стали обладают рядом специфических свойств: износостойкость, жаропрочность, прокаливаемость в крупных сечениях, кислотостойкость.
Легированием можно повысить предел текучести, ударную вязкость, относительное сужение и прокаливаемость, а также существенно снизить скорость закалки, порог хладноломкости, деформируемость изделий и возможность образования трещин. В изделиях крупных сечений (диаметром свыше 15-20 мм) механические свойства легированных сталей значительно выше, чем механические свойства углеродистых.
Влияние на конструкционную прочность оказывают легирующие элементы. Повышение конструкционной прочности при легировании связано с обеспечением высокой прокаливаемости, уменьшением критической скорости закалки, измельчением зерна.
Металлургическое качество влияет на конструкционную прочность. Чистая сталь при одних и тех же прочностных свойствах имеет повышенные характеристики надежности.
Основное отличие легирующих элементов от примесей заключается в том, что их количество определяется необходимой мерой изменения свойств стали, в то время как для примесей количество определяет допустимую меру ухудшения свойств. Одни и те же элементы могут играть роль примесей или роль легирующих элементов, но примеси попадают в сталь случайно или с шихтой, в то время как легирующие элементы вводятся специально.
Легирующие элементы повышают стоимость стали, поэтому их использование должно быть строго обоснованно.
Легированная конструкционная сталь (ГОСТ 4543-71) . Легированные стали широко применяют в тракторном и сельскохозяйственном машиностроении, в автомобильной промышленности, тяжелом и транспортном машиностроении в меньшей степени в станкостроении, инструментальной и других видах промышленности. Это стали применяют для тяжело нагруженных металлоконструкций.
Содержание легирующих элементов может изменяться в очень широких пределах: хром или никель – 1 % и более процентов; ванадий, молибден, титан, ниобий – 0,1--0,5 %; также кремний и марганец – более 1 %. При содержании легирующих элементов до 0,1 % – микролегирование.
В конструкционных сталях легирование осуществляется с целью улучшения механических свойств (прочности, пластичности). Кроме того, меняются физические, химические, эксплуатационные свойства.
Достоинства легированных сталей:
· особенности обнаруживаются в термически обработанном состоянии, поэтому изготовляются детали, подвергаемые термической обработке;
· улучшенные легированные стали обнаруживают более высокие показатели сопротивления пластическим деформациям ();
· легирующие элементы стабилизируют аустенит, поэтому прокаливаемость легированных сталей выше;
· возможно использование более «мягких» охладителей (снижается брак по закалочным трещинам и короблению), так как тормозится распад аустенита;
· повышаются запас вязкости и сопротивление хладоломкости, что приводит к повышению надежности деталей машин.
Недостатки:
· в высоколегированных сталях после закалки остается аустенит остаточный, который снижает твердость и сопротивляемость усталости, поэтому требуется дополнительная обработка;
· склонны к дендритной ликвации, так как скорость диффузии легирующих элементов в железе мала. Дендриты обедняются, а границы – междендритный материал – обогащаются легирующим элементом. Образуется строчечная структура после ковки и прокатки, неоднородность свойств вдоль и поперек деформирования, поэтому необходим диффузионный отжиг.
· склонны к образованию флокенов.
Меры борьбы: уменьшение содержания водорода при выплавке и снижение скорости охлаждения в интервале флокенообразования.
3.1. Классификация легированных сталей
Стали классифицируются по нескольким признакам.
1. По структуре после охлаждения на воздухе выделяются три основных класса сталей:
· перлитный, стали характеризуются малым содержанием легирующих элементов (все углеродистые стали, сумма легирующих элементов не должна превышать 5-7 %, не должно быть Ni); 20Хб 20ХГТР, 60С2ХА, ШХ15СГ.
· мартенситный, стали характеризуются более значительным содержанием легирующих элементов,сумма легирующих элементов 7-15 % (причем каждого в отдельности не более 5 %, есть Ni); 20Х2Н2А, 5ХНМ, 30Х13, 40Х10С2М.
· аустенитный, стали характеризуются высоким содержанием легирующих элементов больше 15 %, Ni > 8 %, либо Мn ³ 13 %. 12Х18Н10Т.
· ферритные стали (легирующие элементы Cr > 17 %; С < 0,15 %);15Х27Т, 15Х17.
· карбидный класс 30…35 % карбидов (W, Mo, V, Ti), С ³0,7 %. Р18, Р6М5К5.
Классификация связана с кинетикой распада аустенита. Диаграммы изотермического распада аустенита для сталей различных классов представлены на рис. 5.
По мере увеличения содержания легирующих элементов устойчивость аустенита в перлитной области возрастает, а температурная область мартенситного превращения снижается.
Рис. 5. Диаграммы изотермического распада аустенита для сталей перлитного (а), мартенситного (б) и аустенитного (в) классов
Для сталей перлитного класса кривая скорости охлаждения на воздухе пересекает область перлитного распада (рис. 5.а), поэтому образуются структуры перлита, сорбита или троостита.
Для сталей мартенситного класса область перлитного распада сдвинута вправо (рис. 5. б). Охлаждение на воздухе не приводит к превращению в перлитной области. Аустенит переохлаждается до температуры мартенситного превращения и происходит образование мартенсита.
Для сталей аустенитного класса увеличение содержания углерода и легирующих элементов сдвигает вправо область перлитного распада, а также снижает мартенситную точку, переводя ее в область отрицательных температур (рис. 5. в). Сталь охлаждается на воздухе до комнатной температуры, сохраняя аустенитное состояние.
2. По числу легирующих элементов:
· трехкомпонентные (железо, углерод, легирующий элемент);
· четырехкомпонентные (железо, углерод, два легирующих элемента) и так далее.
3. По составу:
· никелевые,
· хромистые,
· хромоникелевые,
· хромоникельмолибденовые и так далее (признак – наличие тех или иных легирующих элементов).
4. По назначению:
· конструкционные;
· инструментальные (режущие, мерительные, штамповые);
· стали и сплавы с особыми свойствами (резко выраженные свойства – нержавеющие, жаропрочные и термоустойчивые, износоустойчивые, с особыми магнитными и электрическими свойствами).
Наиболее широкое применение в строительстве получили низколегированные стали, а в машиностроении - легированные стали.
Читайте также:
