Металлы не проявляют отрицательную степень окисления
Обновлено: 18.05.2024
Тип 3 № 30237Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Тип 1 № 30235Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число неспаренных электронов. Запишите номера выбранных элементов.
Запишем электронные формулы:
1. — — один неспаренный электрон;
2. — — два неспаренных электрона;
3. — — два неспаренных электрона;
4. — — шесть неспаренных электронов;
5. — — три неспаренных электрона.
Тип 2 № 30236Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите номера выбранных элементов в нужной последовательности.
Из перечня элементов p−элементами являются углерод, кислород, азот. Известно, что атомный радиус уменьшается вверх по группе и вправо по периоду. Тогда последовательность химических элементов в порядке уменьшения их атомного радиуса следующая: углерод — азот — кислород.
Рассмотрим высшие и низшие степени окисления для всех элементов:
1. — низшая степень окисления «0», высшая — «+1», разница степеней окисления — «1»;
2. — низшая степень окисления «−4», высшая — «+4», разница степеней окисления — «8»;
3. — низшая степень окисления «−2», высшая — «+2», разница степеней окисления — «4»;
4. — низшая степень окисления «0», высшая — «+6», разница степеней окисления — «6»;
5. — низшая степень окисления «−3», высшая — «+5», разница степеней окисления — «8».
Тип 3 № 9691Выберите два элемента, которые в соединениях могут иметь степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 9689Определите, атомы каких двух из указанных элементов имеют в основном состоянии два неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1. Сера имеет конфигурацию . На p подуровне, где должно быть 6 электронов, т.е 3 электронные пары, только 4 электрона, по правилу Хунда 2 спарены, образуя 1 электронную пару, а 2 неспарены.
2. Магний имеет конфигурацию . На s орбитали все электроны спарены, на p орбитали их нет.
3. Углерод имеет конфигурацию . На p подуровне, где должно быть 6 электронов, т.е 3 электронные пары, только 2 электрона, по правилу Хунда оба неспарены.
4. Бор имеет конфигурацию . На p подуровне, где должно быть 6 электронов, т.е 3 электронные пары, только 1 электрон, который неспарен.
5. Литий имеет конфигурацию . На s подуровне, где максимум может быть 2 электрона, у него только 1, он же как раз неспаренный.
Тип 2 № 9690Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Элементы и — в 3-ем периоде, , и во 2-ом периоде.
Известно, что электроотрицательность увеличивается вверх по группе и вправо по периоду, поэтому последовательность этих атомов в порядке увеличения электроотрицательности выглядит как → → .
Элемент может иметь степень окисления от максимальной положительной до максимальной отрицательной. Максимальная положительная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Сера в 6 группе, имеет степени окисления −2; −1; 0; +1; +2; +4; +6.
Магний это металл и не проявляет отрицательной степени окисления, находится во 2 группе, следовательно, степени окисления 0; +2.
Углерод находится в 4 группе и имеет степени окисления −4; −3; −2; −1; 0; +1; +2; +3; +4. (Максимальная положительная «+№ группы», т. е. +4; максимальная отрицательная 4−8 = −4).
Бор в 3 группе, т. е. +3; 0.
Литий — это металл и не проявляет отрицательную степень окисления, поэтому для него возможны 0 и +1.
Тип 3 № 9657Выберите два элемента, которые в соединениях могут иметь степень окисления +5. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 9655Определите, какие два из указанных элементов образуют устойчивый отрицательный ион, содержащий 18 электронов. Запишите в поле ответа номера выбранных элементов.
1. Алюминий — металл и не проявляет отрицательной степени окисления.
2. Хлор имеет атомный номер 17, следовательно, имеет 17 электронов. Находится в 7 группе, максимальная отрицательная степень окисления () — это −1, т. е. образуя анион с данным зарядом, хлор получает 1 электрон и их становится 18.
3. Сера имеет атомный номер 16, следовательно, имеет 16 электронов. Находится в 6 группе, максимальная отрицательная степень окисления () — это −2, т. е. образуя анион с данным зарядом, сера получает 2 электрона и их становится 18.
4. Фтор имеет атомный номер 9, следовательно, имеет 9 электронов. Находится в 7 группе, максимальная отрицательная степень окисления () — это −1, т. е. образуя анион с данным зарядом, фтор получает 1 электрон и их становится 10.
5. Йод имеет атомный номер 53, и образуя анион не останется лишь с 18 электронами.
Тип 2 № 9656Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке усиления неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Алюминий в 3 группе, Сера в 6, а Хлор, Фтор и Йод в 7. Известно, что усиление неметаллических свойств идет вправо по периоду и вверх по группе, поэтому располагая элементы в порядке усиления неметаллических свойств, получаем → → .
1. Алюминий металл главной подгруппы и имеет степени окисления 0 и равную номеру группы, т. е. +3.
3. Сера в 6 группе, т. е. −2; −1; 0; +1; +2; +4; +6.
4. Фтор является исключением и имеет фиксированные степени окисления −1; 0.
Тип 3 № 9864Выберите два элемента, которые в соединениях могут иметь степень окисления +3. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 9862Определите, в атомах каких двух из указанных элементов (в основном состоянии) общее число p-электронов превосходит общее число s-электронов. Запишите в поле ответа номера выбранных элементов.
Для атома электронная конфигурация следующая: .
Тип 2 № 9863Выберите три элемента, которые в периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения радиуса атома. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Элемент находится в 3 периоде, — в 3 периоде, — во 2 периоде, в 3 периоде, в 1 периоде. Таким образом, нужные элементы — это , , . Известно, что атомный радиус увеличивается вниз по группе и влево по периоду, поэтому последовательность этих атомов в порядке увеличения атомного радиуса выглядит как →→.
Элемент может иметь степень окисления от максимальной отрицательной до максимальной положительной. Максимальная положительная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Азот в 5 группе, т. е. −3; −2; −1; 0; +1; +2; +3; +4; +5.
Кремний в 4 группе, поэтому −4; 0; +2; +4.
Гелий — благородный газ и имеет степень окисления 0.
Тип 3 № 9898Выберите два элемента, которые в соединениях могут иметь степень окисления –2. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 9896Определите, в атомах каких двух из указанных элементов (в основном состоянии) общее число s-электронов превосходит общее число p-электронов. Запишите в поле ответа номера выбранных элементов.
Для атома электронная конфигурация . Для атома — . Для атома — . Для атома — . Для атома — .
Тип 2 № 9897Выберите три элемента, которые в периодической системе находятся в одном периоде, и расположите эти элементы в порядке усиления неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Элемент находится во 2 периоде, — во 2, — в 3, во 2, — в 3. Таким образом, нужные элементы — это , и . Известно, что неметаллические свойства увеличиваются вверх по группе и вправо по периоду, т. е. в нашем случае (по периоду) от к .
Углерод находится в 4 группе и имеет степени окисления −4; −3; −2; −1; 0; +1; +2; +3; +4. (Максимальная положительная «+№ группы», т. е. +4; максимальная отрицательная 4-8 = −4.)
Фтор является исключением и меет фиксированные степени окисления −1; 0.
Сера в 6 группе, т. е. -2; −1; 0; +1; +2; +4; +6.
Тип 19 № 1378Установите соответствие между названием вещества и степенью окисления азота в нём: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) гидросульфид аммония
Б) нитрат железа (II)
В) нитрит натрия
Г) азотистая кислота
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Напомню, что степень окисления щелочных металлов в соединениях «+1», щелочноземельных «+2», кислорода в подавляющем большинстве соединений «−2», водорода «+1», галогенов чаще всего «−1». Кроме того помните, что суммарная степень окисления всех атомов в соединении должна быть равна заряду иона или нулю для нейтральных молекул.
А) Гидросульфид аммония — соль аммония, в ионе аммония степень окисления азота «−3» — ответ: 1.
Б) Нитрат железа (II) — соль азотной кислоты, в нитратном анионе степень окисления азота «+5» — ответ: 6.
В) Нитрит натрия — соль азотистой кислоты, в азотистой кислоте степень окисления азота «+3» — ответ: 5.
Г) Азотистая кислота — в азотистой кислоте степень окисления азота «+3» — ответ: 5.
Тип 3 № 10418Выберите два элемента, которые в соединениях могут проявлять степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Тип 1 № 10416Определите, атомы каких из указанных элементов имеют три валентных электрона. Запишите в поле ответа номера выбранных элементов.
На внешнем энергетическом уровне три электрона имеют элементы III группы: бор и алюминий.
Тип 2 № 10417Неметаллические свойства усиливаются по периоду слева направо: , и .
Низшая степень окисления вычисляется по формуле №группы −8, а высшая равна номеру группы.
Для азота низшая −3, а высшая + 5, таким образом он может проявлять степень окисления в промежутке от низшей до высшей (−3, −2, −1, 0, +1, +2, +3, +4, +5). Степень окисления +4 азот имеет в диоксиде азота .
Для кремния низшая −4, а высшая + 4. Степень окисления +4 кремний имеет в диоксиде кремния .
Для бора и алюминия высшая степень окисления +3, а кислород обычно не проявляет положительную степень окисления, исключением является соединение , где кислород принимает степень окисления +2, так как соединен с более электроотрицательным элементом.
Тип 3 № 9725 Тип 1 № 9723Определите, какие два из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов. Запишите в поле ответа номера выбранных элементов.
1. Натрий имеет атомный номер 11, следовательно, имеет 11 электронов. Натрий находится в 1 группе, что значит, что максимальная степень окисления (которая численно равна номеру группы) натрия +1, т. е. образуя катион с данным зарядом, он теряет 1 электрон, а остается 10.
2. Калий имеет атомный номер 19, следовательно, имеет 19 электронов. Находится в 1 группе, что значит, что максимальная степень окисления +1, т. е. образуя катион с данным зарядом, калий теряет 1 электрон, а остается 18.
3. Азот имеет атомный номер 7, следовательно, 7 электронов. Образуя катион, атом теряет электроны, поэтому данный вариант не подходит по условию задачи.
4. Литий имеет атомный номер 3, поэтому также не подходит по условию.
5. Алюминий имеет атомный номер 13, следовательно, имеет 13 электронов. Находится в 3 группе, что значит, что максимальная степень окисления +3, т. е. образуя катион с данным зарядом, алюминий теряет 3 электрона, а остается 10.
Степень окисления элемента

В химии степень окисления элементов говорит о том, как проходят окислительно-восстановительные реакции, а точнее — как при этом атомы перераспределяют между собой электроны. Это не очень сложная тема, но в ней часто бывает путаница. Разберемся, как считать степень окисления в разных соединениях.
О чем эта статья:
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
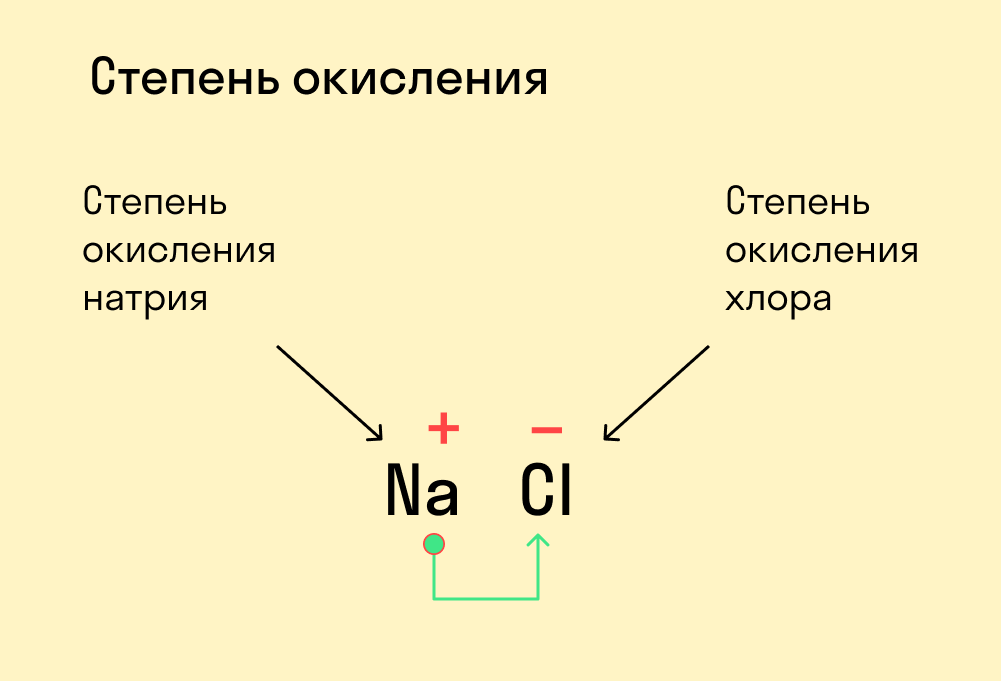
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
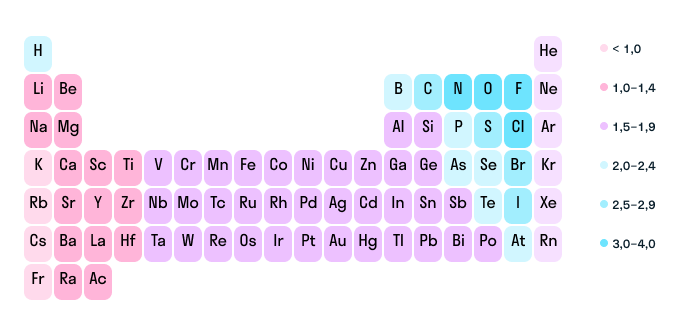
Шкала относительной электроотрицательности
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.

Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Степень окисления Cl2, S8 равна 0.
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N -3 H4 +1 )2S +6 O4 -2 .
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
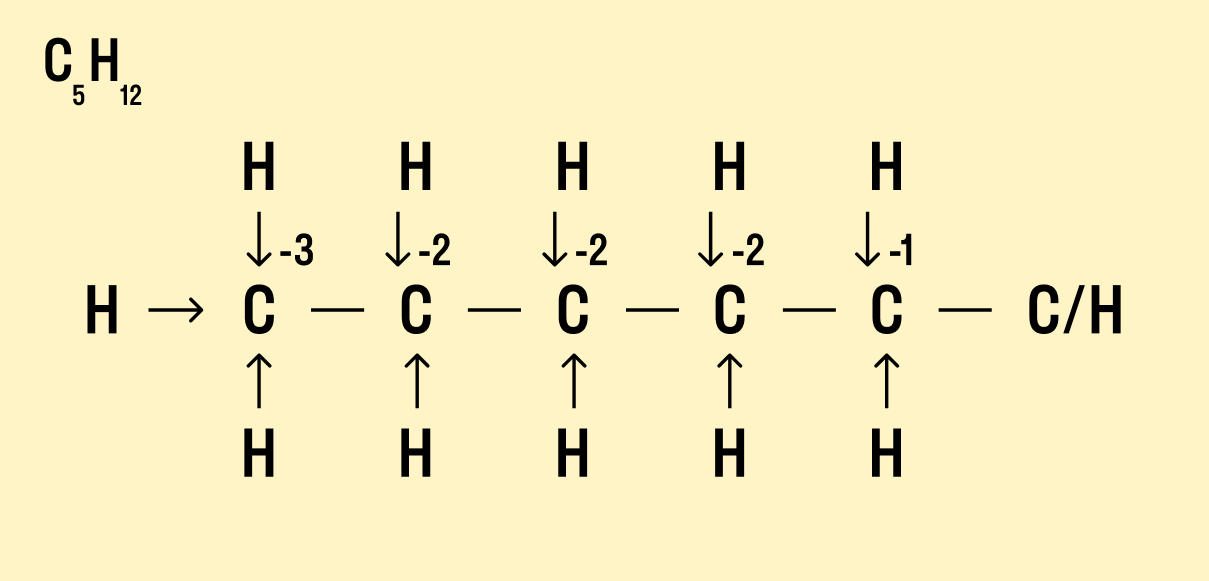
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
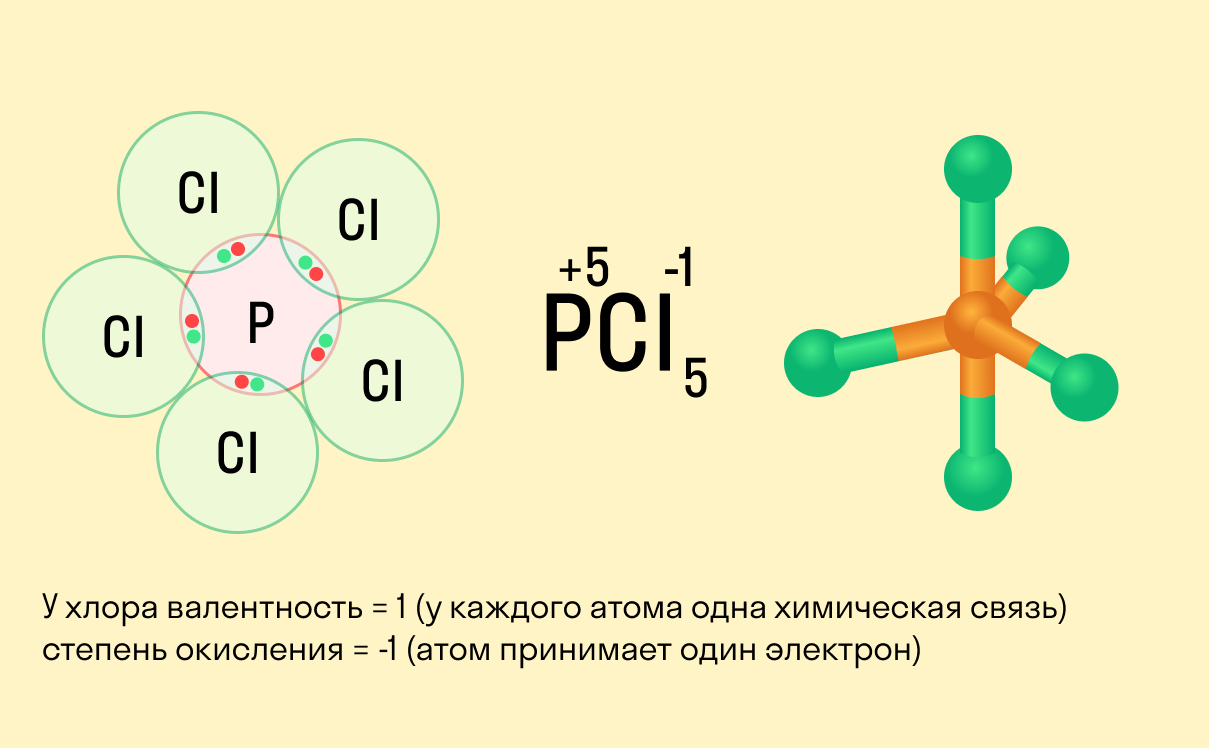
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Металлы не проявляют отрицательную степень окисления

В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
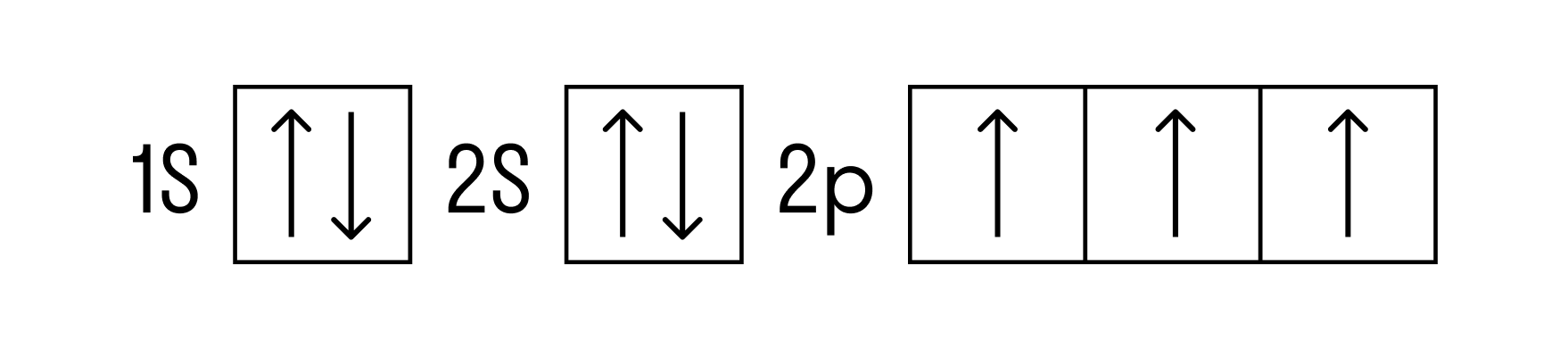
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
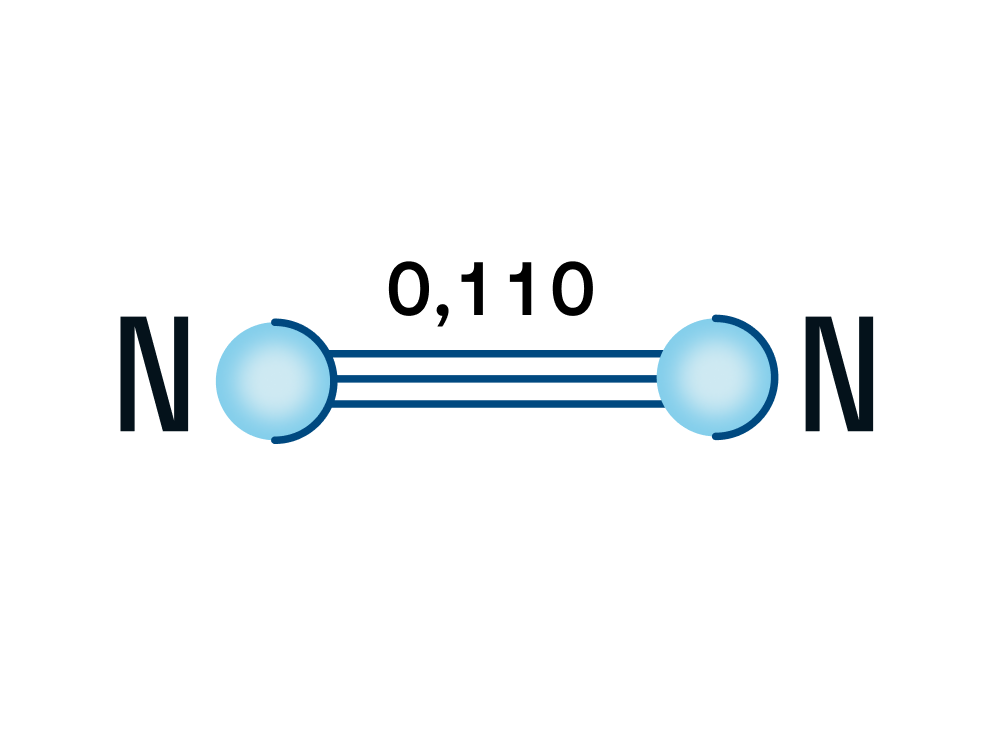
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
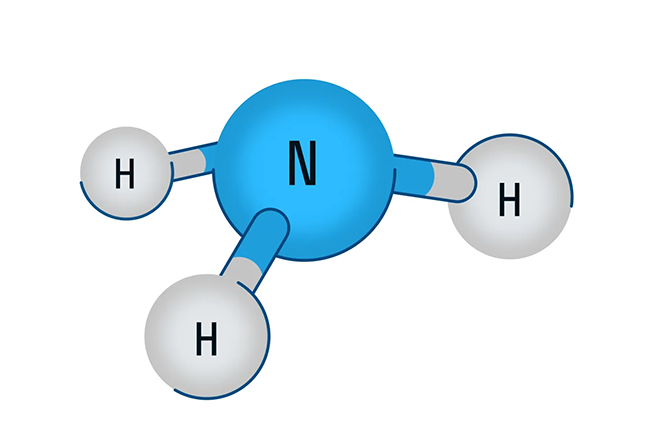
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
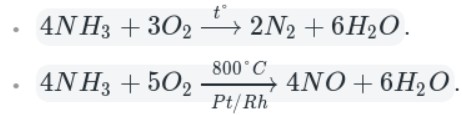
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
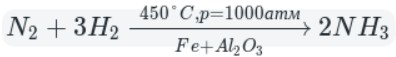
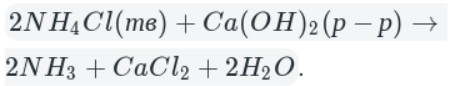
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
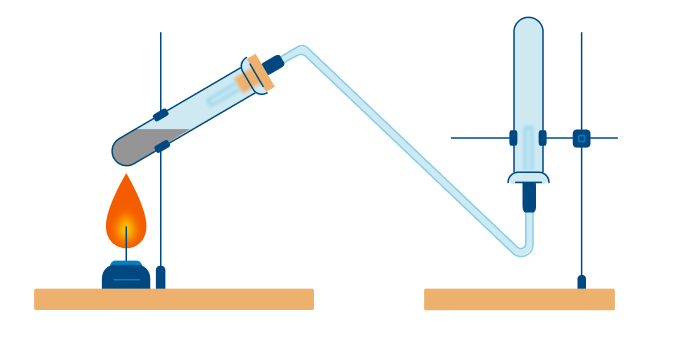
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
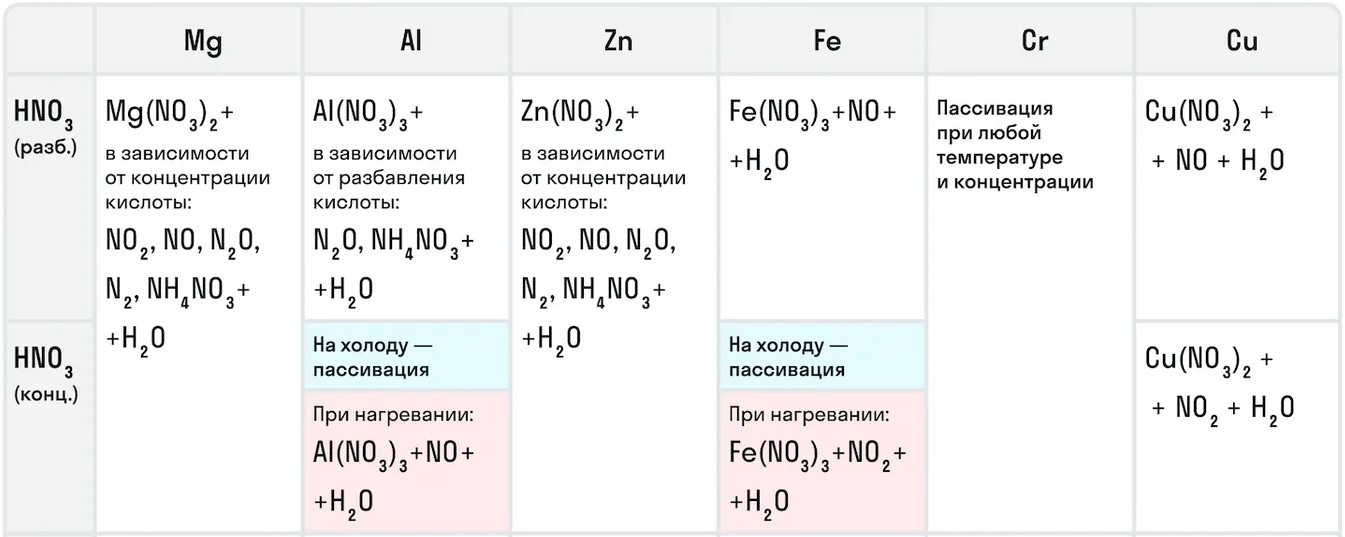
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
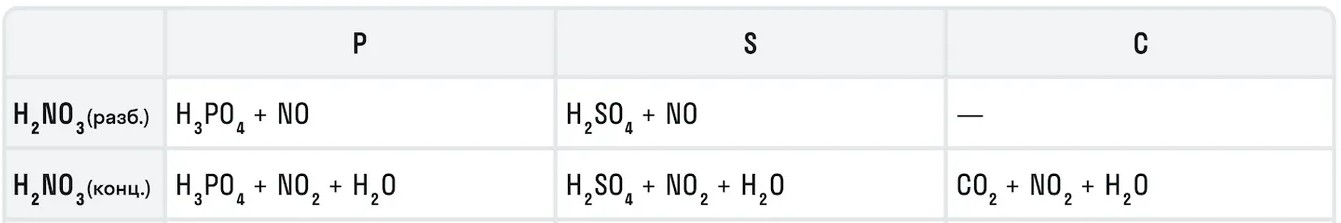
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
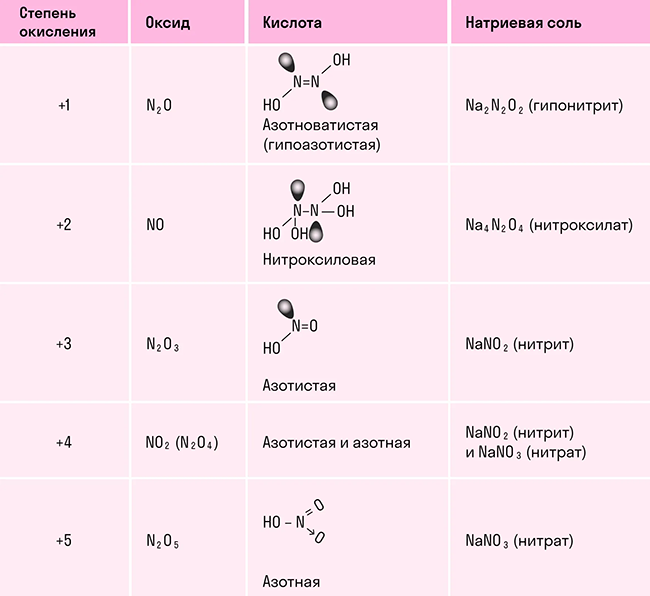
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ — , его «партнер» — частичный положительный заряд δ+ . Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной . Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной .
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например , в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.

Например , для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например : Ca 2+ , CO3 2- .
Для нахождения степеней окисления используют следующие правила :
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной . У всех остальных химических элементов степень окисления — переменная , и зависит от порядка и типа атомов в соединении.
Примеры :
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
Отрицательная степень окисления у металлов.

Действительно, школьная химия говорит нам, что металлы - всегда имеют положительную степень окисления, а так ли это на самом деле? Не совсем. Существует ряд веществ, в которых металлы будут проявлять отрицательную степень окисления.
1. Cs9Pt4H (платинид-гидрид цезия) Соединение Cs9Pt4H было выделено в виде кристаллов вишнево-красного цвета, для его получения использовали реакцию платины с металлическим цезием и гидридом цезия. Изучение платинид-гидрида цезия с помощью ЯМР-спектроскопии и квантовохимического моделирования подтвердило его строение и распределение зарядов;
2. Алкалиды — соли, содержащие в качестве аниона анионы щелочных металлов.
Алкалиды, как правило, содержат катион металла, связанный органическим полидентатным лигандом (краун-эфиры, криптанды, азакрауны и др.) и анион щелочного металла. Были изучены и получены более 30 алкалидов с анионами Na−, K−, Rb− и Cs−
3. Интерметалли́д (интерметаллическое соединение) — химическое соединение двух или более металлов. Интерметаллиды, как и другие химические соединения, имеют фиксированное соотношение между компонентами.
Степень окисления - довольно условная циферка. И отрицательная у металлов встречается нередко. Всякие там станниды или висмутиды.
"Действительно, школьная химия говорит нам, что металлы - всегда имеют положительную степень окисления, а так ли это на самом деле?"
И школьная химия абсолютно права, то что ты привел это сплавы, а не металлы.

Хули эти вещества . Ты пример металла приведи.
В школе нам сначала говорят, что числа бывают только положительные и целые, потом говорят что из большего нельзя вычитать меньшее, потом говорят что на 0 делить нельзя. И всё это правильно, потому что каждой информации своё время, а так можно и 8 класс начать с уравнения Шрёдингера, что бы ну всё по "чесноку".
Не бывает металлов или сплавов с отрицательной степенью окисления? А то в заголовке одно, в тексте уже другое

Ответ на пост «Не нужны уроки сексуального воспитания в школах, пусть, но хотя бы анатомию и физиологию нормально объясняйте»
В 15 лет среди знакомых сверстников узнала о существовании в городе центра "Анти-СПИД", медицинского центра. На его базе было волонтерское отделение, где психологи работали со школьниками старших классов и организовывали встречи с учебными классами в школах города. Идея была в том, чтобы такие же школьники, которым объяснили все про ВИЧ, СПИД, пути заражения, предохранения и тд, рассказывали своим ровесникам, все что нужно, отвечали на их вопросы. Что важно, во время такой встречи учитель должен был выйти из класса, чтобы было максимально доверительное общение и задавались откровенные вопросы, например можно ли заразиться через оральный секс или прерванный половой акт. Ну и конечно в центре нас обучали так, чтобы с одной стороны всей информацией мы владели, но не выглядели ботаниками, которые читают по бумажке доклад.
Это был 2000 год, в нашем городе было засилие героиновых наркоманов. Везде валялись шприцы, да и гуляя во дворе все видели - этот нарик, этот тоже торчит. Ну а дальше по цепочке, один укололся, переспал с подругой, та с другом. Проблема была актуальная. Конечно акцент в этих встречах был именно на проблеме ВИЧ, а не сексуальном просвещении. Но от СПИДа защищают те же презервативы, что и от нежелательной беременности, про них мы тоже говорили.
Лично я пошла в этот центр, чтобы самой узнать про СПИД, потому что в 2000 у кого-то был компьютер и наверное интернет, но не у меня) Но была потребность разобраться.
Сейчас этот центр существует как медицинский, но вряд ли в нем есть подобные группы волонтёров. Я думаю, уже есть несколько статей, по которым подобное можно запретить, закрыть, признать и призвать к ответственности.
Ответ Farengate451 в «Не нужны уроки сексуального воспитания в школах, пусть, но хотя бы анатомию и физиологию нормально объясняйте»
Обитаю в европах и могу немного поделиться про эти самые уроки сексуального воспитания у моих детей.
Их проводили два раза - один раз в 4-5 классе и один раз в седьмом. Оба раза давали информацию по анатомии и физиологии, но во второй раз ещё и по ЗППП, предохранению, ранней беремености, овуляции, согласию и ответственности. Давали информационный материал, где сухо было описано то, что объясняли на уроке специально приглашённые люди. Изображения присутствовали, но схематические как в учебнике.
Никакой пропаганды ЛГБТ, никакой пошлятины - всё по-взрослому, с медицинскими терминами. Лично для меня ничего нового или незнакомого, но я бы не осилил так чётко, сжато и без смущения объяснить всё это дочери. На вопросы ответить смог, но вот всё в полном объёме я бы просто не потянул рассказать.
Я не сторонник ранней половой жизни и сам немного пуританского воспитания, родители никогда не обсуждали со мной подобные темы. Данные уроки считаю правильным делом при условии ответственной подборки материала и ведущего эти уроки.
Если есть вопросы (не по сексуальным аспектам) - буду рад ответить.
В 8 классе кажется, училка биологии молча раздала каждому по 2 листка, на одном влагалище, на другом пенис, и в частям этих органов проведены стрелочки. Наша задача была просто подписать каждый элемент органа. С пенисом все справились быстро, чего сложного, там головка, там мошонка, ну и крайняя плоть.
Со вторым листком ситуация была не однозначная. Влагалище на нем было типа раскрытое, ну как перед гинекологом, что то такое. Девочки справились почти сразу, возможно у них был хотя бы один урок где хоть что-то рассказывали, точно не помню.
А вот мы с парнями обосрались по полной. Писали кто как мог, кто то слышал про точку G - подписал к мочеиспускательному отверстию, кто то даже слышал про внешние половые губы, значит где то там должны быть внутренние наверное, пара минут ушла на то чтобы из ниоткуда вспомнить про какой-то клитор и придумать где он находится. Это было фиаско братцы. Даже я про клитор наверное в южном парке только слышал.
Те кто поумней попробовали поискать ту же схему в учебнике. Те кто посмелей не стаснялись перешептываться с девочками и просить помочь.
Результаты были очевидны, пацанам проставили в основном тройки. Ни объяснений, ни попыток наверстать упущенное в образовании.
К сожалению и сегодня тяжело поднимать такую тему. Мы к этому не предрасположены, закрыты какими то устаревшими моральными комплексами. Единственное что мы можем, это в кругу семьи попросить поделиться знаниями и опытом, что конечно не даёт 100% результата. Где то в семье почитается религия и кроме "береги честь семьи" подросток ничего не узнает.
Перенимать опыт стран Европы тоже считаю нужно с осторожностью, раскройте подросткам границы сексуальной стороны жизни без должной ответственности и у вас будет массовое оплодотворение несовершеннолетних, возможные вспышки ЗППП, сотни уголовных дел о совращении и т.д.
В общем сложное это дерьмо, а я так, чисто поделился нашим опытом. Чукча не писатель и все такое.
Ответ Aleks.Krasnoff в «Не нужны уроки сексуального воспитания в школах, пусть, но хотя бы анатомию и физиологию нормально объясняйте»
Заканчивал школу в 2001 году.
У нас преподаватель по биологии сначала рассказала про функции половых органов у мужчин и женщин, в общих чертах.
А потом всех парней выгнали, а девочкам видимо рассказывали про месячные, ЗППП, предохранения и т.д.
Нам, пацанам, которым по 15-16 лет было никто ничего не собирался рассказывать.
Мне-то в общем и не нужно было, я уже в 1 классе знал всё про размножение/месячные и как всё происходит. Не знал только про ЗППП, уже в ПТУ учась на следующем году узнал, прочитав в книге.
Но чего я никогда не забуду, это хохот и смехуёчки парней и девчонок, когда нам рассказывали про размножение и устройство половых органов. Не смеялся один я, да ещё пара девочек. Всем остальным было очень весело.
Моя история старая, но показательная. 97-й, ВС РФ, срочка. Сидим как-то ночью, чаи гоняем в курилке, человек шесть-семь. Начальство всё по домам. Был в батарее двухметровый детина по прозвищу, естественно, "Малыш". И вот он вваливается к нам: губы трясутся, глаза блестят, уставные трусы мокрые. И дрожащим голосом говорит: Парни, со мной случилось то, что бывает только у мальчиков в 14 лет. Я сначала решил, что шутит, по сторонам посмотрел - у народа напряжённые лица, все за сигаретами потянулись. Ну решил разрядить обстановку, говорю, мол, радуйся, организм работает, как надо. Тут уже ко мне все обернулись с вопросом на лицах. Напомнил им про поллюции. Ноль эмоций. Не может быть, думаю, и начинаю потихоньку, издалека им про это дело рассказывать. Никогда в жизни меня так внимательно не слушали! Минут сорок разглагольствовал. И это люди по 19-20 лет, каждый из которых себя гигантом секса считал.
"Малыш" потом подошёл, говорит: Спасибо, FlyingVombat, я-то думал, что безнадёжно болен.
Ответ Gx460 в «Не нужны уроки сексуального воспитания в школах, пусть, но хотя бы анатомию и физиологию нормально объясняйте»
В 10-11 классе у нас тоже был урок сексуального воспитания в школе. И я была бы рада поделиться, если бы он был хоть в чем-то информативный, но на деле…
Собрали нас, девочек, в классе, зашла тетя, не помню, кем она представилась, но искренне надеюсь, что гинекологом она никогда не работала, и стала просвещать наши неокрепшие умы:
Во-первых, телегония. Да-да, девочки, секс нужен только после свадьбы, иначе ваш ребёнок будет похож на первого полового партнера, так как матка имеет память, а член какие-то особые клетки, способные проникать в женский организм и оставаться там на всю жизнь… нет, презерватив не поможет, эти клетки живучие и проникают через него.
Во-вторых, секс после свадьбы нужен потому, что стопроцентных методов предохранения от беременности (ну и ЗППП, естественно) нет и быть не может. И упустила бы я этот пункт, но дальше нам было рассказано, как работает внутриматочная спираль. Если вкратце, то вставляют в матку нечто похожее на насадку на миксер такого плана
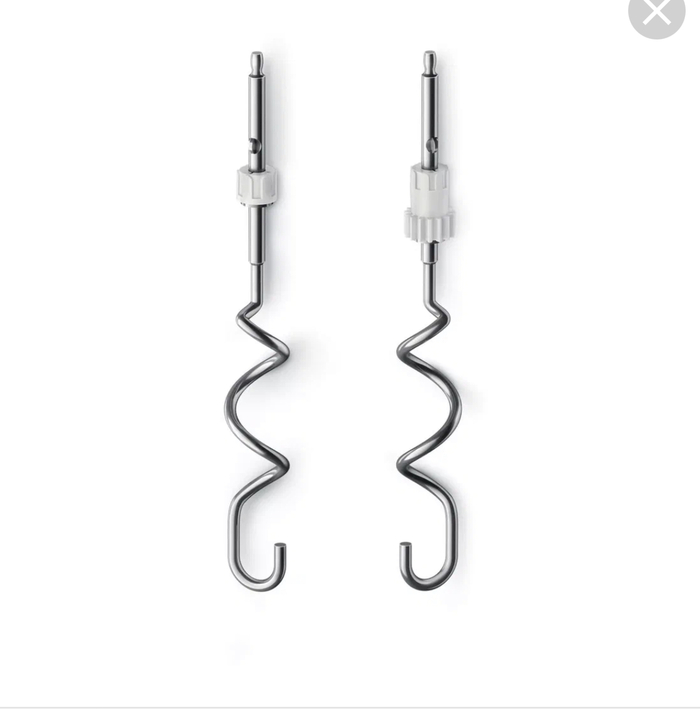
Для наглядности нам это все зарисовали на доске. И вот способ работы этого оборудования в том, что внутри матки этот венчик крутится и соскребает и расчленяет бедного несчастного человеческого детёныша…
В-третьих, что следует из второго пункта, аборт зло. Зло. Зло. Зло. Для того, чтобы мы окончательно в этом утвердились, нам был зачитан и так же дан в распечатанном виде «Дневник нерожденного ребёнка». Мракобесная слезовыжималка.

Окончил школу в 2001, так что не помню уже в каком это классе было. Но хорошо запомнил случай:
У нас учитель по биологии была набожной. Когда что-то рассказывала, она могла приплести религию. В духе: «дети, знаете почему у насекомых 6 лап? Вспомните на какой день Бог создал животных». 🤦🏼♂️
Ну а когда мы должны были перейти к изучению анатомии человека она вообще сказала: «я не буду вам это все рассказывать, изучайте всё самостоятельно дома». Понятно, что никто ничего не читал, так- пролистали в лучшем случае.🤷🏻♂️
С чего вы решили, что более длительный и углубленный курс анатомии и физиологии даст знания по данным вопросам?
Это ПАТфизиология, это вам кажутся очевидными данные факты, поскольку вы учились профильно на врача.
Чтобы понять что аборт не метод контрацепции, нужно проводить урок по методам контрацепции в рамках курса полового воспитания, а где в анатомии и физиологии заложен такой курс? Правильно, нигде!
Про механизмы ожирения и инсулинорезистентности не всегда даже узкопрофильный врач знает, поэтому существуют эндокринологи, которые знают как лечить его. И тут дело не в заблуждении о лечении содой, а в том, что многие слепо уверены: достаточно меньше жрать. Вы хотите впихнуть эти знания в голову школьников? Голова взорвется!
Про хламидиоз вообще молчу, нужно знать определенные моменты физиологии, патофизиологии, микробиологии, дерматовенерологии, гинекологии. Какой нахрен школьный курс?
Вы путаете необходимые «бытовые» знания, которые должны приниматься де-факто без понимания сущности и просто применяться в жизни (к примеру, прочитал про хламидиоз в Википедии, или, допустим, объяснили просвещенные в данном вопросе родители / знакомые) и наполнение школьного курса по анатомии и физиологии.
Да, имеется необходимость каких-то прикладных курсов в школе: «половое воспитание», «первая медицинская помощь», «информационная культура» и пр., но это никак не связано с анатомией и физиологией. Хотя согласен, что в головах большинства людей роятся дикие, а иногда варварские мысли «о правильном» в разных сферах жизни.
У меня в школе тоже достаточно пожилая учительница в конце 90-х постеснялась объяснять и рассказывать, но у меня был свой самоучитель:

Сколько же там было всего интересного: письма в редакцию, советы, анекдоты.
Мне родители не проводили лекций о половом созревании, но, мне кажется, они специально оставляли эту литературу в туалете.
Именно, благодаря этой газете, я был более чем готов к своему первому разу)

Ответ на пост «Лабораторные работы в школе: "Провести нельзя игнорировать"»
Есть еще другая проблема. Отсутствие в школе материально-технической базы для проведения лабораторных практикумов. Старые, просроченные реактивы советских еще времен, не хватает лабораторной посуды.
А еще банальный страх администрации образовательных учреждений.
Работала я в одной из школ учителем химии. Мой предшественник как-то видимо нарушил ТБ и устроил в кабинете пожар во время одной из лабораторных работ. Учителя уволили, кабинет отремонтировали. А еще списали и утилизировали почти все реактивы и оборудование, оставив только советские, с истекшим сроком годности.
На мой вопрос, как проводить лабораторные работы, мне сказали - показывайте видеоуроки с Ютуба.
А потом из детей, ни разу в школе не прикоснувшихся к лаб. посуде, не умеющих лить кислоту в воду, получаются первокурсники естественнонаучных и медицинских специальностей, у которых трясутся руки при попытке взять в руки пробирку или колбу, и не дай Бог, что-то смешать. Такое тоже видела.
Из этой школы я ушла, по комплексу факторов. Это был один из них.
Лабораторные работы в школе: "Провести нельзя игнорировать"
Немного о наболевшем.
Меня очень сильно расстраивает современная тенденция по игнорированию учителями естественных наук лабораторных практикумов. Очень больно смотреть на высохшие рН-электроды, на совершенно новые газоанализаторы с вышедшими из строя датчиками (некоторые имеют срок годности и со временем портятся), слежавшиеся в камень реактивы, запылившиеся микроскопы. Понятное дело, порой причина кроется в преподавателях — кому-то лень, кому-то некогда. В той школе, где работал я — на это было плевать всем, вплоть до директора. У меня были дорогущие цифровые лаборатории с современными датчиками, но не было даже нормального количества стаканов, не говоря уже о весах и бюретках. Директор школы предлагал мне пользоваться рычажными весами с гирьками, а слежавшиеся реактивы из стеклянных пузырьков с узким горлышком выковыривать карандашом. За 4 месяца пинания разных управленцев мне так и не смогли повесить дистиллятор (он всё это время валялся по вытяжным шкафом).
И я прекрасно понимаю, что таких школ много. Как бороться с этим изнутри я не представляю. Но! Сейчас я учусь в магистратуре и темой своей дипломной работы я взял экспертизу качества проведения лабораторных практикумов в средней школе. На мой взгляд, повысить количество и качество практикумов на сегодняшний день можно лишь в том случае, если создать нормативную базу, а так же регулярно проверять школы на исполнение этой нормативной базы, заранее рассказав всем что и как будет проверяться.
На мой взгляд, только так можно увеличить скорость закупки реактивов и оборудования. Только так учитель может донести до руководства необходимость наличия тех или иных приборов. Только так можно содействовать появлению мотивации учителей реально проводить практические работы.
С другой стороны, я очень часто слышал, мол, а зачем всё это надо? Кто хочет — найдёт практикум на стороне, нам главное на ЕГЭ натаскать, да и вообще, лабораторные работы — это лишний геморрой. А так — "Праки реже — деньги те же!"
А как Вы считаете, есть ли другие методы улучшения ситуации с лабораторными работами? И нужно ли вообще в этой области что-то делать?
Ну и бонусом, буду признателен всем, кто ответит на небольшой опросник. Он анонимный. Хотелось бы видеть хотя бы примерный масштаб трагедии.
UPD: Пост не призывает куда-то писать, кому-то жаловаться и так далее. Я сам лично буду проталкивать наверх проекты нормативок. А здесь мне больше интересно, насколько это вообще важно для обывателя. Для родителей, дети которых ходят или пойдут в школу, для тех, кто работает по ту сторону баррикад. Насколько вообще то, что я делаю, нужно для общества.
Читайте также:
