Металлы образующие амфотерные оксиды и гидроксиды
Обновлено: 21.09.2024
Кто-то любит соленое, кто-то любит сладкое, а кто-то — и то, и другое. То же самое происходит и с амфотерными металлами.
Характеристика амфотерных металлов
Под амфотерностью понимают способность соединений проявлять одновременно и кислотные, и основные свойства в зависимости от условий и природы реагентов, участвующих в реакции.
Список амфотерных металлов включает в себя множество наименований. Из них мы рассмотрим цинк и алюминий.
Характеристики элементов-металлов
Алюминий — элемент IIIA группы третьего периода. Его электронная конфигурация [Ne]3s 2 3p 1 .
В возбужденном состоянии электронная пара на 3s-орбитали распаривается. В результате образуются три неспаренных электрона, которые способны образовывать химические связи. Поэтому у алюминия постоянная степень окисления +3.
Цинк — расположен во IIВ группе в четвертом периоде. Цинк относится к d-элементам, при этом атом цинка имеет полностью заполненные 3d– и 4s– электронные подуровни.
Его электронная конфигурация в основном состоянии [Ar]3d 10 4s 2 . В соединениях цинк проявляет постоянную степень окисления +2.
Физические свойства
Алюминий — лёгкий серебристо-белый металл, покрывающийся на воздухе оксидной плёнкой из-за взаимодействия с кислородом (на фото расположен слева). Из алюминия часто делают тысячи вещей, которые окружают нас в быту: от фольги на баночке йогурта до стильного корпуса смартфона.
Цинк — голубовато-белый металл (на фото расположен справа).
Способы получения
Химические свойства
По химическим свойствам они являются типичными восстановителями, а значит, способны реагировать с окислителями. Как и другие металлы, они будут взаимодействовать со своими противоположностями — неметаллами. Также они будут вступать в реакции вытеснения с водой, кислотами-неокислителями, щелочами и солями менее активных металлов.
Как типичные металлы, алюминий и цинк способны вступать в реакции с неметаллами и образовывать различные бинарные соединения.
Ввиду низких значений электроотрицательности алюминий и цинк, как и другие металлы, являются отличными восстановителями. Настолько сильными, что они даже способны восстанавливать некоторые металлы и неметаллы из их оксидов. Этот процесс называется металлотермией.
| Активные металлы (стоящие до алюминия в ряду активности) не получают путём восстановления из оксидов. |
Алюминий является очень активным металлом, который, помимо этого, ещё и является одним из наиболее распространённых в земной коре.
Его очень часто используют в металлургии для получения других металлов из их оксидов. Этот процесс называется алюмотермией.
Так как алюминий и цинк — металлы, стоящие в ряду активности левее водорода, то они способны вытеснять водород из воды.
Алюминий, подобно другим активным металлам, при взаимодействии с водой образует гидроксид и водород.
Цинк является уже менее активным металлом, поэтому нуждается в создании более жёстких условий для реакции с водой. Он взаимодействует только с перегретым водяным паром и в таких жёстких условиях вытесняет из воды ОБА атома водорода, превращаясь в оксид.
Алюминий и цинк также способны вытеснять водород не только из воды, но и из кислот-неокислителей.
С кислотами-окислителями протекают более сложные ОВР, при этом помним, что в холодных концентрированных растворах кислот-окислителей алюминий пассивируется из-за наличия оксидной плёнки на его поверхности.
Амфотерные металлы реагируют со щелочами, причем продукты зависят от определенных условий:
Как и другие металлы, алюминий и цинк способны вытеснять менее активные металлы из их солей.
Оксиды алюминия и цинка
Оксиды алюминия и цинка по физическим свойствам представляют собой бесцветные порошки, нерастворимые в воде.
По химическим свойствам это типичные амфотерные оксиды, которые способны вступать в основно-кислотные взаимодействия как с основным, так и с кислотным. Как и другие оксиды, они могут вступать в ОВР с сильными восстановителями с восстановлением из них металла.
Оксидам алюминия и цинка соответствуют нерастворимые гидроксиды Al(OH)3 и Zn(OH)2, поэтому и сами оксиды с водой не взаимодействуют.
Как типичные амфотерные оксиды, оксиды алюминия и цинка будут реагировать как с веществами, проявляющими основные свойства (основаниями, основными оксидами), так и с веществами, проявляющими кислотные свойства (кислотами, кислотными оксидами):
- ОВР с сильными восстановителями
Как и другие оксиды, оксид цинка может вступать в ОВР с сильными восстановителями (C, CO, H2, Al, Mg, Ca и т. д.) с восстановлением из них металла.
Гидроксиды алюминия и цинка
По физическим свойствам гидроксиды алюминия и цинка представляют собой белые порошкообразные вещества, нерастворимые в воде. Все их химические свойства обусловлены тем, что они являются амфотерными гидроксидами: они способны вступать в реакции как с основным, так и с кислотным.
Помимо этого, как и для других нерастворимых гидроксидов, для гидроксидов алюминия и цинка характерны реакции термического разложения.
- Гидроксиды алюминия и цинка как амфотерные гидроксиды
- Термическое разложение гидроксидов
Подобно другим нерастворимым гидроксидам, нерастворимые Al(OH)3 и Zn(OH)2 способны разлагаться при нагревании на соответствующий оксид и воду.
Важнейшие химические свойства солей
- Реакции с растворами щелочей
Соли алюминия и цинка реагируют с растворами щелочей.
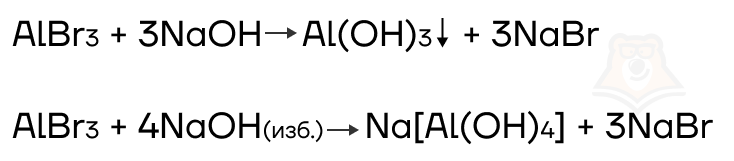
- Разрушение комплексных солей и их аналогов кислотами
Если сильная кислота находится в недостатке, её хватает только для самого сильного металла (щелочного или щелочно-земельного). В результате образуется соль и амфотерный гидроксид, возможно также образование воды.
Если сильная кислота находится в избытке, её хватает на оба металла: образуются две соли и вода.
Со слабыми кислотами (угольной CO2(р-р), сернистой SO2(р-р), сероводородной H2S) ситуация немного сложнее:
- Если слабая кислота находится в недостатке, её также хватает только для самого сильного металла (щелочного или щелочно-земельного).
— Если слабая кислота находится в избытке, в продуктах образуется кислая соль (из-за избытка кислотного) и амфотерный гидроксид.Со слабой кислотой он не взаимодействует, так как сам слабый.
При нагревании комплексной соли будет происходить выпаривание из неё воды. В анионе там, где нет воды (например, в расплаве), образуются средние соли с амфотерными металлами.
Самые “страшные” реакции с участием комплексных солей — их реакции с солями. Чтобы их написать, можно для себя представить комплексную соль как совокупность щёлочи и амфотерного гидроксида.
Фактчек
- Алюминий и цинк относятся к амфотерным металлам, то есть таким, которые могут реагировать и с кислотами, и со щелочами в зависимости от природы реагирующих веществ.
- Алюминий относится к p-элементам, его постоянная степень окисления +3; цинк относится к d-элементам, его постоянная степень окисления +2.
- Алюминий и цинк реагируют с рядом веществ: неметаллами, водой, кислотами, щелочами, солями.
- Оксиды и гидроксиды алюминия и цинка также обладают амфотерными свойствами ,что определяет их химическое поведение в различных реакциях.
- Алюминий и цинк способны образовывать особый тип солей, называемый комплексными.
Проверь себя
Задание 1.
Какими свойствами обладают алюминий, цинк и их оксиды и гидроксиды?
- Основными свойствами;
- Кислотными свойствами;
- Амфотерными свойствами;
- Нейтральными свойствами.
Задание 2.
Цинк реагирует с водой с образованием:
- Оксида цинка и водорода;
- Гидроксид цинка и водорода;
- Цинката и водорода;
- Гидрида цинка и кислорода.
Задание 3.
Что можно наблюдать при приливании раствора гидроксида натрия к раствору хлорида алюминия?
- Выделение газа;
- Выпадение осадка;
- Видимых изменений не наблюдается;
- Выпадение осадка, а затем его растворение.
Задание 4.
Что образуется в реакции оксида цинка и сернистого газа?
- Сульфат цинка;
- Сульфит цинка;
- Сульфид цинка и кислород;
- Реакция не идет.
Задание 5.
Какая соль образуется при взаимодействии тетрагидроксоалюмината натрия и избытка сероводорода?
- Средняя соль;
- Комплексная соль;
- Кислая соль;
- Основная соль.
ОТВЕТЫ: 1. — 3; 2. — 1; 3. — 4; 4. — 4; 5. — 3
Металлы образующие амфотерные оксиды и гидроксиды
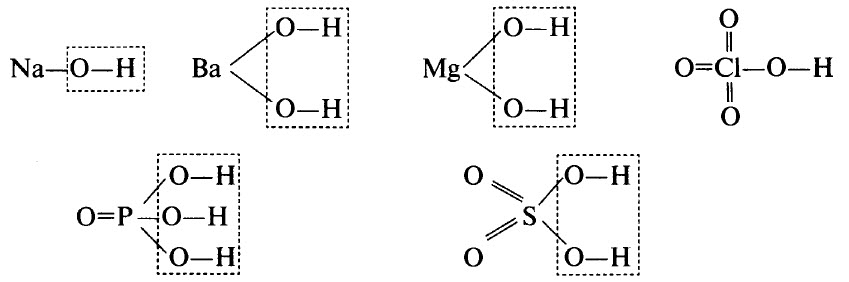
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O

Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO2 2– .
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2 – .
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей
Амфотерные гидроксиды проявляют свойства как основных, так и кислотных гидроксидов в зависимости от среды.
Большинство металлов периодической системы могут образовывать амфотерные гидроксиды, чаще всего это гидроксиды металлов в степени окисления «+2» и «+3», а также, теоретически, гидроксиды металлов в степени окисления «+4», хотя большинство из них не выделены (для них существуют только соответствующие соли). Подробнее о классификации гидроксидов можно прочитать в статье «Классификация гидроксидов и оснований»
Химические свойства амфотерных гидроксидов
- Как уже было сказано выше, амфотерные гидроксиды ведут себя как типичные основания при реакции с кислотами:
- Амфотерные гидроксиды реагируют с твёрдыми щелочами при сплавлении и с растворами концентрированных щелочей:
В растворах щелочей:
О том, какие анионы характерны для амфотерных оксидов и гидроксидов, Вы можете прочитать в статье «Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных»
- Амфотерные гидроксиды взаимодействуют с солями, образованными щелочным металлом и анионом, с которым «амфотерный металл» не может образовать существующую или устойчивую соль (для алюминия это сульфиты, сульфиды, карбонаты, нитриты, ацетаты и силикаты). Информация о том, существует ли соль или мгновенно разлагается в водных растворах, можно получить из таблицы растворимости:
- Амфотерные гидроксиды разлагаются при нагревании на воду и соответствующих оксид (степень окисления металла в исходном гидроксиде и в полученном оксиде одинаковая):
Получение амфотерных гидроксидов
Напрямую, растворением соответствующего оксида в воде, амфотерный гидроксид получить нельзя из-за низкой растворимости в воде амфотерных оксидов. Поэтому амфотерные гидроксиды получают в основном из солей.
- Действием раствора щелочи на растворимую соль, содержащую металл, соединения котного могут проявлять амфотерность:
В этих реакциях не используют концентрированный раствор щелочи и большие избытки растворов щелочи, иначе образуются не амфотерные гидроксиды, а комплексные соединения:
Зависимость продукта от количества взятой щелочи можно выразить следующей схемой:
- Амфотерные гидроксиды получают действием на растворы солей, содержащих «амфотерный» металл аммиака:
- Амфотерные гидроксиды получают действием на раствор соли, содержащей «амфотерный» металл растворов солей, содержащих анион, с которым амфотерный металл не образует существующих солей или соли гидролизуются в водной среде:
- Амфотерные гидроксиды можно получить действием разбавленных кислот на гидроксокомплексы:
Если использовать избыток кислоты, то образуется не амфотерный гидроксид, а соль, так как избыток кислоты растворяет гидроксид:
Амфотерные оксиды. Получение, химические свойства, образование средних и комплексных солей
Амфотерность – способность веществ проявлять кислотные или основные свойства в зависимости от реагента. Так, оксид алюминия, с кислотными оксидами и кислотами ведёт себя как основный оксид, а со щелочами и основными оксидами – как кислотный оксид.
Какие оксиды называют амфотерными?
К амфотерным относят в основном оксиды металлов +3 и +4 степени окисления, но также можно встретить амфотерные оксиды и в степени окисления «+2».
Таблица 1. – Примеры амфотерных оксидов в различных степенях окисления
В таблице представлены лишь самые популярные примеры оксидов, встречающихся на ЕГЭ, многие другие оксиды при различных условиях реагируют как со щелочами, так и с кислотами.
Подробнее о классификации оксидов можно узнать в статье Классификация оксидов
Химические свойства амфотерных оксидов
- Амфотерные оксиды проявляют свойств основных оксидов в реакции с кислотами:
- Амфотерные оксиды проявляют основность при реакции с кислотными оксидами:
- Амфотерные оксиды проявляют свойства кислотных оксидов при взаимодействии со щелочами (растворимыми основаниями). При этом реакция осуществима как в растворах с концентрированными щелочами, так и при сплавлении.
В растворах:
Полученную соль называют тетрагидроксоцинкат натрия
Полученную соль называют тетрагидроксоалюминат натрия.
Формула полученной соли зависит от количества воды и щелочи, вступивших в реакцию, так в избытке щелочи образуется гексагидроксоалюминат, а не тетрагидроксоалюминат:
При сплавлении:
Полученная соль называется цинкат натрия.
Полученная соль называется алюминатом калия (метаалюминат)
В следующих таблицах приведены некоторые средние и комплексные анионы, в состав которых входят амфотерные металлы.
Таблица 2. – Анионы, содержащие амфотерные металлы в валентности II.
Таблица 3. – Анионы, содержащие амфотерные металлы в валентности III.
Соли с координационным числом «6» образуются в сильном избытке щелочи.
Таблица 4. – Наиболее распространенные ионы, содержащие амфотерные металлы в валентности IV.
Пользуясь данными таблицами, можно назвать многие соли, например, средние соли:
KAlO2 – алюминат калия
NaAlO2 – алюминат натрия
BaZnO2 – цинкат бария
CaBeO2 – бериллат кальция
K2PbO2 – плюмбит калия, содержит свинец (II)
BaPbO2 – плюмбит бария
K4PbO4 – плюмбат (ортоплюмбат) калия, содержит свинец (IV)
KCrO2 – хромит калия
NaFeO2 – феррит натрия
И комплексные соли:
K[Al(OH)4] – тетрагидроксоалюминат калия
K3[Al(OH)6] – гексагидроксоалюминат калия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Ca[Zn(OH)4] – тетрагидроксоцинкат кальция
K2[Be(OH)4] – тетрагидроксобериллат калия
Ba[Be(OH)4] – тетрагидроксобериллат бария
Na2[Pb(OH)4] – тетрагидроксоплюмбит натрия
Na2[Pb(OH)6] – гексагидроксоплюмбат натрия
Ca[Sn(OH)6] – гексагидроксостаннат кальция
Na[Cr(OH)4] – тетрагидроксохромит натрия
K3[Cr(OH)6] – гексагидроксохромит калия
Ca3[Cr(OH)6] – гексагидроксохромит кальция
Na3[Fe(OH)6] – гексагидроксоферрит натрия
Как составлять формулы безводных солей?
Например, в реакции участвовал оксид свинца IV и оксид кальция:
В первую очередь необходимо знать остатки соответствующих кислот, следовательно и формулы кислот, содержащих амфотерный металл. И хоть многие из них не выделены, теоретически мы можем установить их формулы. Для амфотерных металлов в III и IV валентности можно установить орто- и мета-формулы кислот. Для металлов в II валентности выделяют только одну форму кислоты, поэтому для них не указывают уточняющую приставку «орто-» или «мета-», а вывод формулы соответствует выводу как орто- так и мета-формул кислот и их остатков у металлов в III и IV валентности.
Орто-формула соответствует гидроксиду амфотерного металла с учетом того, что в кислоте порядок элементов меняется (водород должен стоять на первом месте).
Таблица 5. – Амфотерные оксиды и кислотные остатки, соответствующие им
Для амфотерных металлов в III валентности можно выделить общую формулу орто-кислоты и орто-аниона: H3MeO3 и MeO3 3- .
Для амфотерных металлов в IV валентности можно выделить общую формулу орто-кислоты и орто-аниона: H4MeO4 и MeO4 4- .
Таким образом, в реакции оксида свинца IV и оксида кальция можно получить ортоплюмбат кальция:
PbO2 + 2CaO = Ca2PbO4 (ортоплюмбат кальция)
Для этих же металлов можно вывести мета-формулы кислот и их остатков, для этого при образовании формулы используются наименьшие значения индексов. Так, формула орто-хромистой кислоты, как и любого другого гидроксида в кислотной форме, начинается с водорода, а заканчивается кислородом, степень окисления хрома «+3» учитывается при установке индексов:
Подробнее о таком способе можно прочитать в статье Свойства кислотных оксидов
Таким образом, оксиду алюминия и оксиду свинца IV соответствуют следующие мета-формулы:
Таблица 6. – Амфотерные оксиды и кислотные остатки, соответствующие им
Поэтому в реакции между оксидом кальция и диоксидом свинца может образоваться и метаплюмбат кальция.
- Амфотерные оксиды проявляют свойства кислотных в реакциях с основными оксидами. Реакция происходит при сплавлении:
ZnO + CaO = CaZnO2 – цинкат кальция
Al2O3 + SrO = Sr(AlO2)2 – алюминат (метаалюминат) стронция
- Амфотерные оксиды способны вытеснять летучие оксиды из солей:
- Как и многие другие нерастворимые оксиды, амфотерные оксиды реагируют с восстановителями (C, CO, H2, NH3, CH4, более активные металлы). Реакции идут только при нагревании.
Получение амфотерных оксидов
- Термическое разложение амфотерных гидроксидов:
Данная реакция не подходит для получения оксида железа III, так как при окислении железа образуется двойной оксид Fe3O4.
- Термическим разложением нитратов. Причем, если в состав катиона входит металл с переменной степенью окисления, в продукте его степень окисления может измениться:
Оксиды хрома и железа в III валентности разлагаются без изменения степени окисления металла:
Классификация оксидов
Все сложные неорганические вещества можно разделить на следующие группы:
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»
* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K + и O2 -1 .
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
* Гидроксид – соединение элемента с гидроксо-группой (OH ‒ ).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
Классификация оксидов неметаллов.
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
Классификация оксидов металлов.
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Читайте также:
