Металлы особенности строения атомов и кристаллов
Обновлено: 15.05.2024
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39металлы легкоплавкие (менее 100 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см 3 ) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см 3 ).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества - металлы всегда являются восстановителями.
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | |||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 и конц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al 3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
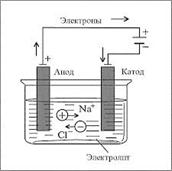
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
Лекция "Особенности атомно-кристаллического строения металлов"по дисциплине "Основы материаловедения"
Материаловедение - это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами.
Создание научных основ металловедения по праву принадлежит. Чернову Д.К., который установил критические температуры фазовых превращений в сталях и их связь с количеством углерода в сталях. Этим были заложены основы для важнейшей в металловедении диаграммы состояния железоуглеродистых сплавов.
Открытием аллотропических превращений в стали, Чернов заложил фундамент термической обработки стали. Критические точки в стали, позволили рационально выбирать температуру ее закалки, отпуска и пластической деформации в производственных условиях.
В своих работах по кристаллизации стали, и строению слитка Чернов изложил основные положения теории литья, не утратившие своего научного и практического значения в настоящее время.
Великий русский металлург Аносов П.П. впервые применил микроскоп для исследования структуры металлов. Ему принадлежит приоритет в создании легированных сталей. Разработал теорию и технологию изготовления клинков из булатной стали. Из его работ стало ясно, что так называемый булатный узор на поверхности стали, непосредственно зависит от ее внутренней структуры.
В 1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Для решения практических задач знание фазового равновесия в той или иной системе необходимо, но не достаточно для определения состава и относительного количества фаз. Обязательно знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а также распределение, размер и форму кристаллов каждой фазы.
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов.
В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз.
В пятидесятых годах, когда началось исследование природы свойств металлических материалов, было показано, что большинство наиболее важных свойств, в том числе сопротивление пластической деформации и разрушению в различных условиях нагружения, зависит от особенностей тонкого кристаллическо строения. Этот вывод способствовал привлечению физических теорий о строении реальных металлов для объяснения многих непонятных явлений и для конструирования сплавов с заданными механическими свойствами. Благодаря теории дислокаций, удалось получить достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики.
Основными направлениями в развитии металловедения является разработка способов производства чистых и сверхчистых металлов, свойства которых сильно отличаются от свойств металлов технической чистоты, с которыми преимущественно работают. Генеральной задачей материаловедения является создание материалов с заранее расчитаными свойствами применительно к заданным параметрам и условиям работы. Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и высокие температуры и давление).
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
По данным института имени Байкова А.Н. в нашей стране есть все условия чтобы в течении 10…15 лет машиностроение могло перейти на выпуск алюминиево-титановой подвижной техники, которая отличается легкостью, коррозионной стойкостью и большим безремонтным ресурсом.
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических) – пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Металлы, особенности атомно-кристаллического строения
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определ¨нным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объ¨му металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определ¨нным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объ¨ма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
размеры р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определ¨нными. ·
· углы между осями ().
координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. ·
базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки. ·
плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) ·
Рис.1.1. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
примитивный – узлы решетки совпадают с вершинами элементарных ячеек; ·
· базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
объемно-центрированный – атомы занимают вершины ячеек и ее центр; ·
гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней ·
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических реш¨ток являются:
1. Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, )
2. Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, )
3. Гексагональная, в основании которой лежит шестиугольник:
o простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
o плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим располохением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Д ля обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Для определения индексов кристаллографической кристаллографической плоскости необходимо:
установить координаты точек пересечения плоскости с осями координат в единицах периода решетки; ·
взять обратные значения этих величин; ·
привести их к наименьшему целому кратному, каждому из полученных чисел. ·
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках. Примеры обозначения кристаллографических плоскостей на рис. 1.3 а.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
одну точку направления совместить с началом координат; ·
установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки ·
привести отношение этих координат к отношению трех наименьших целыж чисел. ·
Индексы кристаллографических направлений указываются в квадратных скобкаж [111]
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют теже индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Магнитные превращения
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
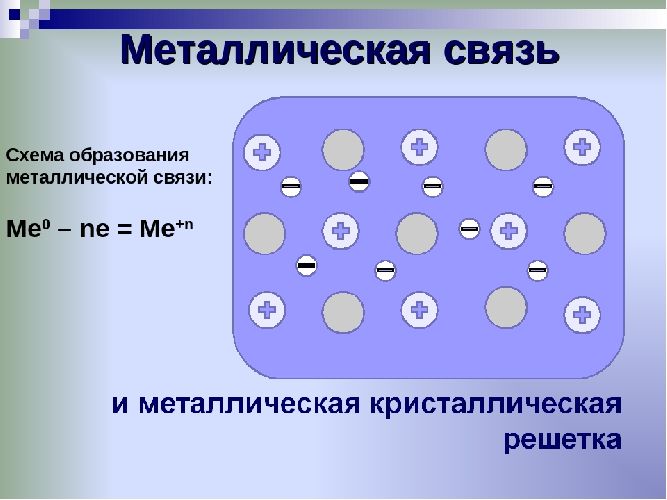
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
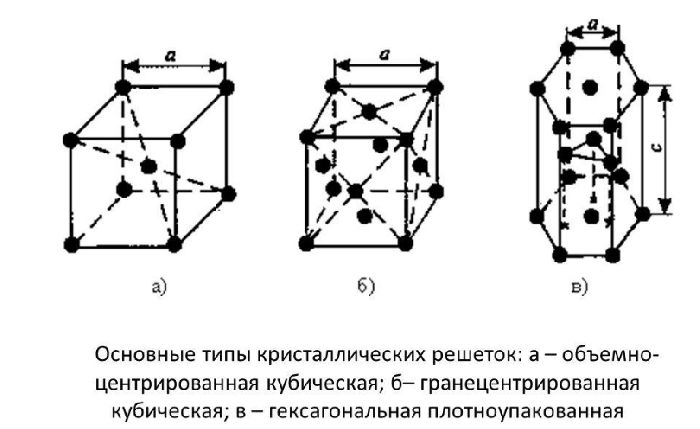
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
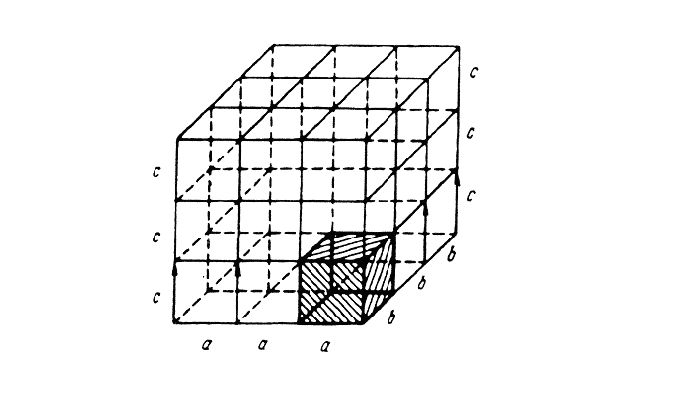
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Металлы, особенности атомно-кристаллического строения
Металлы – один из классов конструкционных материалов, характеризующийся определ¨нным набором свойств:
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определ¨нным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
Элементарная ячейка – элемент объ¨ма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
· размеры р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определ¨нными.
· координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
· базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
· плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74)
· примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
· объемно-центрированный – атомы занимают вершины ячеек и ее центр;
· гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим располохением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Для обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
· установить координаты точек пересечения плоскости с осями координат в единицах периода решетки;
· взять обратные значения этих величин;
· привести их к наименьшему целому кратному, каждому из полученных чисел.
· одну точку направления совместить с началом координат;
· установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки
· привести отношение этих координат к отношению трех наименьших целыж чисел.
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Конспект лекции по теме "Металлы - особенности строения атомов, способы получения и свойства" дисциплины ОУД.10 Химия, специальности Фармация, СПО
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s -элементы I и II групп (исключение — водород), все d - и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
♦ небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
♦ малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
♦ сравнительно слабая связь валентных электронов с ядром;
♦ низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. м еталлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Me n + + пе - = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
2. Способы получения металлов
Пирометаллургия — восстановление безводных соединений при высокой температуре
С или СО (карботермия)
Сульфиды предварительно обжигают:
2 = 2 ZnO + 2 S 02
ZnO + С = Zn + 2СО
Fe, Cu, Pb, Sn, Cd, Zn
Mn, Cr, W, Mo, Ti, V
H 2 (водородотермия)
Оксиды активных металлов (МgО, СаО, А1203 и др.) водородом не восстанавливаются
Cu, Ni, W, Fe, Mo, Cd, Pb
Электрометаллургия – восстановление электрическим током
2 1
электролиз 2 Na + Cl 2
Щелочные металлы, Be , Mg , Ca (из расплавленных хлоридов), Al – из расплавленного оксида
К Ni 2+ + 2е - = Ni 2
А 2Н2О - 4е - = O 2 + 4Н + 1
4 + 2Н2О электролиз 2 Ni + О2 + Н2 SO 4
Гидрометаллургия – восстановление из растворов солей
Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом:
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а ) 1s 2 2s 2 2 р 6 3s 2 3 р 6 ; в ) 1s 2 2s 2 2 р 4 ;
б) 1 s 2 2 s 2 2р 6 ; г ) 1 s 2 2 s 2 2р 6 3 s 2 ;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди ( II ) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см 3 ) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1\/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
3. Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1). Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блеск и непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см 3 ): Na , Са , Mg , Al , Ti — и тяжелые (плотность больше 5 г/см 3 ): Zn , Cr , Sn , Mn , Ni , С u , Ag , Pb , Hg , Аи, W , Os - самый тяжелый ;
2). по значению температуры плавления — на легкоплавкие ( t пл < 1000 °С): Hg , Na , Sn , Pb , Zn , Mg , Al , Ca , Ag — и тугоплавкие ( t пл > 1000 ° C ): Au , Cu , Mn , Ni , Fe , Ti , Cr , Os , W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей ( Fe , Со, Ni );
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях ( Al , Cr , Ti );
в) диамагнитные — не притягиваются к магниту ( Sn , С u , Bi ).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе - = Me п+ (окисление)
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1). Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
Основной продукт окисления натрия — пероксид:
При горении других щелочных металлов образуются супероксиды, например:
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
На реакции пероксида натрия с оксидом углерода (1 V ) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
Читайте также:
