Металлы побочных подгрупп меди
Обновлено: 04.10.2024
Цель урока: сформировать у учащихся представления о специфических свойствах металлов побочных подгрупп на примере меди и цинка.
Задачи урока:
Развивающие : развитие речи, внимания, памяти, познавательного интереса, потребности в приобретении и применении знаний.
Образовательные:
1) закрепление и углубление знаний о положении меди, цинка, хрома в периодической системе химических элементов, о строении их атомов, о физических и химических свойствах металлов, об их получении, о наиболее важных природных соединениях меди, цинка об их применении и практической значимости.
2) повторение характеристик изученных веществ, развитие умений составлять уравнения химических реакций, определять их тип;
3) совершенствование умений экспериментально подтверждать химические свойства веществ;
Воспитательные : воспитание у учащихся культуры речи, поведения, манеры.
Формировать УУД:
Познавательные УУД : умение осуществлять поиск нужной информации, выделять главное в тексте, структурировать учебный материал, грамотно формулировать вопросы,
Личностные УУД : умение применять полученные знания в своей практической деятельности.
Регулятивные УУД: умение планировать свою работу при выполнении заданий учителя, делать выводы по результатам работы.
Коммуникативные УУД: умение работать в составе творческих групп, высказывать свое мнение.
Оборудование:
Периодическая система химических элементов Д.И.Менделеева;
Реактивы: Al , Zn , Cuo ;
Растворы: CuCl 2, HCl , ZnCl 2, NaOH , CuSO 4.
1. Организационный момент
2. Мотивация
«Жить – это значит узнавать» (Д.И. Менделеев)
3. Актуализация знаний.
Давно известно человеку:
Она тягуча и красна,
еще по бронзовому веку
знакома в сплавах всем она.
С горячей серной кислотой
дает нам синий купорос. (Медь)
Без него ржавеют машины
Без него не растут цветы
Без него не сделать резины
Без него не чувствуют носы
Да кто же он? Волшебник?
Что без него так трудно на Земле? (Цинк)
- Какие закономерности изменения химической активности проявляются у металлических элементов в главных подгруппах?
Химическая активность металлов главных подгрупп в периодах возрастает справа налево, а в группах – сверху вниз.
- Каким образом происходит заполнение электронами у металлов главных подгрупп?
Металлы главных подгрупп являются S - и P - элементами, поэтому у них происходит заполнение электронами последнего энергетического уровня S - и P -подуровней. Количество электронов на внешнем энергетическом уровне соответствует номеру группы, в которой находится металл.
-Какие закономерности изменения химической активности проявляются у металлических элементов в побочных подгруппах?
Химическая активность металлов побочных подгрупп возрастает в направлении снизу-вверх, нежели в главных подгруппах.
4.Подготовка к ЕГЭ.
Решу ЕГЭ. Задание № 6
5.Объяснение нового материала.
Сегодня на уроке мы познакомимся с металлами: медью, цинком и их соединениями.
1.Строение атомов .
2.Нахождение в природе .
Медь и цинк встречаются в связанном виде и входят в состав следующих минералов:
Медный блеск Cu 2 S , куприт Cu 2 O , медный колчедан CuFeS 2, цинковая обманка ZnS , цинковый шпат ZnCO 3.
4. Физические свойства
Медь-металл светло-розового цвета, тягучий, вязкий, t пл=1083 C , отличный проводник электрического тока. Цинк – голубовато-серебристый металл. При обычной температуре хрупок, t пл=419,5 C
5. Химические свойства.
Медь - химический малоактивный металл. Цинк - химический активный металл, но в воздухе он устойчив, т.к. покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления
1) Взаимодействие с простыми веществами ( CL 2, О2, S ) при повышенной температуре.
2) Взаимодействие со сложными веществами
6. Получение.
Работа с учебниками стр.135.
7. Применение
Работа с учебниками стр.136
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:

Рисунок – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
§ 18.9. Металлы побочных подгрупп. Медь
Медь известна человеку уже более шести тысяч лет. Латинское название этого металла связано с островом Кипр (отсюда «купрум» — медь), где уже в III в. до н. э. разрабатывались месторождения медных руд и выплавлялась медь.
Нахождение в природе. Медь встречается в природе как в свободном виде (самородная медь), так и в виде соединений. Наиболее известны медный блеск, или халькозин, Cu2S, халькоперит FeCuS2, ковеллин CuS, малахит (СuOН)2СO3 и др. В литосфере на долю меди приходится 0,01% (по массе).
Получение. Основным источником меди служат сульфидные, а также полиметаллические руды. Вначале сульфидную руду обжигают, а затем сплавляют полученный оксид с сульфидом:

Так получают черновую медь, которую далее подвергают рафинированию (очистке от примесей).
Свойства меди. Это металл розовато-красного цвета, очень ковкий, пластичный, с высокой электро- и теплопроводностью.
В химическом отношении медь является малоактивным металлом. В сухом воздухе она устойчива, во влажном покрывается зеленоватым налетом карбоната гидро-ксомеди (II):

С кислородом в зависимости от температуры образует два оксида:

Аналогично медь взаимодействует с серой. С галогенами взаимодействие меди идет уже при комнатной температуре. Например, с влажным хлором образуется хлорид меди (II) СuСl2.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Однако в присутствии кислорода воздуха медь может растворяться в соляной кислоте:

Взаимодействует медь и с азотной и концентрированной серной кислотой:

Медь вытесняет металлы, стоящие правее в ряду напряжений, из солей в растворе:

Применение. Медь применяют для изготовления электропроводов и различных сплавов — бронзы (сплав с оловом), латуни (сплав с цинком), дюралюминия и др. Все медные сплавы обладают высокой стойкостью к атмосферной коррозии.
Соединения меди. Оксид меди (I) Сu2O — твердое вещество красного цвета, в природе встречается в виде минерала куприта. Вам этот оксид известен как продукт восстановления свежеприготовленного гидроксида меди (II) альдегидами и глюкозой:

Гидроксид меди (I) СuOН — промежуточный продукт этой реакции, очень нестойкое соединение:
Оксид меди (II) СuО — твердое вещество черного цвета. Его получают при взаимодействии меди с кислородом, а также при разложении гидроксида меди (II), нитрата меди (II):

Оксид меди (II) — окислитель, он восстанавливается до чистой меди при нагревании с водородом, коксом, оксидом углерода (II), углеводородами, спиртами; последние превращаются при этом в альдегиды или кетоны. Например:

Окисление углеводородов оксидом меди (II) до углекислого газа и воды используется при качественном анализе для определения содержания в них углерода и водорода.
Гидроксид меди (II) Сu(ОН)2 осаждается из растворов солей меди (II) в виде голубой студенистой массы при действии на них щелочей.
Оксиды и гидроксиды меди имеют слабо выраженные амфотерные свойства с преобладанием основных, поэтому легко растворяются в кислотах. Оксиды и гидроксиды меди растворяются в водном растворе аммиака, образуя комплексные соединения: гидроксид диамин-меди (I) [Cu(NH3)](OH)2, гидроксид тетрааминмеди (II) [Cu(NH3)4](OH)2.
Способность металлов побочных подгрупп к образованию комплексных соединений обусловлена возможностью образования химических связей с участием d-электронов и свободных d-орбиталей металлов.
Соединения меди (I) легко окисляются и превращаются в соединения меди (II).
Большинство солей меди (II) хорошо растворимы в воде, но в растворе гидролизованы по катиону, поэтому их растворы имеют кислотную среду. Наиболее известны сульфат, хлорид и нитрат меди (II), которые применяют в гальваническом производстве. Медный купорос CuSO4 • 5Н2) используют в сельском хозяйстве. Минерал малахит, имеющий красивый изумрудно-зеленый цвет, — поделочный материал.
Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зеленых, синих, коричневых, фиолетовых, черных.
Подгруппа меди
Особенности атомных структур элементов побочных подгрупп
В данной главе мы будем рассматривать элементы побочных подгрупп I—VIII группы. Все они являются элементами больших периодов.
Элементы этих подгрупп имеют свои особенности в строении атомов. У элементов главных подгрупп происходит постепенное завершение внешнего электронного слоя, который содержит только s— и р-оболочки. У элементов же побочных подгрупп предвнешний слой находится в процессе завершения, а внешний слой при этом, как правило, сохраняет неизменно 2 электрона. На предвнешнем слое возникает и заполняется d-оболочка, состоящая из 5 d-орбиталей. На каждой орбитали 2 электрона, поэтому заполнение d-орбиталей происходит последовательно у 10 элементов, расположенных по возрастанию порядковых номеров. Элементы побочных подгрупп всех групп, за исключением I и II, принадлежат к числу d-элементов.
Валентными у элементов побочных подгрупп являются электроны, расположенные как во внешнем слое на s-орбиталях, так и на d-орбиталях более глубокого предвнешнего слоя. Таким образом, для этих элементов характерно образование различного числа валентных связей. Легче всего, разумеется, участвуют в образовании химической связи электроны внешнего слоя; их в атоме один или два. Такое строение атома типично для металла, поэтому элементы побочных подгрупп обладают обычно металлическими свойствами.
■ 1 . Начертите схемы строения атомов скандия, титана, ниобия. (См. Ответ)
Укажите электронные конфигурации внешнего и предвнешнего электронных слоев их атомов. Изобразите размещение электронов внешнего и предвнешнего слоев по орбиталям.
2. В чем отличие структуры внешнего электронного слоя атомов элементов главных подгрупп от атомов элементов побочных подгрупп.
3. Какими свойствами должны обладать элементы побочных подгрупп в связи с строением их атомов.
4. Сколько электронов вмещает d-оболочка электронного слоя? (См. Ответ)
Подгруппа меди
Начнем рассмотрение элементов побочных подгрупп с подгруппы меди. К элементам подгруппы меди относятся медь Сu, серебро Ag и золото Аu, расположенные в побочной подгруппе I группы. Распределение электронов по энергетическим уровням у этих элементов приведено в табл. 22.
Радиусы атомов элементов побочной подгруппы значительно меньше радиусов атомов элементов главной подгруппы, поэтому электрон внешнего электронного слоя с большим трудом отрывается от атома. Как видно из табл. 22, эти элементы имеют сходное строение не только внешнего, но и предвнешнего слоя, и мы вправе ожидать от них большого сходства химических свойств.
В табл. 23 приведены физические свойства металлов подгруппы меди.
■ 5. Сравните радиусы атомов щелочных металлов и металлов подгруппы меди тех же периодов. Какой вывод можно сделать?
6. Почему у элементов подгруппы меди электрон внешнего слоя удерживается прочнее, чем в атомах щелочных металлов?
7. К какой группе металлов по плотности следует отнести металлы подгруппы меди? (См. Ответ)
Медь Сu
Химический знак Сu, атомный вес 63,54. Медь — типичный металл, поэтому ее атомы связаны между собой металлической связью. Электронная конфигурация предвнешнего и внешнего электронных слоев меди выглядит следующим образом: 3s 2 3p 6 3d 10 4s 1 .
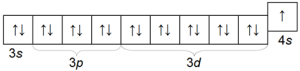
По внешнему виду медь — вещество красного цвета с характерным металлическим блеском. Медь — довольно мягкий металл, однако намного тверже, чем щелочные.
Следует отметить высокую пластичность меди, которую она проявляет не только в нагретом, но и в холодном состоянии. Благодаря своей мягкости и пластичности медь может быть подвергнута холодной обработке. Отсюда широкое использование этого металла для изготовления художественных изделий при помощи чеканки. Не только сама медь, но и все металлы этой подгруппы обладают высокой пластичностью.
Медь что это такое
Один из лучших проводников тепла и электричества, однако для использования ее в этих целях медь обычно хорошо очищают от примесей других металлов, так как даже от незначительных загрязнений ее электропроводность сильно уменьшается.
Химические свойства меди и ее аналогов очень отличаются от свойств щелочных металлов, расположенных в главной подгруппе I группы. Так, они располагаются в ряду напряжений после водорода. Степень окисления меди в окислительно-восстановительных реакциях +1 или +2. Других степеней окисления медь обычно не проявляет.
Медь довольно легко сплавляется с другими металлами, образуя ряд сплавов, наиболее распространенными из которых являются бронза (сплав, состоящий из меди и олова) и латунь (сплав меди и цинка).
При обычной температуре медь постепенно вступает во взаимодействие с кислородом, двуокисью углерода и влагой воздуха, превращаясь в основной карбонат меди. Этот процесс протекает очень медленно и объясняет причину, по которой изделия из меди с течением времени покрываются зеленым налетом.
При прокаливании на газовой горелке медь покрывается черным налетом окиси меди СuО. Нагретая медь довольно легко вступает во взаимодействие с хлором, образуя хлорид меди (II), и с некоторыми другими неметаллами.
С разбавленными кислотами медь обычно в реакции не вступает, так как не может вытеснить водород, но с разбавленной азотной кислотой реагирует без вытеснения водорода, однако с выделением окиси азота. С концентрированными серной и азотной кислотой медь также вступает в окислительно-восстановительную реакцию, которая также протекает без вытеснения водорода. Во всех названных реакциях медь в основном проявляет свою высшую валентность II. Соединения одновалентной меди получить значительно сложнее.
■ 8. Какова электронная конфигурация внешнего и предвнешнего слоя атома меди? (См. Ответ)
9. Перечислите физические свойства меди и укажите, где они находят себе применение.
10. Напишите следующие уравнения реакций, характеризующих химические свойства меди: а) взаимодействие с кислородом; б) взаимодействие с хлором; в) взаимодействие с водой, кислородом и двуокисью углерода воздуха; г) с концентрированными серной и азотной кислотами; д) с разбавленной азотной кислотой.
Все уравнения рассмотрите с точки зрения окислительно-восстановительных процессов. Если реакция ионная, запишите уравнение в полной и сокращенной ионной форме.
11. Для получения медного купороса CuSO4-5H2O медный лом прокаливают на воздухе и получившийся продукт обрабатывают 70% серной кислотой. Сколько меди и раствора серной кислоты израсходуется на получение 125 т медного купороса? Напишите уравнения протекающих при этом реакций.
12 Приведите все известные вам способы получения хлорида меди (II), сульфата меди (II), нитрата меди (II), исходя из чистой меди. Уравнения реакций записывайте в ионной форме, а в окислительно-восстановительных указывайте окислитель и восстановитель. Для реакций можно использовать дополнительно любые вещества. Процессы можно вести с любым количеством промежуточных веществ.
13. Почему металлическую медь можно получить электролизом раствора хлорида, а металлический натрий — нельзя. (См. Ответ)
Соединения меди
Медь образует два ряда соединений—соединения двухвалентной и одновалентной меди.
Соединения двухвалентной меди — это СuО (окись меди), гидроокись меди и наиболее распространенные соли.
Окись меди представляет собой твердое вещество черного цвета, поступает в лаборатории в виде порошка или гранул (гранулированная окись меди). Ее получают обычно из металлической меди путем прокаливания на воздухе, а также разложением солей, например:
Cu2(OH)2CO3 = 2CuO + Н2O + CO2
Окись меди — основной окисел, при обычных условиях весьма устойчивый. При небольшом нагревании окись меди довольно легко восстанавливается водородом или углеродом до металлической меди:
СuО + С = Сu + СО СuО + Н2 = Сu + Н2O
С водой окись меди никогда не реагирует, поэтому соответствующее ей основание — гидроокись меди Си(ОН)4— никогда не образуется путем взаимодействия окисла с водой. Гидроокись меди — слабое нерастворимое основание, легко вступает во взаимодействие с кислотами с образованием солей:
Сu(ОН)2 + H2SO4 = CuSO4 + 2Н2O
Cu(OH)2 + 2Н + + SO 2- = Cu 2+ + SO 2 4 — + 2H2O
Cu(OH)2 + 2H + = Cu 2+ + 2H2O
Взаимодействие со щелочами при некоторых условиях возможно, но совершенно нетипично, хотя и свидетельствует об очень слабо выраженных амфотерных свойствах. Гидроокись меди легко растворяется в аммиаке, образуя раствор ярко-синего цвета. Этот раствор нередко применяется в органической химии для разного рода качественных реакций, а также иногда для обработки целлюлозы.
Гидроокись меди легко разлагается даже при простом хранении на воздухе:
Cu(OH)2 = СuО + Н20
При этом она чернеет, превращаясь постепенно в черную окись меди.
Из солей меди наиболее распространены медный купорос CuSO4 · 5H2O, хлорид меди СuСl2 · 2Н2O, нитрат меди Cu(NO3)2 · 3H2O, сульфид меди CuS. Кристаллогидраты медных солей при нагревании довольно легко отдают кристаллизационную воду, теряя свою окраску. Обычно кристаллические медные соли и их растворы имеют красивую голубую окраску. Медные соли используют для борьбы с сельскохозяйственными вредителями, в текстильной промышленности для изготовления красителей.
В природе медь встречается в виде минерала — самородной меди, однако чаще ее добывают в виде сульфидов (важнейшие—халькозин Cu2S, халькопирит CuFeS2 ит.д). Полученную из них медь очищают электролизом (рафинируют), а затем используют для изготовления проводов медных сплавов и других изделий.
■ 14. Как осуществить ряд превращений: (См. Ответ)
Сu → Cu(NO3)2 → CuO → Cu(OH)2 → CuSO4 → CuCl2.?
15. Окись меди прокалили в токе водорода, затем обработали концентрированной азотной кислотой до прекращения выделения бурого газа, далее, добавив щелочи, получили студенистый голубой осадок. Какие химические процессы происходили? Напишите их уравнения в молекулярной и ионных формах.
16. Даны окись меди, вода, серная кислота, нитрат серебра. Как, не имея других веществ, получить медь, нитрат меди, сульфат меди.
17. Смесь карбоната и нитрата меди подвергли прокаливанию. Что останется в реакционном сосуде после прокаливания? Каков состав выходящей смеси газов?
18. Смесь меди с окисью меди обработали 30% азотной кислотой. При этом выделилось 2,8 л окиси азота. Известно, что в составе смеси медь составляет 40% Какой объем раствора азотной кислоты был израсходован на реакцию? (См. Ответ)
Серебро и золото
Серебро Ag и золото Аu — аналоги меди, но относятся к числу так называемых благородных металлов. Такое название возникло из-за того, что эти металлы обладают значительной химической стойкостью к окислению.
Электронные конфигурации внешних и предвиешних слоев атомов серебра и золота:
Ag 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Au 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1 .
Серебро и золото — наиболее ковкие металлы, причем на первом месте по мягкости и ковкости стоит золото, а серебро — на втором. Однако по электро- и теплопроводности на первом месте находится серебро. Цвет у этих металлов различный. Серебро белого цвета, а золото — желтого.
Как уже было сказано, серебро и золото устойчивы к окислению и длительное время могут сохраняться, не изменяя внешнего вида. В связи с этим, а также благодаря мягкости они легко шлифуются, полируются и потому используются для разного рода поделок и украшений. Золото применяют в стоматологии для изготовления зубных коронок. Серебро также используют в медицине для изготовления некоторых инструментов. Гораздо чаще, чем чистые металлы, применяют их сплавы с медью, обладающие антикоррозийной стойкостью, но благодаря меди — большей твердостью и лучшими механическими свойствами.
Несмотря на сравнительную химическую устойчивость, серебро и золото могут подвергаться воздействию некоторых реактивов. Серебро, например, может реагировать с азотной кислотой, как с разбавленной, так и с концентрированной:
Ag + HNО3 → (Ag +1 ; N +4 ) (конц.)
Ag + HNО3 → (Ag +1 ; N +2 ) (разб.)
а также с концентрированной серной кислотой:
Ag + H2SО4 → (Ag +1 S +4 )
• Продукты реакции определите сами и найдите коэффициенты на основе электронного баланса.
Золото не реагирует с азотной кислотой. Отсутствие реакции при испытании золотого предмета азотной кислотой является подтверждением его состава. Однако смесь концентрированных азотной и соляной кислот под названием «царская водка» окисляет золото (см. § 72).
Ионы серебра Ag+1, попадая в раствор даже в ничтожно малых количествах, оказывают бактерицидное действие. Именно поэтому, например, очень долгое время может сохраняться так называемая «святая вода», которую священнослужители держат в серебряной посуде.
Из окислов следует отметить окись серебра Ag2О — вещество черного цвета, растворимое в аммиаке и проявляющее окислительные свойства особенно по отношению к некоторым органическим веществам.
Галогениды серебра, кроме фторида, в воде нерастворимы и несколько различаются между собой по цвету: хлорид — белый, бромид — желтоватый, иодид — желтый. Хлорид легко растворим в аммиаке. Бромид серебра особенно чувствителен к свету, как уже говорилось в § 42. Нитрат серебра AgNО3 широко применяется в химических лабораториях, а также в медицине в виде так называемого ляписа.
Соединения золота не имеют особого практического значения, поэтому мы на них останавливаться не будем.
В природе золото встречается в основном в самородном состоянии в виде песка, самородков. Серебро чаще всего встречается в виде сульфида Ag2S, получившего название «серебряный блеск». Соединения серебра часто сопутствуют другим металлам — меди, свинцу, сурьме и др.
■ 19. Почему при лечении зубов применяют в основном серебро и золото? (См. Ответ)
20. Почему серебро и золото причисляют к благородным металлам? Перечислите возможно более полно физические свойства этих металлов
21. Объясните процесс растворения золота в «царской водке» и напишите уравнения реакций.
22. Перечислите области применения серебра и золота. (См. Ответ)
Статья на тему Подгруппа меди
Похожие страницы:
ПОДГРУППА МЕДИ Элемент Символ Атомный вес Порядковый номер Распределение электронов по слоям Медь Сu 63,54 29 2 8 18 1 .
Содержание статьи1 ЧТО ТАКОЕ КИСЛОТНЫЙ АФФИНАЖ БЛАГОРОДНЫХ МЕТАЛЛОВ1.1 Способ д’Арсе1.2 Аффинаж благородных металлов царской водкой ЧТО ТАКОЕ КИСЛОТНЫЙ АФФИНАЖ БЛАГОРОДНЫХ.
СВОЙСТВА СЕРЕБРА И ЗОЛОТА Золото и cеpeбpo — металлы соответственно желтого и белого цвета Они имеют гранецентрированную кубическую решетку, отличаются.
Что такое сульфат меди Медный купорос, медная соль серной кислоты. Белое, прозрачное неорганическое вещество (Безводное). Находясь на воздухе поглощает влагу.
Свойства меди это сходство по свойствам с предшествующими ей переходными металлами третьего периода — кобальтом, никелем и последующим цинком. Однако.
ЦИАНИРОВАНИЕ СЕРЕБРА Одним из самых больших методов получения серебра из его руд где серебро находится в самородном состоянии считается метод.
Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Конспект урока "Металлы побочных подгрупп"
Цель: Повторить и обобщить знания о металлах на примере металлов представителей побочных подгрупп (меди, железа, хрома); углубить знания об их свойствах и применении.
Образовательная : Изучить строение, свойства и применение металлов побочных подгрупп
Развивающие : 1. Создать условия для развития логического мышления через сравнение и установление взаимосвязи строения и свойств веществ с учетом зоны ближайшего развития 2. Формирование умений переносить полученные знания в новую ситуацию
Воспитательные: 1. Формирование научного мировоззрения через познаваемость химических явлений 2. Формирование умений осуществлять самоконтроль хода и результатов своего труда 3. Развитие коммуникативности личности
Планируемые результаты:
Знать строение атома, физические и химические свойства, получение и применение металлов побочных подгрупп.
Уметь составлять электронные формулы атомов металлов побочных подгрупп на примере меди, железа, хрома; записывать уравнения реакций, характеризующих химические свойства, способы получения.
Тип урока: изучение нового материала
Оборудование: компьютер, мультимедийный проектор, карточки с тестами, коллекция «Металлы», периодическая система химических элементов.
I .Организационный момент.
II .Актуализация опорных знаний
Устный опрос по пройденному материалу:
Прежде, чем мы приступим к изучению нового материала вспомним материал прошлого занятия. Постарайтесь ответить на вопросы.
- В какой части Периодической системы в основном расположены металлы?
Ответ: в левой нижней части таблицы
- Что общего в физических свойствах всех металлов?
Ответ: высокая электрическая проводимость, теплопроводность, ковкость, пластичность
- По каким характерным физическим свойствам металлы в значительной степени отличаются друг от друга?
Ответ: по плотности, твердости, температуре плавления
- Назовите самый легкий и самый тяжелый металл
Ответ: самый легкий литий, тяжелый осмий
- У какого из металлов самая низкая и самая высокая температура плавления?
Ответ: ртуть –38,9 ; вольфрам 3390
- Какие металлы мы изучали на последнем занятии?
Ответ: металлы главных подгрупп
- Назовите несколько металлов главных подгрупп
Ответ: литий, натрий, калий, магний, кальций и др.
- Назовите общее химическое свойство металлов главных подгрупп
Ответ: это их способность легко отдавать валентные электроны вследствие гораздо большего атомного радиуса по сравнению с неметаллическими элементами, поэтому являются восстановителями
III .Самоопределение к деятельности
- На сегодняшнем занятии мы познакомимся с еще одной группой металлов, среди которых наибольшее практическое значение имеют: медь, цинк, титан и железо
- Возникает вопрос, почему эти металлы изучаются отдельно?
Чтобы ответить на этот вопрос – выясните в чем отличие в расположении этих элементов в таблице Менделеева от ранее изученных металлов?
Ответ: эти металлы находятся в побочных подгруппах
Ответ: «Металлы побочных подгрупп»
- Какие цели вы ставите перед собой на уроке?
Ответ: узнать, изучить строение, свойства и применение металлов побочных подгрупп
- Давайте вместе обсудим план работы на сегодняшнем занятии. Предложите свои пункты плана по которому можно будет достичь вашей цели на уроке.
Ответ: предлагают изучить строение, физические, химические свойства и т.д
1) Исторические данные
2) Строение атома
3) Физические свойства
4) Химические свойства
В течении урока, вам необходимо будет сделать краткий конспект - записать необходимые данные, которые вы узнаете на занятии.
- Ответьте на вопрос: «Для чего, где вам пригодятся знания полученные на сегодняшнем уроке?»
IV. Изучение нового материала
б) Строение атома
– Электронное строение атомов меди, железа, хрома
Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).

в) Физические свойства меди, железа, хрома
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Медь — довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло - и электропроводностью . Tплавл= 10830С. ρ = 8,96г/см3. СО: 0,+1,+2
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. Tплавл=15390С. ρ = 7,87г/см3.
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С
г) Химические свойства меди, железа, хрома
Химические свойства меди
I. Взаимодействие с простыми веществами.
1. При высокой температуре взаимодействует с кислородом: 2Cu + O2 2CuO
2. Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 CuCl2
II. Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3( разб .) → 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3( конц .) → Cu(NO3)2 + 2NO2↑+ 2H2O
Cu + 2H2SO4( конц .) → CuSO4 + SO2↑+2H2O
Химические свойства железа
1. Горит в кислороде, образуя окалину - оксид железа (II, III): 3Fe + 2O2 → Fe3O4
2. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 2FeBr3
1. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O Fe3O4 + 4H2 ↑
2. На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
3. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4( разб .) → FeSO4 + H2↑
4. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H2SO4( конц .) Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3( конц .) Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
Химические свойства хрома
1. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом , кремнием, бором, серой, фосфором.
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
1. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Получение меди
1. Восстановлением из оксидов углём или оксидом углерода (II): CuO + C Cu + CO
CuO + CO Cu + CO2
2. При электролизе солей меди: 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Получение железа
1. Восстановлением из оксидов углём или оксидом углерода (II)
Fe2O3 + 3CO 2Fe + 3CO2
Получение хрома
1. Алюминотермия: Cr2O3 + 2Al Al2O3 + 2Cr
2. Восстановлением оксидов хрома оксидом углерода (II), водородом :
CrO + Н2 Cr + H2O
е) Применение меди, железа, хрома
V .Закрепление
– Напишите электронное строение атома меди
– Допишите уравнения реакций:
а) Fe + O 2 ® б) Cr + H 2 SO 4 ® в) Cu + Cl 2 ®
Тест по теме урока
1) Электронная формула 1s 2 2s2 2p6 3s2 3p6 3d2 4s2 принадлежит:
а) Zn б) Ti в) Cu г) Fe
2) Определите металл по следующим данным: светло-розовый цвет, тягучий, вязкий, легко прокатывается. Температура плавления 1083 o С. По проводимости электрического тока уступает лишь серебру.
3) Степень окисления железа в формуле Fe2O3:
а) –2 б) + 4 в) + 2 г) + 3
4) Металлические свойства в ряду Ti ® Cr ® Fe:
а) уменьшаются б) увеличиваются в) не изменяются г) изменяются периодически
5) В схеме превращений Cr → CrCl 3 → Cr ( OH )3
веществами x и y могут быть соответственно
а) Cl 2 , H 2 O б) Cl 2 , NaOH в) NaCl , KOH г) HCl , KOH
VI .Итог урока.
VII .Рефлексия.
Какая цель была на уроке _________________
Достиг ли ты поставленной цели ____________
Что тебе помогло достичь цели? _______________
Я узнал на уроке _____________
Я не согласен _____________
На уроке столкнулся со следующими трудностями ___________
Поставьте себе оценку за урок _______
VIII . Домашнее задание: изучить § 28
Выполните одно из трех заданий по своим возможностям
«3» - Допишите уравнения: а) Fe+ Cl2 ® б) Ti(IV) + O2 ® в) Zn + HNO3 ®
«4» – Напишите уравнения реакций по схеме: Zn ® ZnO ® ZnSO4 ® Zn(NO3)2
«5» – Напишите уравнения реакций по схеме, заменив «X» и «Y» соответствующей формулой: Fe(III) ® «X» ® «Y» ® Fe2O3
Читайте также:
