Металлы с оксидной пленкой
Обновлено: 17.05.2024
Свойства анодных оксидных пленок в основном определяются их строением и фазовым составом, т.е. структурой. Наблюдениями с помощью обычного оптического микроскопа было установлено, что утолщенные пленки являются пористыми и имеют волокнистую структуру. В зависимости от состава используемого электролита диаметр пор может колебаться в пределах нескольких сотен ангстрем, а их количество может доходить до 10 8 на квадратный сантиметр поверхности пленки.
Применение электронного микроскопа позволило построить идеализированную модель структуры оксидной пленки пористого типа. Келлер и ряд последователей по рельефу поверхности металла, с которого удалена пленка, установили, что оксид состоит из гексагональных ячеек, имеющих форму граненых карандашей, плотно прижатых друг к другу. Если у этих “карандашей” удалить грифели, то образуются поры, которые заполняются электролитом во время формовки оксида. Идеализированная структура по Келлеру в настоящее время принимается за основу и приводится во всех монографиях.
Установление фазового состава стало возможным благодаря применению методов электроно- и рентгенографии, а также инфракрасной спектроскопии. Было установлено, что анодная оксидная пленка может быть аморфной или кристаллической, а иногда содержания и ту и другую фазы. Обнаружено также, что пористость кристаллического анодного оксида может на два порядка превышать пористость пленки.
Способность оксидных пленок предохранять металл от воздействия окружающей среды была обнаружена сразу после открытия процесса анодирования. Анодное окисление металлов стало одним из методов защиты от коррозии в машиностроении и электронной промышленности. Первоначально от защиты от коррозии применялись только тонкие плотные пленки. В настоящее время стали применятся и пористые покрытия, так как они после уплотнения и наполнения не только повышают свои коррозионно-защитные свойства, но и приобретают декоративный вид.
Для оценки коррозионной стойкости часто применяются ускоренные испытания пробой ВИАМ, разработанной во Всесоюзном институте авиационного машиностроения (отсюда ее название). При этом капля пробы наносится на испытываемую анодированную поверхность и измеряется время, в течение которого она разъедает пленку до металла. Результат обнаруживается по изменению цвета капли, когда начинается реакция пробы с металлом.
К электрофизическим свойствам относятся сопротивление электрическому току, диэлектрическая проницаемость, тангенс угла диэлектрических потерь и электрическая прочность. Они достаточно хорошо изучены и отражены практически во всех монографиях, посвященных анодным покрытиям.
Применение оксидных пленок в качестве изоляции обусловлено их высоким сопротивлением электрическому току и большой механической прочностью. Основным преимуществом оксидной изоляции является то, что она сохраняет свои свойства при повышенных температурах. Электрическая прочность, т.е. пробивное напряжение при данной толщине, у разных пленок зависит от многих факторов. Чем плотнее пленка, тем выше ее электрическая прочность. Даже пористые пленки имеют электрическую прочность на порядок выше, чем у воздуха.
Наличие в оксидной пленке пор приводит к тому, что ее эффективная диэлектрическая проницаемость может изменяться в широких пределах при изменении свойств окружающей среды. Это влияние, связанное с конденсацией паров воды в порах пленки, используется при создании датчиков влажности.
Анодные оксидные пленки по своим механическим свойствам относятся к разряду веществ высокой твердости. Особенно большой твердостью обладают пленки оксида алюминия. Обычно для оценки механической прочности оксидной пленки измеряют ее микротвердость на поперечных шлифах. С помощью прибора ПМТ – 3 при небольших нагрузках (обычно 50 гс) установлено, что твердость пористой пленки постепенно убывает при удалении от металла к поверхности оксида. Кроме микротвердости механическую прочность оценивают по сопротивлению истирания к информационным нагрузкам. Исследование износостойкости производится на рабочих поверхностях деталей, используемых в парах трения. Хорошие результаты были получены при анодировании зубчатых колес из алюминиевых сплавов. При анодировании наблюдается не только повышение прочности, но и улучшение антифрикционных свойств, так как оксидный слой легко полируется и становится гладким и твердым.
Коррозия металлов и способы защиты от нее
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Пленки на металлах
У большинства металлов при взаимодействии с окислителями поверхность покрывается пленкой окислов.
Адсорбция окислителя на металле
Когда металл попадает в коррозионную среду, начальной стадией их взаимодействия является адсорбция окислителей (CO2, H2O, O2, Cl2, SO2) на поверхности металла. Между атомами металла и окислителем сразу возникает сильная ионная связь – атом металла передает атому кислорода два электрона. Атом кислорода находится под воздействием поля, которое создают атомы металла. На поверхности металла адсорбируется окислитель, при этом внутренняя поверхность образовавшейся адсорбционной пленки заряжена положительно, а внешняя – отрицательно.
Распределение атомов окислителя на поверхности металла очень сильно зависит от расположения на поверхности атомов металла.
Поверхность металла заполняется хемосорбированным окислителем почти мгновенно и образуется тонкий слой окисляющего вещества. При пониженных температурах после хемосорбированного окислителя за счет ванн-дер-ваальсовых сил может возникнуть и физическая адсорбция молекул окислителя.
Образование продуктов коррозии
Если между металлом и окислителем есть химическое сродство (окисел термодинамически стабильный), то пленка, состоящая с хемосорбированного окислителя, превращается в окисную пленку. Металл и окислитель в окисной пленке поддерживают ионную связь.
Продукты коррозии – химические соединения, которые образовались в результате химического взаимодействия металла и некоторых компонентов окружающей среды. Продукты коррозии формируют на поверхности металла пленку, которая может обладать защитными свойствами, затрудняя подход окислителей. Данный процесс протекает с самоторможением во времени.
Пленки продуктов коррозии очень сильно влияют на жаростойкость металлов, поэтому необходимо изучить их свойства, закономерности роста и влияние на них различных внешних и внутренних факторов.
Классификация по толщине пленок на металлах
По толщине оксидной пленки на металлах их принято разделять на три группы: толстые, тонкие, средние.
Тонкие оксидные пленки невидимы для человека невооруженным глазом. Их толщина составляет до 400 Å.
Средние оксидные пленки в толщину достигают от 400 до 5000 Å и дают цвета побежалости.
Толстые оксидные пленки хорошо видны на поверхности металла. Их толщина составляет свыше 5000 Å. Иногда они могут быть достаточно толстыми, как, например, окалина на поверхности стали.
От защитных свойств оксидных пленок зависит жаростойкость металла, законы роста толщины пленки во времени и многое другое.
При образовании окисной пленки устанавливается скорость окисления металла, которая может изменяться во времени. По этому судят о защитных свойствах окисных слоев. Также защитные свойства оксидной пленки определяют в лабораторных условиях капельным методом. На ее поверхность наносят подходящий для данного случая реагент и определяют время его проникновения к основному металлу.
Оксидные пленки металлов. Устойчивость оксидных - коррозионных пленок (ржавчин) на поверхностях металлов. Отношение объемов оксида и металла для металлов. Линейные коэффициенты теплового расширения металлов и их оксидов.
Оксидные пленки металлов. Устойчивость оксидных - коррозионных пленок (ржавчин) на поверхностях металлов. Отношение объемов оксида и металла для металлов. Линейные коэффициенты теплового расширения металлов и их оксидов.
Таблица. Отношение объемов оксида и металла для некоторых металлов. Что происходит с объемом металла при окислении (коррозии). Меняет ли (увеличивает или уменьшает) ржавчина (оксидная пленка) объем металла, металлической детали. Защитные свойства оксидных пленок.
Очевидно, что при Vоксида/Vметалла >1 пленка оксида получается сплошной а при Vоксида/Vметалла < 1 - нет.
| Металл | Оксид | Vоксида/Vметалла | Металл | Оксид | Vоксида/Vметалла | Металл | Оксид | Vоксида/Vметалла |
| Li - Литий | Li2O | 0,57 | Cd - Кадмий | CdO | 1,27 | Mo - Молибден | MoO2 | 2,18 |
| Na - Натрий | Na2O | 0,59 | U - Уран | UO2 | 1,96 | Mo | MoO3 | 3,45 |
| K - Калий | K2O | 0,48 | U | U2O3 | 3,12 | W - Вольфрам | WO2 | 1,86 |
| Mg - Магний | MgO | 0,79 | Al - Алюминий | Al2O3 | 1,31 | W | WO3 | 3,36 |
| Ca - Кальций | CaO | 0,63 | Ti - Титан | TiO2 | 1,76 | Fe - Железо | FeO | 1,77 |
| Sr - Сурьма | SrO | 0,66 | Zr - Цирконий | ZrO2 | 1,60 | Fe | Fe3O4 | 2,09 |
| Ba - Барий | BaO | 0,73 | Sn - Олово | SnO2 | 1,33 | Fe | Fe2O3 | 2,14 |
| Cu - Медь | Cu2O | 1,67 | Pb - Свинец | PbO | 1,15 | Co - Кобальт | CoO | 1,75 |
| Cu | CuO | 1,74 | Nb - Ниобий | NbO | 1,57 | Co | Co3O4 | 2,00 |
| Ag - Серебро | Ag2O | 1,58 | Nb | Nb2O3 | 2,81 | Co | Co2O3 | 2,42 |
| Be - Беррилий | BeO | 1,67 | Ta - Тантал | Ta2O5 | 2,32 | Ni - Никель | NiO | 1,52 |
| Zn - Цинк | Zno | 1,58 | Cr - Хром | Cr2O3 | 2,02 | Pt - Платина | PtO | 1,56 |
Таблица. Линейные коэффициенты теплового расширения αt = dl /ldt металлов и их оксидов. Устойчивость оксидных пленок на металлах при нагревании и охлаждении. Сохряняется ли ржавчина (оксидная пленка) на металлах при изменении температуры.
| Металл | αt *10 6 ,град -1 | Оксид | αt *10 6 ,град -1 |
| Al | 22,9 | Al2O3 | 8,0 |
| Be | 16,8 | BeO | 9,5 |
| Ca | 22 | CaO | 13,7 |
| Cr | 8,1 | Cr2O3 | 9,6 |
| Сu | 16,6 (31 для монокристалла ) | CuO | 5-10 (3 для -200°C) |
| Fe | 11,2 | FeO | 13,4 |
| Mg | 25,1 | MgO | 15,7 |
| Mn | 21,6 | MnO | 11,0 |
| Ni | 12,4 | NiO | 12,6 |
| Si | 3,6 | SiO2 | 4,3 |
| Sn | 20,3 | SnO2 | 4 |
| Th | 12,3 | ThO2 | 9,7 |
| Ti | 8,4 | TiO2 | 8,2 |
| U | 14,5 | UO2 | 10,0 |
| Zr | 5 | ZrO2 | 8,0 |
- *Источники: в основном, но не только:
- Семенова И.В., Флорианович Г.М., Хорошилов А.В. Коррозия и защита от коррозии. Физматлит 2006.
- Авдеенко А.П., Поляков А.Е., Юсина А.Л., Гончарова С.А. Коррозия и защита металлов. ДГМА, 2004.
- Size Effect of the Thermal Expansion of Nanostructural Copper Oxide I.B. Krynetski, B.A. Gizhevsk, S.V. Naumov, E.A. Kozlov, 2008 Fizika Tverdogo Tela
Дополнительная информация от Инженерного cправочника DPVA, а именно - другие подразделы данного раздела:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.Оксиды на поверхности металлов, механизм их образования и роста. Сравнительная характеристика физической и химической стойкости оксидов
В атмосферных условиях металлы покрыты оксидными пленками. Первично образующаяся на металле оксидная пленка может иметь аморфную или кристаллическую структуру. Например, в случае окисления алюминия при комнатной температуре образуется аморф-ная пленка толщиной 20¸45Å, которая при нагреве становится кри-сталлической. Первичная пленка на железе меди, цинке с самого на-чала имеет кристаллическое строение. Образование аморфных или кристаллических первичных оксидных пленок зависит не только от физико-химической природы окисляемого металла, но и от условий ее образования, в основном от температуры.
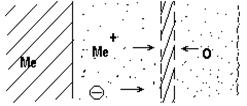
При комнатной температуре в атмосфере воздуха вначале окисление металла идет быстро, но при достижении определенной толщины пленки процесс окисления практически заканчивается. Так, при окислении меди приблизительно через 2 часа толщина пленки достигает 24Å, а затем почти не изменяется. После образования первичной пленки дальнейшее окисление определяется скоростью диффузии через нее металла и кислорода. При диффузии металла зоной роста является внешняя поверхность оксидной пленки. При диффузии кислорода зоной роста является граница металл-оксидная пленка. При соизмеримых скоростях встречной диффузии металла и кислорода зона роста находится внутри оксидной пленки. Схема роста оксидной пленки в этом случае представлена на рис. 1
![]()
Рис. 1 – Схема роста оксидной пленки при соизмеримых скоростях встречной диффузии металла и кислорода
Так как оксидные пленки на металлах имеют кристаллическую структуру, обладающую ионной, а также электронной проводимостью, то при диффузии через пленку перемещаются не непосредственные атомы металла, а ионы и свободные электроны. Это не исключает возможности атомной диффузии, но поскольку радиусы ионов металлов значительно меньше атомов, то можно предположить, что основной диффузионный поток от металла будет состоять из их ионов. Кислород же проникает внутрь оксидной пленки в виде атомов, а не ионов, т.к. размер атомов кислорода в два с лишним раза меньше радиуса иона кислорода.
В процессе образования оксидных пленок закон их роста может быть различным, что в основном определяется соотношением объема оксида Vокк объему металла Vм, из которого он образовался. Например, это отношение для некоторых металлов имеет следующее значение:
Mg – 0,35 Zn – 1,57 Ni – 1,64
Sn – 1,31 Cu – 1,71 W – 3,50
Al – 1,38 Fe – 1,78
= k, (1)
где y – толщина оксидной пленки;
t– время окисления;
k – константа.
После интегрирования зависимости (4.1) получим
y = kt + A(2)
Линейный характер роста пленки устанавливается через некоторое время после начала окисления, когда пленка достигает критической величины. Это наблюдается на щелочных и щелочноземельных металлах, а также на таких металлах как ванадий, молибден, вольфрам, образующих оксиды, легко испаряющиеся при нагреве.
y 2 = kt + A(3)
Для некоторых металлов рост пленки можно описать зависимостью
y n = kt + A (4)
(Частный случай – кубическая парабола при n = 3)
Иногда наблюдается логарифмическая зависимость роста оксидной пленки.
y = ln(kt)(5)
Скорость роста оксидной пленки в процессе окисления зависит от температуры. С повышением температуры скорость увеличивается в соответствии с зависимостью
= Ае – Q / RT ,(6)
где Q – энергия активации процесса;
R – газовая постоянная;
T – абсолютная температура.
Следует отметить, что рассмотренные закономерности роста оксидной пленки соблюдается лишь для чистых металлов. Наличие даже следов примесей может сильно изменить свойства поверхности металла и характер реакций его с кислородом.
Образующиеся на металлах в результате окисления пленки делятся на тонкие, средние и толстые. Тонкими принято считать невидимые пленки от мономолекулярных до 400Å, средними от 400 до 5000Å и толстыми – выше 5000Å (0,5 мкм). В процессе пайки металлов большое значение имеют не только толщины, но и свойства оксидных пленок. Плотные, прочно связанные с металлом оксидные пленки труднее удалить с поверхности металла, что осложняет процесс пайки. Чем менее компактна оксидная пленка, чем слабее ее связь с металлом и, чем менее устойчива она при нагреве, тем меньше затруднений возникает в процессе удаления ее при пайке.
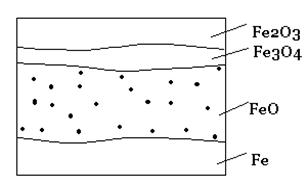
При окислении железа кислородом возможно образование разных соединений в соответствии с диаграммой состояния железо-кислород. Оксидная пленка на железе обычно имеет четко выраженный слоистый характер. На границе с металлом образуется монооксид железа FeO, соответствующая наименьшему содержанию кислорода в оксиде, затем следует промежуточный слой монооксида-оксида железа Fe3O4 и на внешней поверхности пленки – высший оксид Fe2O3. Предполагается, что поверхностный слой металла, находящийся под оксидной пленкой, содержит некоторое количество кислорода в виде твердого раствора с металлом.
Прилегающий к металлу слой монооксида железа FeO (вюстит) имеет кубическую кристаллическую решетку по типу каменной соли. FeO устойчив только при температурах выше 570 0 С. При более низких температурах он не образуется, а при медленном охлаждении распадается с выделением металла по реакции:
4FeO Þ Fe + Fe3O4
При температуре 1377 0 С монооксид железа плавится.
Монооксид-оксид железа Fe3O4 (магнетит) имеет кристалличесую кубическую решетку. Магнетит кристаллографически является самостоятельной фазой, а не молекулярной смесью монооксида и оксида железа. Он устойчив при всех температурах, начиная от комнатной и до точки плавления железа. При нагреве в окислительной среде магнетит переходит в оксид железа a-Fe2O3. Этот переход совершается в две стадии. При нагреве до температуры 220 0 С образуется промежуточная структура оксида g- Fe2O3 с сохранением кубической шпинельной решетки. Двухвалентное железо при этом превращается в трехвалентное:
![]()
При дальнейшем нагреве до 400-500 0 С оксид теряет магнитные свойства и образуется решетка оксида железа a- Fe2O3.Рис. 2 – Микроструктура оксидной пленки на железе (схема)
Оксид железа Fe2O3 (гематит) имеет ромбоэдрическую структуру. Гематит устойчив в широком интервале температур, но при нагреве выше 1100 0 С частично разлагается. При температуре плавления железа гематит полностью диссоциирует на железо и кислород.
При окислении меди образуются три вида оксидов – монооксид меди Cu2O, оксид меди CuO и полуторный оксид меди Cu2O3. Имеются также предположения об образовании в интервале 950-1050 0 С соединения типа недооксида Cu4O. Окисление меди начинается с адсорбции газа на ее поверхности. При комнатной температуре на воздухе происходит образование оксида меди, кристаллизующегося в кубической решетке. Кристаллическая решетка оксида меди ориентирована так, что ребра и грани кубической решетки Cu2O лежат параллельно и граням кубической решетки меди.
Нагрев меди выше 250 0 С вызывает более интенсивное окисление, при этом пленка состоит из смеси оксида и монооксида меди. Рост пленки происходит по диффузионному механизму; предполагают, что при повышенных температурах через пленку диффундируют ионы меди, имеющие малый размер. При 300 0 С и выдержке 5÷10 мин в атмосфере воздуха медь покрывается цветами побежалости.
Наряду с монооксидом меди при окислении также образуется полуторный оксид меди, который, как и монооксид, имеет красный цвет. Кристаллическая решетка его соответствует решетке монооксида меди и отличается от последней только удельной проводимостью. Полуторный оксид меди неустойчив, он начинает разлагаться при 75 0 С. При 400 0 С разложение происходит по уравнению
В интервале 400 – 500 0 С и выдержке 5¸15 мин окисная пленка на меди двухслойная. К металлу примыкает монооксид меди, верхний более тонкий слой состоит из оксида меди, имеющий почти черный цвет. Оксидная пленка в интервале 600 – 800 0 С имеет мелкокристаллическую структуру и плохую связь с металлом. Выше 800 0 С образовавшийся оксид меди разлагается по уравнению
4 CuO Þ 2 Cu2O + O2
В интервале 800 – 950 0 С пленка состоит только из монооксида меди. Этот интервал характерен несколько более прочной связью пленки с основным металлом. При 950¸1050 0 С оксидная пленка приобретает ярко малиновый цвет, что связано, по-видимому, с образованием соединения Cu4O. Оксидная пленка в этом интервале имеет крупнокристаллическую структуру и наиболее прочно держится на металле.
Алюминий при взаимодействии с кислородом при комнатной температуре окисляется с образованием первичной оксидной пленки толщиной 40¸100 мкм. Дальнейшее окисление алюминия тормозится, т.к. образовавшаяся пленка надежно изолирует металл от кислорода. Для оксида алюминия известны модификации a, b, g и др. Наряду с оксидом алюминия известны оксиды состава Al2O – недооксид алю-миния и AlO – субоксид алюминия, существующие при высоких температурах. Первоначально образующийся на поверхности алюми-ния оксидный слой в атмосферных условиях представляет собой аморфное образование. Умеренное нагревание этого слоя до темпе-ратуры выше 200 0 С приводит к возникновению модификации g- Al2O3. В результате взаимодействия с влагой воздуха в оксидной пленке на поверхности алюминия могут образовываться гидрооксиды.
Применяемые в качестве припоев металлы и сплавы также имеют на своей поверхности оксидную пленку. Нагрев под пайку при недостаточной защите может вызывать дальнейшее окисление припоя. Наличие на поверхности припоя в процессе пайки оксидной пленки приводит к ухудшению условий пайки и свойств паяных соединений. Поэтому для получения качественных паяных соединений необходима очистка припоя перед пайкой и надежные условия удаления оксидов в процессе пайки.
В зависимости от состава припои имеют различную окисляемость. Наибольшей стойкостью при высоких температурах отличаются припои на основе никеля.
При легировании основы паяемого металла или припоя легирующие элементы по-разному могут влиять на образование оксидной пленки. Скорость окисления металла может или уменьшаться или увеличиваться. Если легирующие элементы обладают меньшим сродством к кислороду по сравнению с основным металлом, то они обычно остаются под оксидной пленкой в неокисленном состоянии.
На основе анализа состава и строения оксидных пленок можно видеть, что даже при самых благоприятных условиях окисления чистых металлов и сплавов в атмосфере воздуха образующиеся пленки имеют толщину более 20Å. Силы взаимодействия атомов металлов между собой практически исчезают на расстояниях более 10 ангстрем, поэтому обеспечить взаимодействие паяемого металла и расплавленного припоя при наличии на их поверхности оксидных пленок невозможно. Следовательно, металлы необходимо тщательно очищать от оксидных пленок и загрязнений, для чего перед пайкой надо производить механическую зачистку или травление их поверхности в растворах щелочей или кислот. Однако за время между очисткой и пайкой на поверхности металлов вновь образуется тонкая оксидная пленка. Поэтому непосредственно в процессе пайки необходимо удалять оксидную пленку не только с паяемого металла, но и с расплавленного припоя, что достигается применением при пайке флюсов, искусственных газовых сред, вакуума, а также физико-механическими способами разрушения оксидной пленки.
Читайте также: