Металлы в природе химия 9 класс
Обновлено: 17.05.2024
Цель урока. Познакомить учащихся с природными соединениями металлов и с самородными металлами. Сформировать понятие о минералах, рудах и металлургии и ее разновидностях – пиро-, гидро- и электрометаллургии.
- применение обобщения знаний, умений и навыков в новых условиях – создание проблемной ситуации;
- контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
- уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
- уметь устанавливать причинно-следственные связи между «составом», «химическими свойствами», «получением металла».
- развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
- развитие логического мышления, внимания и умения работать в проблемной ситуации.
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Оборудование: коллекция руд железа, алюминия, мел, железо, раствор сульфата меди, таблицы «Доменный процесс», « Доменная печь», «Процессы выплавки стали в конвертере, в дуговой печи», «Электрохимическое получение алюминия», фарфоровая ступка, компас.
Оформление и наглядность: таблица размещается на доске.
План урока
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Изучение новой темы.
4. Закрепление.
5. Домашнее задание.
I. Организационный момент
Проверяется готовность к уроку, раздаются листы с тестом (Приложение 2), инструкции для выполнения лабораторной работы (Приложение 4), лотки с демонстрационным материалом – коллекция оксидных руд железа, план урока (Приложение 1), лист наблюдений (Приложение 4), объявляются этапы урока.
Вступительное слово учителя. На этом уроке мы будем рассматривать новую тему «Металлы в природе. Общие способы их получения». Для этого нам нужно вспомнить материал, который мы уже прошли в темах «Химические свойства металлов», «Сплавы». Сейчас мы выполним тест по этим темам.
II. Промежуточный контроль знаний по темам «Химические свойства металлов», «Сплавы»
Учащиеся выполняют тест – 5 минут (Приложение 2). После того, как учащиеся выполнят тест, необходимо обменяться вариантами, проверить работу соседа и поставить оценку, затем тесты передать на проверку учителю. Учитель просит класс поднять руки, кто написал тест на 5 или 4 балла. На закрытой доске открывают заранее подготовленные ответы теста для самопроверки.
III. Изучение новой темы
Объяснение учителя с опорой на знания учеников. Весь материал разбит на три блока, каждый включает актуализацию темы, объяснение нового материала, закрепление.
Объяснение учителя. В повседневной жизни нас окружает множество металлических изделий. Мы с вами познакомились с физическими, химическими свойствами металлов, а также со сплавами, которые образуют эти металлы, но до сих пор нам ничего неизвестно в каком виде встречаются металлы в природе, как их получают и как это связано с химическими свойствами металлов. На этом уроке мы рассмотрим эти увлекательные вопросы. Для того чтобы изучать материал было легче, мы разделим тему на несколько составляющих тем.
1. Металлы в природе
Актуализация знаний.
1.Что такое электрохимический ряд напряжений? (Это ряд металлов, расположенных в зависимости от их восстановительной способности.)
2. Что такое восстановительная способность металлов? (Это способность атомов металлов отдавать электроны в химических реакциях.)
3. Как изменяется восстановительная способность металлов в электрохимическом ряду напряжений? (В электрохимическом ряду напряжений слева направо восстановительная способность атомов металлов уменьшается).
Новый материал
Сегодня мы рассмотрим не только нахождение металлов в природе, но и, как связаны между собой химическая активность металлов и нахождение металлов в природе.
Объяснение учителя, заполнение таблицы на доске, сопровождающееся объяснением учителя с опорой на знания учеников, и в тетрадях. Демонстрация слайдов №1, №3-10 (тема «Получение металлов»)
Природные соединения алюминия
*Место металла в 2-й, 3-й, или 4-й колонках определяется учениками, после рассмотрения образцов на слайдах коллекции.
Коллективное устное обсуждение таблицы с классом
Природные химические соединения металлов называют минералами. минералы, содержащие в количествах. пригодных для получения в промышленности, называют рудами.
На основании вышесказанного можно составить следующий логический ряд, указывая ключевые слова. Один ученик работает у доски с помощью учителя, класс записывает в тетради
«Формы существования металлов в природе»
Металл ––> минерал ––> руды
Природное Природное
химическое химическое соединение, содержащее металл в количествах,
соединение пригодных
Составим еще одну классификацию природных соединений металлов по признаку принадлежности минералов к одному из классов неорганических соединений
Минералы, руды
Таблица заполняется учениками по учебнику [2], работа в парах. Затем проверяется – вызванный ученик зачитывает свой вариант, и учитель предлагает классу составить третью классификацию природных соединений металлов по кислотному остатку минералов, заполнить вторую колонку таблицы № 2, работа в парах. Затем учитель вызывает пару учеников, которые зачитывают свой вариант, и обсуждают его с классом. (Приложение 3)
Закрепление темы
1. Назовите, в каком виде встречаются металлы в природе? (Металлы встречаются в природе как в чистом виде. так и виде соединений)
2. Как это связано с химической активностью металлов? (Малоактивные металлы встречаются в свободном виде: золото, платина; более активные металлы встречаются как в самородном виде, так и в соединениях – серебро – олово; активные металлы – от олова до лития встречаются только в виде соединений)
3. Какая таблица отражает эти закономерности нахождения металлов в природе? (Электрохимический ряд напряжения металлов.)
2. Металлургия – наука и отрасль промышленности, изучающая получение металлов из руд
Актуализация знаний
1. Что такое руды? (Руды – это минералы, содержащие металл в количествах, достаточных для получения его в промышленности.)
2. Какие руды вам известны? (Руды бывают оксидные, сульфидные, карбонаты, сульфаты, хлориды, нитраты.)
Объяснения учителя с опорой на знания учеников
– Ребята, как вы думаете, из каких руд легче всего получить металл в чистом виде и почему?
Наиболее пригодны для получения металлов оксидные руды, затем сульфидные, следующие карбонатные руды и сульфаты. Например, железо получают именно из оксидных руд, поэтому такие руды имеют наибольшее значение. Следующими считаются сульфидные руды железа. Среди оксидных руд железа наиболее удобен для переработки магнитный железняк Fe3O4, так как там наибольший процент содержания железа по сравнению с другими образцами.
Учащиеся рассматривают коллекцию руд железа (работа в группах), выполняют по инструкции (Приложение 4) исследование физических свойств руд железа, записывают результаты в лист наблюдений, предварительно обсудив в группе. Работа в группах, с распределением функций участников: руководитель, выполняющий эксперименты, ученик, который ведет протокол, то есть пишет уравнения реакций и наблюдения. В процессе выполнения работы в группе коллективно выставляют каждому оценку. Результаты обсуждаются в классе
Лабораторная работа «Исследование физических свойств оксидных руд железа»
*Текст, выделенный темным шрифтом, заполняется учащимися
1. Какие руды наиболее пригодны для получения металлов? (Наиболее удобны для получения металлов оксидные руды, затем сульфидные, карбонатные, сульфатные)
2. Какая руда железа и почему, из рассмотренных в лабораторной работе, наиболее пригодна для промышленной обработки? (Магнитный железняк, так как в нем в нем самый высокий процент содержания железа)
3. Общие способы получения металлов, сопровождающие их химические процессы
Актуализация знаний
1. Написать схему восстановления металлов из ионов. (Me +n + ne ––> Me 0 )
2. Что такое чугун? (Чугун – сплав на основе железа, содержащий от 2 – 4,5 %% углерода, а также марганец, кремний, фосфор и серу)
3. Что такое сталь? (Сталь – сплав на основе железа, содержащий не менее 2% углерода)
Новый материал
Объяснение учителя, демонстрация химических реакций, параллельно запись реакций в тетрадь, на доске учениками с помощью учителя.
В зависимости от способа извлечения металла из руды выделяют следующие виды металлургических процессов
Схема
1. Электрометаллургия – выделение металлов из их солей и оксидов плд действием электрического тока
Демонстрация слайда №2 (тема «Получение металлов»)
2. Гидрометаллургия – методы получения металлов, основанные на химических реакциях, протекающих в растворах
3. Пирометаллургия – методы извлечения металлов из руд под действием высоких температур. Оксидные руды и оксиды восстанавливают углем, оксидом углерода (II), более активным металлами (алюминий, магний, натрий)
Демонстрация видео слайда №11 (тема «Получение металлов»)
Сульфидные руды подвергаются обжигу:
Демонстрация слайдов № 3, 4, 5 (тема «Железо»)
Доклад или презентация заранее готовятся группой учеников, где распределены роли среди участников: руководитель, помощники, докладчик. В сданной учителю работе должны быть выставлены оценки самими исполнителями работы, а также она оценивается классом, если есть или высказываются замечания. Доклад обсуждается с классом.
Закрепление темы
1. С какими видами металлургических процессов вы сегодня познакомились? (В зависимости от способа получения металлов выделяют пиро-. гидро-, электрометаллургия)
2. Какие этапы переработки железа вы знаете? (От руды к чугуну, от чугуна к стали)
IV. Закрепление
Выполнить упражнение 6,7 из рабочей тетради, тема «Получение металлов» [3]
Затем с помощью учителя ученики делается вывод по уроку.
Вывод по уроку. Сегодня мы рассмотрели нахождение металлов в природе и получение металлов.
1. Как вы думаете от чего зависит, в какой форме будет находиться металл в природе?
(Форма нахождения металла в природе зависит от химической активности металла)
2. От чего зависит способ переработки руды для получения металла? (Способ получения металла зависит от вида, в котором находится металл в природе, то есть от руды.)
Таким образом, мы видим, что получение металлов зависит от химической активности металлов, то есть химических свойств, а также от количественного и качественного состава природных соединений металлов.
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок.
V. Домашнее задание
Проблемный вопрос. Как строение атомов металлов влияет на способы получения металлов?
Параграф 9 «Получение металлов», страница 71-74, упражнение 2-5[2]
рабочая тетрадь, страница 69, упражнение 6,7 [3], кто не успел в классе
Список литературы.
1. Химия 9 класс. Металлы. Получение металлов, Железо Мультимедийное приложение к учебнику О.С.Габриеляна. Электронное учебное издание. ООО «Дрофа» 2011.
2. Габриелян О.С. Химия 9 класс. Учебник , М.: Дрофа, 2011.
3. Габриелян О.С., Яшукова А.В., Рабочая тетрадь 9 кл. О.С.Габриелян «Химия, 9 класс». М., Дрофа, 2011.
4. Шпаусус З. Путешествие в мир химии, «Просвещение», М., 1967.
Методическая разработка урока по химии «Металлы в природе. Общие способы получения металлов» 9 класс (базовый курс, О.С. Габриелян)
план-конспект урока по химии (9 класс)
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт. О.С. Габриелян. К конспекту прилагается презентация (приложение1) и дополнительный материал(приложение 2).
| Вложение | Размер |
|---|---|
| konspekt_uroka_po_metallurgii._himiya._9kl.docx | 35.17 КБ |
| prilozhenie_1_k_uroku_po_metallurgii.him_.9kl.pptx | 114.33 КБ |
| prilozhenie_2_k_uroku_po_metallurgii.him_.9_kl.docx | 21.28 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Тема: «Металлы в природе. Общие способы получения металлов».
Цель: сформировать у учащихся представление о формах существования металлов в природе, познакомить с природными соединениями металлов; сформировать понятие о минералах и рудах. Познакомить учащихся с металлургией и ее разновидностями: пиро-, гидро- и электрометаллургией.
Оборудование: Учебник О.С. Габриелян. Химия. 9 класс; электронное приложение к учебнику, таблицы: «Производство чугуна», «Конвертор с кислородным дутьем», «Получение алюминия», коллекция руд железа и алюминия, компьютер, мультимедийный проектор.
Применяемые технологии:
Проверяет готовность учащихся
Подготовка к уроку
Актуализация знаний. Определение темы урока.
Беседа в формате вопрос-ответ:
-чем отличаются металлы натрий и золото?
-на какие группы можно разделить все металлы по их активности? К какой из них относится натрий? Золото?
-пользуясь какой таблицей мы можем судить об активности металлов?
- чем обусловлена активность металлов?
- вспомните, в каком виде золото можно найти в природе?
- а натрий в виде чистого металла мы сможем обнаружить в природе?
Сегодня и поговорим о природных соединениях металлов.
Диктует тему урока:
«Металлы в природе. Общие способы получения металлов»
Открывает презентацию к уроку
Слайд 1 Презентации (приложение 1)
-цветом, активностью, плотностью
- по своей активности металлы делятся на активные, средней активности и малоактивные. Натрий – активный металл, золото – малоактивный.
-электрохимический ряд напряжений металлов
- активность металлов обусловлена способностью к отдаче электронов: чем активнее металл, тем легче он отдает электроны
- в виде самородков
- нет. Натрий – активный металл: он очень активно взаимодействует с водой, кислородом и др. неметаллами, поэтому в природе он существует только в виде соединений
Записывают тему в тетрадь
Изучение нового материала.
Нахождение металлов в природе.
Способы получения металлов.
Слайд 2 Презентации (приложение 1):
Обратите внимание, что природные соединения металлов называются минералами. Металлы средней активности обычно существуют в природе в виде оксидов и сульфидов, активные металлы – в виде солей.
В быту мы окружены множеством изделий из различных металлов и сплавов. Узнаем как же из минералов можно получать металлы.
Минералы в природе обычно входят в состав руд.
Слайд 3 Презентации (приложение 1)
Откройте с. 75 учебника и прочитайте определение руды.
Дает определение металлургии.
Мы с вами уже обсудили как связана активность металлов с формами их существования в природе.
А как вы думаете: будет ли активность металлов влиять на выбор способа их получения?
Слайд 4 Презентации (приложение 1):
Просит переписать схему из слайда в тетрадь
Слайд 5 Презентации (приложение 1):
Дает определение пирометаллургии. Просит учащихся записать название способа, сырье и восстановители
Слайд 6 Презентации (приложение 1):
Просит записать подзаголовок со слайда и примеры реакций:
Оксид олова + углерод=
Оксид железа (III)+ оксид углерода (II)=
Показывает учащимся правильные уравнения, просит проверить.
Рассказывает учащимся о доменном производстве чугуна, о кислородном конвертере для производства стали. Демонстрирует таблицы «Производство чугуна», «Конвертор с кислородным дутьем». Далее рассказ учителя дополнительного материала (приложение 2).
Демонстрирует и комментирует видео «Кипящий слой» (ссылка на слайде 6 Презентации)
Слайд 7 Презентации (приложение 1):
Запишем пример восстановления металлов водородом, например, вольфрама из его оксида.
Демонстрирует уравнение реакции. Просит проверить.
Слайд 8 Презентации (приложение 1):
Просит записать подзаголовок слайда в тетрадь и составить в качестве примеров уравнения реакций восстановления алюминием оксида железа (III) и оксида марганца (IV).
Восстановление металлов алюминием – это экзотермический процесс. Демонстрирует видео «Алюминотермия» (ссылка на слайде 8 Презентации)
Слайд 9 Презентации (приложение 1):
Просит записать подзаголовок слайда в тетрадь и составить в качестве примера уравнения реакций получения цинка из его сульфида.
Слайд 10 Презентации (приложение 1):
Дает определение гидрометаллургии. Просит учащихся записать название способа и металлов, которые можно им получить.
Подчеркивает, что при таком способе получения нерастворимые соединения переводятся в растворимые, и уже растворы подвергаются переработке.
Слайд 11 Презентации (приложение 1):
Просит записать в тетрадь подпункт а) из слайда и в качестве примера составить уравнение реакции восстановления меди из ее сульфата железом.
Напоминает, что этот опыт ребята проводили, когда изучали химические свойства металлов.
Просит переписать в тетрадь текст пункта б) слайда и уравнение реакции.
Поясняет, что электролиз – это ОВР, проходящая под действием эл. тока. Более подробно этот процесс рассматривается в 11 классе.
Получение каких металлов мы с вами еще не обсудили?
Почему активные металлы нельзя получить пиро- и гидрометаллургией?
Учитель помогает ученикам наводящими вопросами сформулировать правильный ответ.
Итак, для получения активных (щелочных и щелочно-земельных) металлов нужен сильный восстановитель. И таким восстановителем является эл. ток. Его восстановительной способности хватит и для восстановления очень активных металлов (лития, натрия, калия и др.) Т.е. электролиз, о котором мы говорили выше, можно применять и для получения активных металлов.
Подумайте, можно ли получить активные металлы электролизом их водных растворов?
Поэтому для получения активных металлов эл. током действуют на расплавы их соединений.
Слайд 12 Презентации (приложение 1)
Дает определение электрометаллургии. Просит учащихся записать название способа и металлов, которые можно им получить.
Переписывают данные слайда в тетрадь. Рассматривают образцы минералов из коллекции.
- открывают учебник, читают определение.
Записывают в тетрадь формулу: руда = минерал + горная порода,
Обогащение руды – удаление из нее пустой породы.
-переписывают схему в тетрадь
- делают записи в тетрадь
- записывают текст слайда и составляют уравнения реакций
- проверяют правильность уравнений
- переписывают подзаголовок слайда в тетрадь, пишут уравнение реакции
-проверяют правильность составленного уравнения
- переписывают содержание слайда.
- делают запись в тетрадь, пишут уравнение реакции
- проверяют правильность уравнения
-делают записи в тетради
- активные металлы в природе находятся в виде солей. Чтобы их восстановить из солей, нужны сильные восстановители. Неметаллы такой силой не обладают, а очень активные металлы, например, нельзя применять как восстановители в гидрометаллургии, т.к. они взаимодействуют с водой.
- нет, потому что полученные металлы будут сразу же взаимодействовать с водой.
- делают записи в тетради
Осмысление и формулирование выводов по уроку.
В форме беседы помогает учащимся сформулировать выводы по теме урока:
1. Как вы думаете от чего зависит, в какой форме будет находиться металл в природе?
2. От чего зависит способ переработки руды для получения металла?
3. На чем основаны способы получения металлов из руд?
Записывают вывод в тетрадь
-форма нахождения металла в природе зависит от химической активности металла
-способ получения металла зависит от вида, в котором находится металл в природе, то есть от руды.
- в основе способов получения металлов лежат химические свойства самих металлов и их соединений, входящих в состав руд.
Предлагает выполнить упр.4 на с.80 учебника.
Предлагает проверить и обсудить решение.
Предлагает записать домашнее задание:
§12, записи в тетради – выучить.
Записывают домашнее задание.
Предварительный просмотр:
Подписи к слайдам:
Металлы в природе. Общие способы получения металлов. Химия 9 класс Урок 15 Автор: Ашмасова О.Е., учитель химии и биологии ОАНО КПГСПИК г. Балашиха, МО
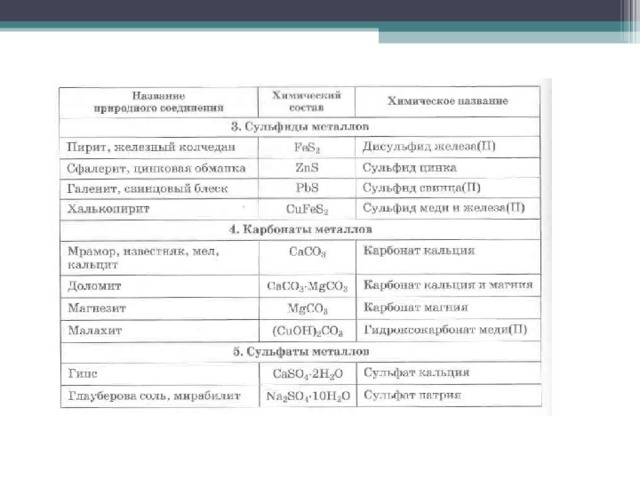
Нахождение металлов в природе В самородном виде ( малоактивные металлы: Ag, Pt , Au, реже Cu, Hg ) В виде минералов (химические природные соединения): Оксиды металлов средней активности : красный железняк Fe 2 O 3 ; бурый железняк 2 Fe 2 O 3 . 3Н 2 O ; магнитный железняк Fe 3 O 4 Сульфиды металлов малой и средней активности : свинцовый блеск PbS , цинковая обманка ZnS , киноварь HgS Соли активных металлов: мел, мрамор, известняк CaCO 3 , галит NaCl , сильвинит KCl . NaCl , фтораппатит 3 Ca 3 (PO 4 ) 2 , фосфорит Ca 3 (PO 4 ) 2
Руда → минерал → металл Руда= минерал + пустая порода Обогащение руды – удаление из нее пустой породы Концентрат – обогащенная руда – сырье для металлургического производства Металлургия – наука о производстве металлов, сплавов и их обработке, а так же и отрасль тяжелой промышленности по производству металлов и сплавов.
1. Пирометаллургия – получение металлов из руд по реакциям восстановления при высоких температурах. Сырье: оксиды и сульфиды металлов малой и средней активности Восстановители: С, СО, Н 2 , Al
б) Восстановление водородом. Метод дорогостоящий, используется для получения редкоземельных металлов.
г) Получение из сульфидов происходит в 2 стадии: обжиг сульфидов до оксидов восстановление металлов из оксидов
2 . Гидрометаллургия – получение металлов из растворов солей.(Медь, золото, серебро, магний, цинк, молибден, уран).
а) Восстановление более активным металлом . б ) Электролиз растворов солей.
3. Электрометаллургия – получение активных металлов из расплавов солей под действием электрического тока. Получают щелочные и щелочноземельные металлы (первая и вторая группа, главная подгруппа).
Приложение 2 (доп. материал к слайду 6)
Внедоменные способы получения железа
В ХIХ-ХХ веках большое количество чугуна и железа получали пиротехническим способом в специальных печах домнах, а потом уже из чугуна получали сталь в конверторах. Домны и конверторы – это металлургические печи довольно больших размеров см. таблица «Производство чугуна», «Конвертор с кислородным дутьем»». Выпуск чугуна и стали в них исчислялся миллионами тонн в год.
В настоящее время нет необходимости в таком количестве чугуна и стали, да и природные ресурсы металлических руд и коксующегося каменного угля значительно снизились. Все больше внимания уделяется методам прямого получения железа.
Под процессами прямого получения железа понимают такие процессы, которые дают возможность получать металлическое железо непосредственно из руды, минуя доменную печь.
Методы прямого получения железа из руд известны давно, но пока не нашли широкого применения.
Интересны они тем, что позволяют вести процесс не расходуя металлургический кокс, заменяя его другими видами топлива; получать чистый металл благодаря развитию способов глубокого обогащения руд, обеспечивающих высокое содержание железа в концентратах, но и полное освобождение от фосфора, серы и других примесей. Этого нельзя достичь при доменной плавке.
Большой интерес представляет собой прямое получение легированного железа (вспомните, что это такое) из комплексных руд, содержащих хром, никель, ванадий и другие полезные компоненты. Традиционная двух стадийная технология переработки таких руд на металлургических предприятиях ведется с большими потерями указанных элементов.
Немаловажным преимуществом прямых способов получения железа является возможность организации маломасштабного производства.
Опыт показал, что прямые способы целесообразно применять для получения губчатого железа, используемого при выплавке стали, а также производства железного порошка.
Наибольшее распространение получили способы восстановления с использованием различных агрегатов: шахтных печей и реторт, вращающихся печей, движущейся колосниковой решетки, реакторов кипящего слоя. Для процессов прямого получения железа применяют газообразные или твердые восстановители.
Некоторые полезные технологические принципы доменного производства перешли и сюда. Например, технология «кипящего слоя».
Демонстрируется видео «Кипящий слой» (ссылка на сл. № 6 в презентации к уроку)
В специальную печь на решетку помещают измельченную руду и твердый восстановитель (например, уголь), а снизу подают поток горячего воздуха. Твердые частички током воздуха поднимаются вверх, образуя движущийся слой. Если применяют газообразный восстановитель (СО или водород), то его нагревают подают снизу и частички руды «парят» в потоке восстановителя. Важно точно соблюдать температурный режим, чтобы частички не спекались, и процесс восстановления проходил более полно.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Тема урока: «Металлы в природе. Понятие о металлургии»
учебно-методический материал по химии (9 класс)
Форма учебной деятельности: коллективная, парная, индивидуальная, исследовательская.
Методы: проблемно-интегративный, эвристический, объяснительно-иллюстрированный, исследование
Оборудование: на доске портреты ученых Н.Н.Бекетова, Г. Деви – первооткрывателей способов получения металлов, на столах - коллекции с рудами металлов, магниты, фарфоровые диски, компьютер, проектор, экран
Цели урока:
- Повторить, закрепить и обобщить знания учащихся по теме «Коррозия металлов»
- Организовать процесс ознакомления учащихся с природными соединениями металлов и с самородными металлами;
- Сформировать понятие о минералах, рудах, металлургии и ее разновидностях – пиро-, гидро- и электрометаллургии, микробиологических методах: сути и химизме этих процессов.
| Вложение | Размер |
|---|---|
| 14.04.2021_tema_urok.metally_v_prirode._ponyatie_o_metallurgii9kl.docx | 52.52 КБ |
Составитель: Бестаева А.А.учитель химии
МБОУ «СОШ №1 с.Ногир»
Технологическая карта урока химии в 9 классе (ФГОС)
Тема урока : « Металлы в природе. Понятие о металлургии »
Тип урока : комбинированный урок
- формирование у учащихся познавательного интереса к химии;
- воспитание таких качеств характера, как настойчивость в достижении цели;
- воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения
Приветствует учащихся, организует рабочее место;
Проверяет количество учащихся в классе, наличие дежурных по классу. Настраивает на повторение домашнего задания
Приветствуют учителя, организуют своё рабочее место, отвечают на организационные вопросы, демонстрируют готовность к уроку.
Коммуникативные : Планирование сотрудничества. Управление своим поведением и деятельностью.
Развитие умения организовать рабочую среду. Развитие доброжелательности и эмоциональной отзывчивости.
- Этап воспроизведения и коррекция опорных знаний (проверка домашнего задания) (8 мин.)
1)Организует устный фронтальный опрос класса (Приложение 1)
2) Организует письменный опрос по карточкам (3 варианта) – работа в мини группах – парах.
3) Демонстрирует образец выполнения работы на слайде презентации
1) Отвечают на вопросы учителя, применяя знания темы «Коррозия металлов»
2) Обсуждают в парах задание, совместно ищут варианты решения. Устно по желанию комментируют полученные результаты
3) Сверяют свои результаты с образцом, самостоятельно выставляют оценку
Коррозия металлов, агрессивные факторы среды, типы коррозии: химическая и электрохимическая коррозия, уравнения коррозии металлов
Регулятивные: (контроль, коррекция знаний)
Познавательные: (использование знаково-символических средств при решении заданий)
Коммуникативные: (монологические ответы, диалоговая коммуникация при обсуждении в парах.)
Самоопределение и смыслообразование.
Умение проявлять лидерские качества, уважать мнение партнера, толерантно относиться к оценке результатов
- Этап актуализации - самостоятельного формулирования цели и темы урока
Логически подводит учащихся к самостоятельному формулированию темы, постановке цели, началу изучения нового материала
Строят умозаключения, логически подходят к теме урока и цели, над которой будут работать.
Коррозия одних металлов – это способ получения других металлов.
умение сравнивать, обнаруживать и формулировать проблему, определить цель учебной деятельности. Познавательные:
умение преобразовывать информацию, умение анализировать, делать выводы
Коммуникативные: умение выслушивать мнение одноклассников, обсуждать, оценивать правильность высказываний, формулировать свои ответы.
Уважительное отношение к собеседнику, готовность и способность вести диалог с другими людьми.
Осознание значимости знаний предмета.
- Этап открытия новых знаний и первичного их усвоения (15 мин)
1. Демонстрирует презентацию на тему « Металлы в природе. Способы получения металлов». Контролирует процесс составления опорного конспекта учащимися по ходу объяснения материала
2. Организует выполнение исследования физических свойств железных руд,оказывает консультационную помощь и поддержку группам при выполнении лабораторных опытов, написании формул веществ.
3.Наблюдает за ходом исследования
4. Корректирует по необходимости формулировку выводов по результатам.
5. Организует проверку результатов исследования с образцом на слайде презентации
1. Слушают объяснение учителя, усваивают наглядную информацию со слайдов презентации, фиксируют главное в тетрадь, составляют опорный конспект по теме.
2. Формулируют цели исследований
3. Работают в парах методом кооперации над исследованием физических свойств руд черных металлов
4. Анализируют результаты
5. Фиксируют наблюдения
7. Заносят названия, формулы, результаты в таблицу
8. Сверяют полученные результаты с результатами в образце на слайде презентации
9. Самостоятельно выставляют оценку
Распространенность металлов в природе.
Руды: оксидные, сульфидные, хлоридные, сульфатные, фосфатные карбонатные.
Физические свойства руд черных металлов: окраска, блеск, цвет черты на фарфоре, магнитные свойства.
Самородные металлы.Металлургия: черная, цветная. Сплавы: Чугун, сталь.Виды металлургии.
- восстановление водородом – водородотермия,
-более активным металлом: алюминотермия(метод Н.Н. Бекетова)2.Гидрометаллургия.
Уравнения соответствующих реакций.
Умение сравнивать, обнаруживать и формулировать проблему, определить цель учебной деятельности, организовывать свою работу в паре, оценивать результаты своей деятельности.
Познавательные умение преобразовывать информацию, умение анализировать, делать выводы, составлять опорный конспект
Коммуникативные: умение присваивать словесную информацию, трансформировать ее в письменный вариант, составлять таблицу;
выслушивать мнение напарника, обсуждать, оценивать правильность высказываний, формулировать свои ответы.
Принятие социальной роли обучающегося, развитие мотивов учебной деятельности и формирование личностного смысла обучения, социальных и межличностных отношений, уважение к своей деятельности,
осознание ее значимости на конкретном жизненном этапе, уважение к партнеру
к партнеру, учителю.
знаний и рефлексии
Контролирует усвоение материала при помощи фронтальному тестированию класса.
На основе решенного теста, организует формулирование вывода учащимися.
Акцентирует внимание учащихся на правильность написания и произношения новых терминов.
(демонстрирует терминологический словарь на слайде)
Отвечают на вопросы теста.
Применяют знания нового материала для формулирования общего вывода по уроку.
Проверяют правильность написания и произношения терминов по слайду презентации
Тест (Приложение 4)
Регулятивные: контроль в форме сравнения способа действия и его результата с заданным эталоном, с целью обнаружения отклонений от эталона. Коррекция. Осознание качества и уровня усвоения материала.Самооценивание.
Познавательные: умение преобразовывать информацию, умение анализировать, применять, преобразовывать информацию во время тестирования, и формулирования выводов, при опоре на заданную схему.
Составлять тезисы выступления. Выступать перед аудиторией, доказывать свою точку зрения.
Наличие внутренней позиции, адекватной мотивации учебной деятельности, включая учебные и познавательные мотивы.
- Этап записи домашнего задания и инструктирования по его выполнению (2 мин)
Демонстрирует домашнее задание.
Объясняет варианты его выполнения.
Благодарит учащихся за урок
Записывают домашнее задание к следующему уроку.
Анализируют информацию, делают осознанный выбор творческого задания
Самоопределение и смыслообразование
Фронтальный устный опрос
(вопросы и предполагаемые ответы обучающихся)
Ежегодно в мире подвергается разрушению более 20 миллионов тонн металла.
-Как называется этот процесс? (Этот процесс называется «коррозия»)
- Дайте определение понятию «коррозия». (Коррозия – это процесс самопроизвольного разрушения металлов и сплавов под действием факторов окружающей среды.)
- Под воздействием, каких агрессивных факторов, происходит коррозия металлов? (Агрессивные факторы, вызывающие коррозию - это влажный атмосферный воздух, газы - окислители, такие как хлор, кислород, азот, растворы кислот, солей, щелочей.)
- Какие виды коррозии металлов существуют? (Химическая и электрохимическая.)
- Кратко охарактеризуйте химическую коррозию. (Химическая коррозия подразделяется на газовую и жидкостную.Газовая – под воздействием газов: F2, CL2, O2; жидкостная под воздействием агрессивных жидкостей – кислот, щелочей.)
- Кратко охарактеризуйте электрохимическую коррозию.
(Электрохимическая коррозия протекает при соблюдении двух условий: контакта двух металлов и наличии электропроводной среды.Например, при контакте железа и цинка в морской воде идет разрушение цинка, как более активного металла.)
Письменныйопрос - работа в мини группах - парах по карточкам
Задание: 1) Допишите уравнения реакций. Расставьте коэффициенты в уравнениях.
2) Найдите среди предложенных, уравнения реакций коррозии металлов. Определите вид коррозии.
Карточка 1: 1) Na+ O2 2) AL + HCl 3) Fe + CuSO4 4) Mg + Fe2O3 Карточка 2: 1) Ca+ O2 2) Mg + H2SO4 3) Zn + FeСl3 4) Al + Cr2O3 Карточка 3: 1) Fe+ O2 2) Zn + HCl 3) Mg + Al2(SO4)3 4) Ca + Al2O3Тест(первичное закрепление материалами контроль)
- Только в самородном состоянии в природе находятся металлы:
- Na, K, Au 2. Au, Ag, Cu 3. Au, Pt
- И в самородном состоянии и в виде соединений в природе встречаются металлы:
- Na, K, Au 2. Ag, Cu, Pb 3. Fe, Mg, Hg
- Только в виде соединений в природе встречаются металлы:
1. Аu, K, Mg; 2. Na, Ca, Pt 3. Ca, Mg, Fe
4) Железо из оксида железа (III) получают при помощи методов:
1. Пирометаллургии 2. Электрометаллургии 3. Гидрометаллургии
5) Гидрометаллургические процессы получения меди из сульфида меди (II) включают в себя:
1. Обжиг и восстановление углем 2.Растворение в серной кислоте и восстановление из раствора более активным металлом 3. Электролиз сульфида меди (II)
6) Электролизом расплавов солей получают металлы, стоящие в ряду напряжений металлов:
1. от Li до Al 2. От Li до Fe 3. от Li до Pb
7) Типичными восстановителями в пирометаллургии являются:
1. Na, K, Au 2. С, СО, Al 3. C, CO2, Mg
8) В цепочке превращений СuCO3 Х Сu, веществом Х является:
1. СuSO4 2. CuS 3. CuO
9) Способ получения металлов из оксидов, открытый русским ученым Н.Н.Бекетовым: 1. Магнийтермия 2. Алюминотермия 3. Электролиз
10) Экологически чистым видом металлургии считается (-ются):
1. Гидрометаллургия 2. Микробиологические методы
По теме: методические разработки, презентации и конспекты

Тема урока: «Металлы главной II подгруппы Периодической системы»
Цель урока: Дать общую характеристику металлов главнойIIподгруппы Периодической системы. Рассмотреть основные физические и химические свойства этих элементовМетоды: проблемные, поисковые, лаборат.

Технологическая карта к уроку биологии 5 класс. Тема урока Разнообразие живой природы
Технология урока направлена на реализацию системно-деятельностного подхода.
Конспект урока по ИЗО в 6 классе Тема урока «Пейзаж настроения. Природа и художник»
Конспект урока по ИЗО в 6 классеТема урока «Пейзаж настроения. Природа и художник».

Презентация к теме урока: Металлы.
Урок повторения со студентами положение металлов в ПСХЭ, особенности строения их атомов и кристаллов, металлическую химическую связь и кристаллическую металлическую решетку.Урок обобщения знания учащи.

Презентация по теме: "Нахождение металлов в природе и общие способы их получения"
Нахождение металлов в природе и общие способы их получения.

Тема урока: «Человек и природа. Экология и нравственность. Пр.р.№2: «Работа с документами по теме «Экология». (повторительно-обобщающий урок).
1.Обобщить и систематизировать знания учащихся о человеке и его взаимосвязи с природой;2.Углубить представление учащихся о взаимосвязи человека, общества и природы, выявить их взаимозависимость и спец.
Презентация к уроку химии "Металлы в природе. Способы получения металлов"

Данная презентация разработана для урока химии в 9 классе. Тема урока:"Металлы в природе. Способы получения металлов". Материал презентации позволит учителю: 1) проверить как учащимися усвоен ранее изученный материал "Характеристика металлов по положению в Периодической системе Д.И. Менделеева"; 2) сэкономит время урока, так как основные моменты и вопросы учителя выведены на экран; 3) через рефлексию в конце урока понять насколько успешно прошел урок для каждого учащегося.
Просмотр содержимого документа
«Презентация к уроку химии "Металлы в природе. Способы получения металлов" »

МЕТАЛЛЫ В ПРИРОДЕ ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ.
Учитель химии: Голикова Екатерина Владимировна,
МОУ СОШ№2 ЗАТО Светлый

Металлы, встречающиеся в природе в свободном состоянии:
Это малоактивные металлы .
Их называют - самородками


Из активных металлов в самородном виде встречается только железо метеоритного происхождения.

В основном металлы присутствуют в природе в виде соединений – оксидов и солей (галогенидов, сульфидов, карбонатов, сульфатов).

- от греческого – «металлон» – шахта, рудник
- от греческого – «металлон» – шахта, рудник
Минералы и горные породы, которые используют для промышленного получения металлов, называют рудами.

Предварительная обработка руды.
2ZnS + 3O₂=2ZnO + 2SO₂

Какую степень окисления имеют металлы в природных соединениях и сырье, подготовленном для металлургического производства?
Во всех соединениях они имеют положительную степень окисления, то есть являются катионами: М ⁿ ⁺
Что необходимо сделать, чтобы получить чистый металл?

В зависимости от способа восстановления металлов, существует несколько видов металлургического производства.
- Пирометаллургия (от греч. «пирос» – огонь)
- восстановитель: углерод (кокс)
C + O₂ = CO₂ + Q
Fe₂O₃ + 3CO = 2Fe + 3CO₂

2) восстановитель: водород
WO₃ + 3H₂ = W + 3H₂O
3) металлотермия – вытеснение более активным металлом.
Cr₂O₃ + 2Al = 2Cr + Al₂O₃
Как называется этот способ?

II . Гидрометаллургия (от греческого «гидро» – вода).
Подумайте: в каком агрегатном состоянии должен находиться металл?
CuO + H₂SO₄ = CuSO₄ + H₂O
Fe + CuSO₄ = FeSO₄ + Cu

III . Электрометаллургия.
Активные металлы из природных соединений очень трудно восстановить с помощью химических веществ.
В начале XIX в. английский химик и физик Г. Дэви предложил использовать в качестве восстановителя не химические вещества, а электрический ток.
Химические реакции, протекающие под действием электрического тока, называют электролизом.

2 NaCl ( расплав) 2 Na + Cl ₂
Na ⁺ + 1ē Na °
2Cl⁻ - 2ē Cl ₂ °

Получение алюминия из оксида алюминия.
Окисд алюминия растворяют в расплавленном минерале криолите : Na₃AlF₆
Читайте также:
