Металлы в природе сообщение
Обновлено: 18.05.2024
Большинство химических элементов относится к металлам (химия, 9 класс). Под этим материалом подразумеваются простые вещества, наделенные определенным комплексом свойств: кристаллическая структура, блеск, высокая теплопроводность и электропроводимость, а также ее зависимость от нагрева, способность легко отдавать электроны, ковкость, тягучесть, склонность к образованию сплавов.

Общая характеристика
В атомах металлов наружные электроны удерживаются довольно слабо (если сравнивать с другими, неметаллическими, элементами). В химических реакциях металлы обычно выступают в качестве восстановителей — это объясняется тем, что они имеют низкую степень ионизации.
Для металлов и их сплавов характерна металлическая связь, то есть та, что возникает за счет перекрытия валентных электронов. Это дает возможность осуществлять взаимные атомные смещения без нарушения кристаллической решетки (это объясняет тот факт, что эти вещества более пластичные по сравнению с неметаллами).

Современная периодическая система насчитывает 118 элементов (правда, часть из них до сих пор не признана), и большая часть из них именно металлы. В свою очередь, они делятся на «подвиды»:
- Щелочные (примером таких выступают натрий Na, калий K, цезий Cs, франций Fr и прочие).
- Щелочноземельные — кальций Ca, стронций Sr, барий Ba.
- Переходные — медь Cu, серебро Ag, золото Au. Эта группа — самая многочисленная, она насчитывает 38 веществ.
- Легкие — алюминий Al, олово Sn, титан Ti.
- Полуметаллы — кремний (Si), бор (B), мышьяк (As), сурьма (Sb).
- Лантаноиды — лантан (La), лютеций (Lu), скандий, иттрий.
- Актиноиды (они до конца не изучены) — торий, плутоний, уран, нептуний.
Примечательно, что такие элементы, как магний и бериллий, нельзя отнести ни к одной из групп — их свойства отличаются от характеристик прочих металлов. Например, при нормальных условиях они устойчивы к воздействию воды и воздуха, потому что имею тончайшую оксидную пленку по всей своей поверхности.
Большинство металлов при нормальных условиях находятся в твердом состоянии. Но бывают исключения: например, ртуть и франций (условно) при комнатной температуре и обычном атмосферном давлении.
Твердость у всех элементов отлична. Температура плавления колеблется от -39°C (Hg) до 3410 °C (W). В зависимости от плотности они делятся на легкие (Li) и тяжелые (Os, Ir).
Нахождение в природе и получение

Металлы (общая формула записывается как Me) могут присутствовать в природе как самородки. Это характерно для тех, что практически не окисляются на воздухе (пример: платина, золото, серебро, реже — ртуть и медь).
Они могут встречаться в самородном состоянии и как вкрапления в различных минералах. Но вот большие «куски» (самородки) образуют нечасто.
Активные Me в природе находятся в виде солей (нитраты, карбонаты, сульфаты, хлориды), оксидов. Минералы входят в состав руд и горных пород.
В промышленности Me получают восстановлением соответствующих руд. Один из основных методов получения Me — флотация (определенный способ обогащения руд, основанный на способности минералов удерживаться на межфазовой поверхности). В этом случае руду, содержащую необходимые элементы, переводят в определенную (единую) форму: например, в оксид: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2. Полученные окислы затем восстанавливают. Сделать это возможно несколькими способами:

- Металлотермия — восстановление элемента другим, более активным (с точки зрения химии): Cr2O3 + 2Al → 2Al2O3 + 2Cr; CuO + C → Cu + CO.
- Термическое разложение. Fe (CO)5 (пентакарбонилжелезо)→ Fe + 5CO. Такой способ применяется, если нужно получить высокочистый элемент.
- Электролиз. Используется для получения щелочных металлов: 2NaCL → 2Na + Cl2; 2LiCl → 2Li + Cl2.
- Вытеснение более активным металлом менее активного из раствора соли. CuSO4 + Fe → FeSO4 + Cu.
Железо и его сплавы называют черными металлами, а медь, цинк, олово, свинец и прочие — цветными. Какие у них отличия: первая группа используется в основном для изготовления чугуна и стали, а вторая более универсальна в использовании, меньше подвержены коррозии, и более «податливы» к обработке.
Химические особенности
Все Me в свободном состоянии — восстановители, их степени окисления имеют положительное значение. Химическая активность этих веществ зависит от двух величин: электродного потенциала и энергии ионизации (в таблице Менделеева это значение увеличивается слева направо). Типичные реакции:

- Взаимодействие с хлором и фтором: Cu + Cl2 → CuCl2.
- Окисление кислородом (протекает не слишком энергично): 4Li + O2 → 2Li2O; K + O2 → KO2 (название этого соединения — надпероксид калия).
- С серой протекают только при повышенных температурах: Fe + S → FeS. Золото и платина в подобных реакциях не участвуют.
- Участие водорода приводит к образованию гидридов: Mg + H2 → MgH2; 2Na + H2 → 2NaH.
- С углеродом взаимодействуют только активные металлы. 2Na + 2C → Na2C2 (ацетиленид натрия); Na2C2 + 2H2O → 2NaOH + C2H2 (ацетилен). 4Al + 3C → Al4C3 (метанид алюминия); Al4C3 + 12H2O → 3CH4 (метан) + 4Al (OH)3.
- Реакции замещения с кислотами. В этом случае все будет зависеть от того, какая активность у элемента. Например: Zn + H2SO4 (разб) → ZnSO4 + H2; Zn + H2SO4 (конц) → ZnSO4 + S + H2O.
- Вода будет давать реакцию по такой схеме: 2Na + 2H2O → 2NaOH + H2.
- Возможны реакции с растворами солей: Fe + CuSO4 → FeSO4 + Cu.
Кроме того, металлы способны образовывать комплексы. Это происходит за счет наличия свободных электронных орбиталей.
Способность к комплексообразованию зависит от величины заряда и его радиуса: чем выше первый показатель и ниже второй, тем сильнее способность.
Названия таких соединений подчиняются определенной структуре: сначала указывается наименование аниона, а затем — катиона, из которых состоит вещество. Например: [Li (H2O)4]NO3 — нитрат тетрааквалития.
Образование сплавов
Если соединить несколько металлических (металых) компонентов в один, то можно получить материал, способный «перещеголять» по своим свойствам исходные материалы. Согласно определению, сплавы — это однородный продукт, состоящий из нескольких химических элементов с преобладанием металлических ингредиентов. Получают их при смешивании расплавленных Me. Различают такие виды:
- Механические — это смесь мельчайших кристаллов компонентов, входящих в сплав.
- Твердые — в этом случае в узлах кристаллической решетки находятся атомы сплавленных элементов.
- Интерметаллические — материалы, полученные «растворением» элементов друг в друге.

Примечательно, что сплавы бывают не только состоящие исключительно из металлов — в них часто присутствуют и неметаллические вещества. При этом они могут не просто смешиваться механически, но и образовывать атомные соединения. Такие сплавы будут значительно отличаться по своим физическим и химическим свойствам от элементов-исходников. Кроме того, существует возможность заранее задавать свойства, которыми будет обладать полученный материал:


- Чугун — сплав Fe с C, в котором присутствуют легирующие добавки. Используется для изготовления деталей, различных предметов в тяжелой промышленности (машиностроение, автомобилестроительная индустрия и прочие).
- Латунь — медь + цинк. Материал устойчив к коррозии, легко сваривается со сталью. Благодаря своему цвету (золотистый) широко применяется для изготовления фурнитуры, художественных изделий.
- Амальгама — металлическая смесь, содержащая ртуть. Применяется для золочения металлсодержащих изделий, в производстве зеркал, люминесцентных ламп.
- Сталь — смесь железа с углеродом (но второго компонента меньше, чем в чугуне — всего до 1,8%), также с использованием легирующих добавок, в качестве которых используются Ni, P, Si, Mn, и некоторые другие. Используется для изготовления различных инструментов (слесарных, столярных), в строительстве, судоремонтной и авиационной промышленности.
- Мельхиор — медь и никель. Применяется для изготовления посуды, бюджетных ювелирных и художественных изделий.
- Бронза — медь, олово и легирующие добавки. Используется в машиностроении, ракетостроении, авиационной индустрии, для изготовления художественных изделий и прочего.
- Дюралюминий (дюраль) — сплав Al + Cu + Mg + Mn. Используется в авиастроении, производстве скоростных поездов, и прочих отраслях машиностроения.
Современные технологии нуждаются в тысячах «нестандартных» металлических материалов, обладающих определенным свойствами.
Поэтому изучение этих элементов, проведение опытов с различными сплавами, еще долгое время будет являться одним из приоритетных направлений науки и промышленности.
1. Общая характеристика элементов металлов
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
В атомах металлов главных подгрупп валентные электроны располагаются на внешнем энергетическом уровне, а у металлов побочных подгрупп — ещё и на предвнешнем энергетическом уровне.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны.
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Получение металлов. Нахождение их в природе

Этот видеофрагмент даёт возможность учащимся вместе с путешественником побывать в местах, где были найдены самые большие самородки металлов, он расскажет о распространённости металлов в земной коре, о некоторых исторических фактах, касающихся металлов, а также о рудах и минералах. Вместе с ним ребята побывают на дне водоёма и увидят отложения металлов, смогут представить себя в роли геолога и сравнить такие минералы, как красный, бурый и магнитный железняк. Путешественник расскажет им об основных методах получения металлов и затронет некоторые вопросы охраны окружающей среды, связанные с получением металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Получение металлов. Нахождение их в природе"
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки. Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг. Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.

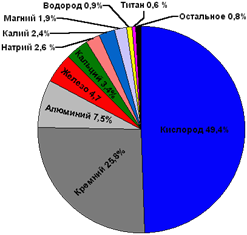
А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.
Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
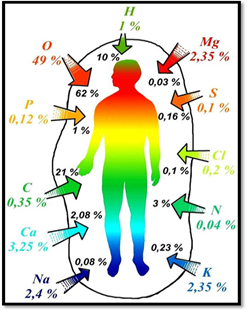
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.
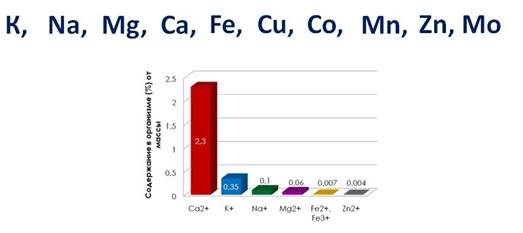
К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Химический состав
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки, густо усеивающие дно. Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой». В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.
Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
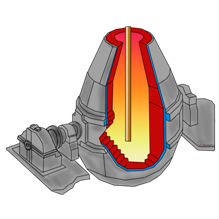
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.
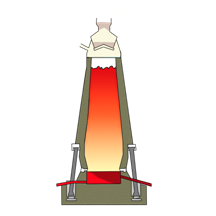
Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
Для получения некоторых металлов в качестве восстановителя используют водород.

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
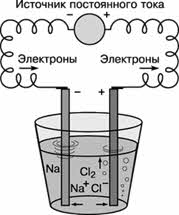
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.

Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.

При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Металлы в природе. Способы получения металлов
Конспект урока "Металлы в природе. Способы получения металлов"
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».

За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.

В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.

Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑

Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
"Металлы в природе. Общие способы получения металлов"
Презентация предназначена для учащихся 9 класса, ее можно использовать при изучение темы "Металлы", а так же при подготовке к ОГЭ. В презентации рассматривается вопрос о нахождении металлов в природе и общих способах получения металлов - прирометаллургии, гидрометаллургии, электрометаллургии и микробиологической способе.
Содержимое разработки

Металлы в природе.
Общие способы получения металлов.
Презентация к уроку. 9 класс .Химия. Антонова Ирина Павловна . Учитель химии и биологии МБОУ СОШ№8

ЦЕЛЬ УРОКА :
- Познакомиться с природными соединениями металлов и с самородными металлами; получить понятие о рудах и металлургии, рассмотреть такие ее разновидности, как пиро–, гидро–, электрометаллургия, термическое разложение соединений металлов, продемонстрировать лабораторные способы получения металлов и ознакомиться с промышленным производством металлов.
РАСПРОСТРАНЕННОСТЬ МЕТАЛЛОВ В ПРИРОДЕ
Процентное содержание металлов в морской воде:
В ПРИРОДЕ МЕТАЛЛЫ МОГУТ ВСТРЕЧАТЬСЯ
Железный метеорит




KCl • MgCl 2 • 6H 2 O


СУЛЬФАТЫ, ФОСФАТЫ, КАРБОНАТЫ

Черная- получение
железа и его
сплавов (сталь, чугун)
Цветная- получение
остальных металлов
и их сплавов

- Восстановление металлов из руд при высоких температурах с помощью восстановителей.
Соль → оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO 3 = CuO + CO 2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО 2 = 2ZnО + 2SО 2

Пирометаллургия
Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO + CO → Cu + CO 2
Водородотермия:
Cr 2 O 3 + H 2 → Cr + H 2 O
Металлотермия:
Fe 2 O 3 + Al → Fe + Al 2 O 3

- Получение металлов израстворових солей.
- Перевод нерастворимого соединения в раствор:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuSO 4 + Fe = FeSO 4 + Cu.
2NaCl → 2Na + Cl 2
MgBr 2 → Mg + Br 2
- Микробиологические методы получения металлов.

-85%
Читайте также:
