Металлы в реакциях замещения
Обновлено: 27.09.2024
Цель урока: познакомить учащихся с химическими свойствами металлов, рассмотреть ряд активности (электрохимический ряд напряжений) металлов, развивать умение наблюдать, сравнивать, анализировать, делать предположения и выводы; воспитывать ответственное отношение к учебе.
Задачи урока:
Образовательные:
- рассмотреть химическую активность металлов исходя из положения в периодической таблице Д.И. Менделеева и в электрохимическом ряду напряжения металлов;
- рассмотреть химические свойства металлов.
Развивающие:
- развивать умения составлять уравнения реакций в соответствие с химическими свойствами металлов.
Воспитательные:
- воспитывать интерес к предмету, формировать навыки поведения в коллективном и индивидуальном учебном труде.
Планируемые результаты
- знать химические свойства металлов;
- уметь составлять уравнения реакций в соответствие с химическими свойствами металлов.
- формировать уважительное отношение к чужому мнению;
- формировать ответственное отношение к учению.
Метапредметные:
Коммуникативные:
- уметь слушать собеседника и вести диалог; уметь признавать возможность существования различных точек зрения.
Регулятивные:
- продолжить развитие умения планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели.
Познавательные:
- умение определять понятия, устанавливать аналогии, строить логические заключения и делать выводы.
Тип урока: урок изучения нового материала
I Организационный момент
II Актуализация опорных знаний учащихся
1.Дайте определение реакции замещения. (Реакция замещения – это реакция между простым и сложным веществом, в результате которой атомы простого вещества замещают один из атомов в сложном веществе)
2.Какие реакции с участием металлов вам известны? (Взаимодействие металлов с растворами кислот, с солями менее активных металлов)
3.Какие реакции замещения лежат в основе реакций получения металлов? (Взаимодействие оксидов металлов с водородом, углем, алюминием, оксидом углерода( II ))
4.Являются ли реакции замещения ОВР? (Все реакции замещения являются ОВР)
5.Окислителями или восстановителями являются металлы в реакциях замещения? (Металлы являются восстановителями)
IV Мотивация учебной деятельности
Из курса химии 8 класса вы уже знаете, что металлы отличаются по своей активности, и знаете химические свойства классов неорганических соединений. Но все ли химические свойства металлов вам известны? Как вы считаете, какова цель нашего урока?
V Изложение нового материала
Химические свойства металлов
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов (Открыл и составил Н.Н.Бекетов)
Чем левее стоит металл в электрохимическом ряду напряжений металлов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно - земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящие в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Физкультминутка
Чтобы голова не болела,
Ей вращаем вправо-влево. (Вращение головой)
А теперь руками крутим –
И для них разминка будет. ( Вращение прямых рук вперед и назад)
Тянем наши ручки к небу,
В стороны разводим. (Потягивания – руки вверх и в стороны)
Плавно производим. (Повороты туловища влево и вправо)
Достаем руками пол. ( Наклоны вперед)
Потянули плечи, спинки,
А теперь конец разминке. (Дети садятся)
I Взаимодействие с простыми веществами - неметаллами
1.С кислородом большинство металлов образует оксиды – амфотерные и основные:
Щелочные металлы, за исключением лития, образуют пероксиды:
2.С галогенами металлы образуют соли галогеноводородных кислот – галогениды:
3.С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
4.С серой металлы образуют сульфиды:
5.С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
6.С углеродом образуются карбиды:
7.С фосфором – фосфиды:
II Взаимодействие со сложными веществами
1.Взаимодействие металлов с растворами кислот
Металлы, расположенные в ряду активности левее водорода взаимодействуют с растворами кислот по схеме:
Me + Hx КО → Ме x( КО )y + H2↑
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
2│Al 0 – 3e - → Al 3+ - окисление
3│2H + + 2e - → H2 – восстановление
2.Взаимодействие с водой
А) Щелочные и щелочно – земельные металлы (до Mg ) взаимодействуют с водой по схеме:
Б) Металлы от Mg до Pb взаимодействуют с водой по схеме:
Me + H 2 O → Me х O у + H 2 ↑
Металлы, стоящие в ряду активности после водорода с водой не взаимодействуют.
3. Взаимодействие металлов с солями менее активных металлов
Взаимодействие металлов с растворами солей.
В 1 пробирку налейте 2 – 3 мл раствора нитрата серебра ( I ), во 2 – 2 – 3 мл раствора сульфата меди ( II ), а в 3 – столько же раствора нитрата алюминия. В 1 пробирку положите тонкую медную проволоку, во 2 – стружку железа, а в 3 – медные стружки.
В 1 пробирке выпало серебро, во 2 пробирке выпала медь, в 3 пробирке ничего не произошло.
Вывод: металлы вытесняют только менее активные металлы из их солей.
VI Закрепление
1. Решите тестовые задания
1.Выберите группу элементов, в которой находятся только металлы:
А) Al, As, P; Б) Mg, Ca, Si; В) K, Ca, Pb
2. Укажите общее в строении атомов K и Li:
А) 2 электрона на последнем электронном слое;
Б) 1 электрон на последнем электронном слое;
В) одинаковое число электронных слоев.
3 . Металлический кальций проявляет свойства:
В) окислителя или восстановителя в зависимости от условий.
4. Металлические свойства натрия слабее, чем у –
А) магния; Б) калия; В) лития.
6. К неактивным металлам относятся:
А) алюминий, медь, цинк; Б) ртуть, серебро, медь;
В) кальций, бериллий, серебро.
2. Закончить уравнения практически осуществимых реакций, назвать продукты реакции
VII Домашнее задание
§ 41, выполнить упр. 2 стр. 14 8
VIII Рефлексия:
C какими трудностями вы столкнулись при изучении этой темы, и как вы решили эту проблему?
§ 36. Ряд активности металлов. Реакции замещения
• для металлов характерны металлический блеск, электропроводность, пластичность и т. п.
Понятие о ряде активности металлов
Во многих химических реакциях принимают участие простые вещества, в частности металлы. Металлы могут взаимодействовать почти со всеми классами неорганических соединений, которые изучаются в школьном курсе химии. Однако разные металлы проявляют разную активность в химических взаимодействиях, и от этого зависит, произойдет реакция или нет.
Чем больше активность металла, тем энергичнее он взаимодействует с другими веществами. По активности все металлы можно расположить в ряд, который называется рядом активности металлов (вытеснительным рядом металлов, рядом напряжений металлов, электрохимическим рядом напряжений металлов). Этот ряд впервые составил и изучил выдающийся украинский ученый Η. Н. Бекетов, поэтому у данного ряда есть еще одно название — ряд Бекетова.
Ряд активности металлов Бекетова выглядит так (более полный ряд см. на форзаце 2):
Николай Николаевич Бекетов (1827-1911)
Русский и украинский химик, основатель украинской школы физической химии, академик Петербургской академии наук с 1886 г. Родился в семье морского офицера. Закончил Казанский университет, работал в Петербурге в Медико-химической лаборатории. Преподавал химию цесаревичу — будущему императору Николаю II. С 1855 г. профессор императорского университета в Харькове, где по предложению ученого в 1864 г. было открыто первое в Украине физикохимическое отделение. Именно там впервые в мире он начал преподавать физическую химию как отдельную дисциплину. Бекетов открыл способ восстановления металлов из их оксидов, который и сегодня используют в металлургии, установил зависимость сродства элементов от порядкового номера, первым получил чистые оксиды щелочных элементов (Натрия, Калия), составил ряд активности металлов, который назван его именем, был автором первого в мире учебника по физической химии.
В этом ряду металлы расположены по уменьшению их химической активности в водных растворах. Таким образом, среди приведенных металлов наиболее активным является калий, а наименее активным — золото. С помощью этого ряда легко выяснить, какой металл активнее другого. Также в этом ряду находится водород. Конечно, водород не является металлом, но в данном ряду его активность принята за точку отсчета (своего рода ноль).
Взаимодействие металлов с кислотами
Металлы, расположенные в ряду активности слева от водорода, способны вступать в реакции с кислотами, в которых атомы металлических элементов замещают атомы Гидрогена в кислотах. При этом образуются соль соответствующей кислоты и водород Н2 (рис. 36.1, с. 194):
Рис. 36.1. Взаимодействие металлов с кислотами: а — алюминий; б — цинк; в — никель
Чем левее расположен металл в ряду активности, тем более бурно он взаимодействует с кислотами. Наиболее интенсивно вытесняют водород из кислот те металлы, которые расположены в самом начале ряда. Так, магний взаимодействует очень бурно (жидкость словно закипает), цинк взаимодействует значительно спокойнее, железо реагирует совсем слабо (пузырьки водорода едва образуются), а медь вовсе не взаимодействует с кислотой (рис. 36.2).
Рис. 36.2. Взаимодействие металлов с хлоридной кислотой
Если металл расположен в ряду активности справа от водорода, то он не способен вытеснять водород из растворов кислот, и потому реакция не происходит (табл. 12, с. 197):
Обратите внимание на уравнения реакций металлов с кислотами, приведенные выше: в этих реакциях атомы металлических элементов из простого вещества замещают атомы Гидрогена в кислотах. Такие реакции называют реакциями замещения.
Реакции замещения — это реакции, в которых атом элемента простого вещества вытесняет атом другого элемента из сложного вещества.
Взаимодействие нитратной и концентрированной сульфатной кислот с металлами происходит по другой схеме. В таких реакциях водород почти не выделяется, а выделяются другие продукты реакции, о чем вы узнаете в следующих классах.
Взаимодействие металлов с водой
Металлы, расположенные в ряду активности слева от водорода, способны вытеснять водород не только из растворов кислот, но и из воды. Как и в случае с кислотами, активность взаимодействия металлов с водой зависит от расположения металла в ряду активности (рис. 36.3).
Рис. 36.3. При обычных условиях натрий и кальций активно взаимодействуют с водой с выделением водорода, а цинк и железо не взаимодействуют
Металлы, расположенные в ряду активности слева от магния, взаимодействуют с водой при обычных условиях. В таких реакциях образуются щелочи и водород:
Литий взаимодействует с водой очень бурно (рис. 36.4):
Рис. 36.4. Взаимодействие лития с водой с образованием бесцветного раствора литий гидроксида
Калий реагирует с водой так бурно, что иногда случается взрыв: во время реакции выделяется настолько большое количество теплоты, что выделяемый водород загорается и вызывает воспламенение самого металла.
Кальций и натрий взаимодействуют с водой так же бурно, но без взрыва:
То, что в результате реакции активных металлов с водой образуются щелочи, можно доказать, добавив раствор фенолфталеина, который приобретает характерную малиновую окраску (рис. 36.5, с. 196).
Рис. 36.5. После взаимодействия кальция с водой добавили фенолфталеин: в растворе виден осадок кальций гидроксида, а малиновый цвет свидетельствует о наличии щелочи
Магний взаимодействует с водой по такой же схеме, что и активные металлы, но вместо щелочи образуется нерастворимое основание. Реакция протекает настолько медленно, что сначала при добавлении магния к воде никакой реакции не наблюдается — пузырьки водорода начинают выделяться лишь спустя некоторое время (рис. 36.6). Для инициирования реакции воду следует немного подогреть или проводить реакцию в кипящей воде.
Рис. 36.6. При комнатной температуре магний взаимодействует с водой очень медленно, раствор слегка мутнеет вследствие образования малорастворимого магний гидроксида
Большинство других металлов, расположенных между магнием и водородом в ряду активности, также могут взаимодействовать с водой (вытеснять из нее водород), но это происходит при более «жестких» условиях: для этого через раскаленные металлические опилки пропускают перегретый водяной пар. Конечно, при таких условиях гидроксиды разлагаются (на оксид и воду), поэтому продуктами реакции являются оксид соответствующего металлического элемента и водород:
Никель, олово и свинец пассивируются водой, поэтому ни при каких условиях с водой не реагируют.
Таблица 12. Зависимость химических свойств металлов от положения в ряду активности
Взаимодействие металлов с солями
Если соль растворима в воде, то металлический элемент в ней может быть вытеснен более активным металлом:
Например, если погрузить в раствор купрум(II) сульфата железную пластинку, через определенное время на ней выделится медь в виде красного налета:
Со временем железная пластинка покрывается довольно плотным слоем порошка меди, а раствор светлеет, что свидетельствует об уменьшении в нем концентрации купрум(II) сульфата (рис. 36.7).
Рис. 36.7. Взаимодействие раствора купрум(II) сульфата с железной пластинкой
Железо расположено в ряду активности слева от меди, поэтому атомы Феррума могут вытеснить атомы Купрума из соли. Но если в раствор купрум(II) сульфата погрузить серебряную пластину, то реакция не происходит:
Медь можно вытеснить из соли любым металлом, расположенным слева от меди в ряду активности металлов. При этом медь будет вытеснять из растворов других солей любой металл, который расположен в ряду активности справа от нее (рис. 36.8):
Рис. 36.8. Менее активное, чем медь, серебро оседает на поверхности медной проволоки. Раствор приобретает голубую окраску благодаря образованию на нем соли Купрума
Наиболее активные металлы, расположенные в самом начале ряда, — натрий, калий — не вытесняют другие металлы из растворов солей, поскольку они такие активные, что взаимодействуют не с растворенной солью, а с водой, в которой эта соль растворена.
Взаимодействие металлов с оксидами
Оксиды металлических элементов также способны взаимодействовать с металлами. Более активные металлы вытесняют менее активные из оксидов. Но, в отличие от взаимодействия металлов с солями, чтобы реакция осуществилась, оксиды необходимо расплавить:
Для получения металла из оксида можно применять любой металл, который расположен в ряду активности левее, даже самые активные натрий и калий, ведь в расплавленном оксиде воды нет:
ZnO + 2Na = Na2O + Zn
CaO + 2K = K2O + Ca
Вытеснение металлов из солей или оксидов более активными металлами иногда применяют в промышленности для получения металлов.
• Многие кислоты и другие вещества алхимики называли «спиртами» (от латин. spiritus — «дух», «запах»). Так, был spiritus sale — соляный спирт, или хлоридная кислота, spiritus nitrate — нитратная кислота и т. д. В современном химическом языке от этих названий остались только spiritus ammonia — нашатырный спирт, который является раствором аммиака NH3, и spiritus vini — винный, или этиловый, спирт.
• Горящие активные металлы (магний, натрий и др.) невозможно погасить водой. Причина заключается в том, что при контакте с водой горящий магний реагирует с ней, вследствие чего выделяется водород, который только усиливает горение.
• «Царской водкой» химики называют кислоту, которая является смесью концентрированных нитратной и хлоридной кислот. Такое название эта смесь получила потому, что с ней взаимодействует даже золото.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
20 декабря 2021
· Обновлено 20 декабря 2021
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Реакции замещения

Данный видеофрагмент объясняет учащимся сущность реакций замещения, знакомит их с рядом активности металлов, прогнозированием протекания реакций между металлами и кислотами, металлами и солями, в уроке есть несколько демонстраций, которые помогут учащимся в описании лабораторного опыта по этой теме.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Реакции замещения"
Проведем опыт английского химика Г. Кавендиша. Для этого нальем в пробирку раствор соляной кислоты и поместим туда несколько гранул цинка. Мы видим выделение пузырьков газа. Соберем этот газ методом вытеснения воздуха, т.к. выделяющийся газ, водород, легче воздуха. Когда соберется достаточное количество газа, поднесем пробирку с газом водородом к пламени спиртовки, после чего раздастся взрыв, сопровождающийся «лающим» звуком. Этот взрыв произошел из-за смешения водорода с воздухом.

Смесь 2 объёмов водорода и 1 объема кислорода называют «гремучим газом». Если собрать чистый водород и поднести пробирку к горелке, то раздастся легкий хлопок, из-за сгорания чистого водорода. Откуда в реакции водород и какие ещё продукты образуются?
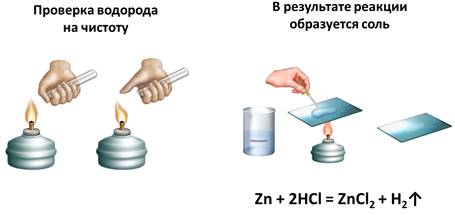
В результате этой реакции – между цинком и соляной кислотой – образуется соль (хлорид цинка). Это можно доказать, если немного этого раствора поместить на предметное стекло и выпарить. В результате вода испарится, а на стеле будут кристаллы соли. Теперь составим уравнение этой реакции: в реакцию вступает цинк и соляная кислота, в результате чего образуется соль – хлорид цинка и выделяется водород.
Zn + 2HCl = ZnCl2 + H2↑
Проведем дугой эксперимент. Нальем в четыре пробирки раствора соляной кислоты. В первую пробирку поместим кальций, во вторую – магний, в третью – цинк, в четвертую – медь. Понаблюдаем за процессом, будет ли выделение водорода во всех случаях, ведь в реакцию вступает металл и соляная кислота? Самое интенсивное выделение водорода наблюдается в первой пробирке, где был металл кальций, во второй пробирке – с металлом магнием – менее интенсивное, с цинком еще менее интенсивное, а с медью реакция не протекает, т.к. выделение водорода и вовсе не наблюдается.

Поэтому, для прогнозирования протекания реакции между металлом и кислотой, нужно использовать ряд активности металлов, или ряд напряжений металлов. Как видите, в этом ряду есть и водород, который металлом не является. Металлы, которые стоят в ряду напряжений металлов до водорода, способны вытеснять его из растворов кислот, те металлы, которые стоят в этом ряду после водорода, этой способностью не обладают.
Самые активные металлы находятся вначале ряда, менее активные – в конце. Т.к. кальций более активный, то выделение водорода в растворе кислоты шло интенсивнее, чем у магния или цинка. Медь не вытесняет водород из раствора кислот, потому как этот металл стоит в конце ряда. В этом вы сами убедились из предыдущего опыта.
Ряд активности металлов используют также для прогнозирования реакций между металлом и раствором соли. Для этого нужно знать, что более активный металл вытесняет из раствора соли менее активный.
Проведем эксперимент: поместим в химический стакан с раствором сульфата меди (II) железный гвоздь. Через некоторое время на гвозде появляется красный налет, а раствор соли изменяет свою окраску. Красный налет – это выделившаяся медь, раствор изменил окраску, т.к. в результате реакции образовался раствор сульфата железа (II).
CuSO4 + Fe = FeSO4 + Cu↓
Если цинк поместить в растворы сульфатов магния, цинка, меди и серебра, то из всех этих растворов он вытеснит только медь в виде красного налёта и серебро в виде серебристо-белого налета. Магний более активный металл, чем цинк, т.к. в ряду активности стоит левее цинка, поэтому реакция не прошла, как и реакция цинка с раствором сульфата цинка.

Если поместить медь в раствор нитрата серебра, то через некоторое время на меди появляется серебристо-белый налет из-за образовавшегося серебра. Как видим, реакция протекает, т.к. медь стоит в ряду напряжений металлов левее серебра, т.е. является более активным металлом, чем серебро.

Все рассмотренные реакции являются реакциями замещения. Теперь можно сделать вывод, что реакции замещения – это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
Урок по теме "Реакции замещения" (8 класс)
Цель: сформировать понятие о сущности реакции замещения, продолжить формирование умения записывать уравнения химических реакций на примере реакций замещения.
1. Обучающие – рассмотреть новый тип реакций – реакции замещения; научить учащихся писать уравнения реакций замещения; формировать умение предсказывать продукты реакций замещения; дать первоначальные понятия об электрохимическом ряде напряжений металлов.
2. Развивающие – развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к адекватному само- и взаимоконтролю.
3. Воспитательные – продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах «ученик–ученик», «учитель–ученик», а также наблюдательность, внимание, пытливость, инициативу.
4. Здоровьесберегающие: профилактика общего и зрительного утомления, обеспечение физиологически необходимых этапов восприятия и переработки новой информации.
Методы и методические приемы. Лабораторная работа; фронтальный опрос; самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок; работа с наглядными средствами – периодической системой химических элементов Д.И.Менделеева и карточками.
Оборудование и реактивы: карточки с заданиями для самостоятельной работы по теме «Реакции разложения и соединения», карточки с таблицей «Классификация реакций на основании количества и состава реагирующих веществ», лабораторный штатив с пробирками, кристаллизатор, прибор для получения водорода, лучинка, спички; цинк и в гранулах, железный гвоздь, медная проволока, растворы – соляной кислоты, хлорида меди (II), хлорида железа (II).
1. Организационный момент.
Учитель. Думаю, что урок вам понравится, вы узнаете много нового. Сегодня вы не соскучитесь, потому что сами будете проводить опыты. Но для начала проверим материал прошлого урока.
2. Актуализация знаний о реакциях разложения и соединения.
Проводится фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений.
Учитель. На прошлом уроке вы познакомились с химическими реакциями. С реакциями каких типов вы познакомились?
Ученик. С реакциями разложения и соединения.
Учитель. Дайте определение реакции разложения.
Ученик. Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель. Какая реакция называется реакцией соединения?
Ученик. Реакцией соединения называется реакция, в результате которой из двух или более простых или сложных веществ образуется одно сложное вещество.
Учитель. Для чего в схемах химических реакций расставляют коэффициенты?
Ученик. Для того, чтобы соблюдался закон сохранения массы веществ.
Учитель проверяет домашние упражнения, выполненные на доске, ученики задают дополнительные вопросы отвечающим, выставляются оценки.
Учитель. Следующий этап урока – самостоятельная работа на два варианта.
Самостоятельная работа (8–10 мин)
Задание. Расставьте коэффициенты, укажите типы химических реакций.
Максимально можно набрать 6 баллов (по 1 баллу за правильно указанный тип химической реакции и по 1 баллу за правильно расставленные коэффициенты).
После выполнения заданий учащиеся, сидящие за одной партой, обмениваются работами. Ученики взаимно проверяют работы, им выставляют отметки по вышеуказанным критериям.
Учитель. Сейчас вы познакомитесь еще с одним типом химических реакций – реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться, потренируетесь в расстановке коэффициентов.
3. Изучение нового материала.
Учитель. Какие ассоциации вызывает у вас название «реакция замещения»?
Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим.
Учитель. Каким по составу – простым или сложным – должно быть вещество, которое замещает элемент сложного вещества?
Учитель. Каким должен быть состав вещества, в котором происходит замещение?
Ученик. Это вещество должно быть сложным, чтобы атомы одного элемента могли замещаться, а атомы других элементов остались.
Учитель. Обозначим простое вещество буквой А, а сложное вещество – двумя буквами – ВС. Как в этом случае записать общую схему реакции замещения?
Ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в тетради.
Учитель. Реакцией замещения называется реакция, в которой участвуют одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуются новые вещества – простое и сложное (запись определения в тетрадь).
Реакция замещения – это взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества
Рассмотрим на практике реакции замещения. Для этого проведем лабораторную работу. (Учащиеся получают карточки с таблицей (табл. 1) для составления отчета по лабораторной работе «Реакции замещения»). В карточке заполнена графа, дающая представление о том, что нужно сделать. Две другие графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспомните, что работать с растворами кислот нужно осторожно, т. к. они опасны. С растворами работайте по принципу «не разлей», с твердыми веществами – по принципу «не рассыпь». Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Лабораторная работа «Реакции замещения»
(что нужно сделать)
(что увидели)
химических реакций,
Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу цинка.
Выделяются пузырьки газа
Произошла химическая реакция:
Это реакция замещения, цинк вытеснил водород из соляной кислоты
Налейте в пробирку раствор хлорида меди(II), опустите в раствор железный гвоздь.
Гвоздь покрывается красным налетом.
Это реакция замещения, железо вытеснило медь из раствора соли
Налейте в пробирку раствор хлорида железа(II) и опустите в раствор медную проволоку
Никаких изменений не происходит
Эта реакция невозможна:
FeCl2 + Cu → Менее активная медь не может вытеснить более активное железо из раствора соли
Фронтальная беседа (обсуждение результатов опыта)
Учащиеся выполняют опыт № 1.
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, поскольку выделился газ.
Учитель. Чтобы составить уравнение химической реакции, надо предположить, какие вещества образовались в результате этой реакции. (Учитель у доски объясняет принцип составления уравнений реакций такого типа и предлагает учащимся самостоятельно расставить коэффициенты.)
Из уравнения реакции видно, что получился газ водород. Открою вам маленький секрет: вы сейчас прошли тем же путем, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории.
Но водород еще нужно собрать. Догадайтесь, как собрать водород в другую пробирку.
Правило при работе с кислотами: «Не разлей!»
Ученик. Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку.
Учитель. Что находится в пустой пробирке?
Учитель. В пробирку, в которую собирают водород, необходимо перевернуть вверх дном, т.к. водород легче воздуха. Такой способ собирания газов называется способом вытеснения воздуха.
Учитель проводит демонстрационный опыт. после этого учащиеся приступают к самостоятельному выполнению опыта № 2.
Учитель. Составьте уравнение этой химической реакции и расставьте в нем коэффициенты. Сравните скорости взаимодействия магния и цинка с соляной кислотой.
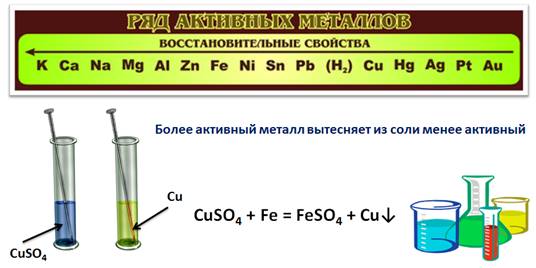
Учитель. Одинаково ли металлы взаимодействуют с кислотами? (Ответ учеников). Чтобы убедиться, что металлы с разной скоростью взаимодействуют с кислотами рассмотрите рис. 101 на с. 161 учебника. Что вы наблюдаете? (Ответ учеников). Объясните увиденное. (Ответ учеников). Оказывается, скорость взаимодействия металла с кислотой зависит от активности металла. Все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов. Посмотрите, какой неметалл занесен в этот ряд. (Учитель указывает на с. 162 учебника и на стенд в кабинете: Ряд активности металлов)
Ученик. Неметалл в ряду металлов – водород.
Учитель. Металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Будет ли медь вытеснять водород из раствора соляной кислоты?
Ученик. Нет, такая реакция невозможна, т.к. медь находится в электрохимическом ряду напряжений металлов за водородом.
Вывод: если металл, стоящий в электрохимическом ряду напряжений до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет.
Учитель демонстрирует опыты, подтверждающие выдвинутую гипотезу, и делает вывод, что электрохимический ряд напряжений металлов позволяет не только предсказывать продукты реакции, но и определять возможность протекания той или иной реакции.
Учащиеся выполняют опыты № 2 и 3.
Учитель. Что вы наблюдали при проведении этих опытов?
Ученик. В первой реакции гвоздь покрылся красным налетом меди, а во второй никаких изменений не произошло.
Учитель. Почему невозможна вторая реакция?
Ученик. Медь в электрохимическом ряду напряжений металлов находится правее железа, значит, она менее активна и не может его вытеснить.
Учитель. Запишите уравнения взаимодействия железа с хлоридом меди (II).
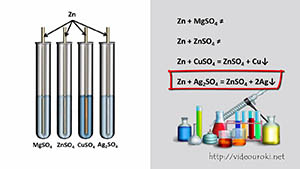
Учитель. Всегда ли это правило справедливо. На с. 162 рис. 103 вы видите как взаимодействует цинк с различными солями серной кислоты. Что вы наблюдаете? (Ответы детей)
Вывод: если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли.
4. Закрепление изученного материала
Учитель. Итак, сегодня вы познакомились еще с одним типом химических реакций – реакциями замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнения.
На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие – нет. Дайте развернутый ответ. (Спрашивать по одному ученику на составление каждого уравнения реакции.)
Задание. Расставьте коэффициенты в схемах возможных химических реакций.
5. Заключительная часть. Учитель подводит итоги урока, анализирует полученные результаты.
Читайте также:
