Металлы в земной коре
Обновлено: 05.07.2024
Первые пять мест в земной коре (по массе вещества) занимают следующие элементы: кислород, кремний, алюминий, железо и кальций. На 1 тонну земной коры приходится кислорода 466 кг,
кремния 277,2 кг, алюминия 81,3 кг, железа 50 кг и кальция 36,3 кг. Общая масса этих пяти элементов в одной тонне земной коры составляют около 92% в массе земной коры. На остальные 101 элемент приходится чуть больше 8% ее массы.
Примечательно, что из этих пяти элементов два, занимающих оба первые места, вовсе не являются металлами, а их суммарное количество составляет почти три четверти массы земной коры. Таким образом, на долю алюминия, железа и всех остальных 77 металлов приходится меньше одной четвертой части массы земной коры.
Итак, из восьми десятков металлов, наибольшее количество в земной коре алюминия (более 8%). Парадоксально, но факт, что металл, которого больше всего в земной коре, был открыт намного позже большинства других.
Содержащие алюминий квасцы были известны в древности. О них упоминается в сочинениях древнеримского историка Плиния Старшего. Кстати, квасцы по латыни и назывались «алумен». Средневековый ученый, врач и естествоиспытатель Парацельс нашел, что квасцы представляют собой «соль некоей квасцовой земли». Через девять лет после смерти Парацельса химик Маркграф сумел выделить «квасцовую землю» — глинозем (окись алюминия Al2O3). Во времена Ломоносова было высказано предположение о том, что в составе квасцов должен быть неизвестный химический элемент. Поисками его и занялся в 1808 году молодой английский ученый Гемфри Деви. Он даже назвал этот элемент алюминием, но получить алюминий так и не смог. 17 лет алюминий существовал лишь в названии. В 1825 году датчанин Эрстед и в 18127 году немец Велер сумели получить первые крупицы этого металла. И только в 1864 году французскому химику Сент-Клер-Девилю удалось получить первый промышленный алюминий. Через 11 лет русский химик Н. Н. Бекетов создал более экономичный способ получения алюминия из глинозема. Этот способ применяли во Франции и Германии до конца XIX века. Но полученный и по этому способу алюминий был по стоимости равноценен золоту.
Наполеон III и члены его семьи, например, во время банкетов пользовались алюминиевыми вилками и ложками, в то время как всем остальным оставалось пользоваться золотыми и серебряными приборами, как более дешевыми.
Лишь после того как русский капитан А. Ф. Можайский создал первый в мире аэроплан, а другой русский капитан О. С. Костович попытался вместо паровой машины поставить на управляемый аэростат двигатель внутреннего сгорания, судьба алюминия была решена. Оказалось, что это именно тот металл, который нужен авиации. Строительство самолетов в первом десятилетии нашего века вызвало к жизни развитие металлургии алюминия, совершенствование его производства и резкое снижение стоимости.
В 18®9 году английское Королевское общество чествовало Дмитрия Ивановича Менделеева в связи с 20-летием открытия им периодического закона. Менделееву были преподнесены весы, изготовленные из алюминия и золота.
В 1604 году русская научная общественность готовилась к 70-летнему юбилею Д. И. Менделеева. Была собрана большая сумма денег. Деньги были переведены ювелирной фирме. Ей было заказано изготовить большую вазу с розами. Лепестки роз требовалось изготовить из золота, а вазу и листья — из алюминия. Два драгоценных металла!
Теперь после железа, алюминий — самый дешевый металл.
Мировое производство алюминия резко увеличилось за последние годы. Оно намного опередило производство меди, олова1, свинца и других металлов. После чугунного и стального, алюминиевое литье теперь самое распространенное во всем мире.
Металлы в земной коре
Металлы как химические элементы

Подавляющее большинство (93 из 117) известных в настоящее время химических элементов относится к металлам.
Атомы различных металлов имеют много общего в строении, а образуемые ими простые и сложные вещества имеют схожие свойства (физические и химические).
Положение в периодической системе и строение атомов металлов.
В периодической системе металлы располагаются левее и ниже условной ломаной линии, проходящей от бора к астату (см. таблицу ниже). К металлам относятся почти все s-элементы (за исключением Н, Не), примерно половина р-элементов, все d— и f-элементы (лантаниды и актиниды).
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых атомов р-элементов (Sn, Pb, Bi, Ро) их больше (от четырех до шести). Валентные электроны атомов металлов слабо (по сравнению с атомами неметаллов) связаны с ядром. Поэтому атомы металлов относительно легко отдают эти электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы:
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8.
Легкость, с которой атомы металла отдают свои валентные электроны другим атомам, характеризует восстановительную активность данного металла. Чем легче атом металла отдает свои электроны, тем он более сильный восстановитель. Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов (см. таблицу ниже).
Распространенность металлов в природе.
В первую тройку наиболее распространенных в земной коре (это поверхностный слой нашей планеты толщиной примерно 16 км) металлов входят алюминий, железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
железо и кальций. Менее распространены натрий, калий, магний. В таблице ниже приведены массовые доли некоторых металлов в земной коре.
Распространенность металлов в земной коре
| Металл | Массовая доля в земной коре, % | Металл | Массовая доля в земной коре, % |
|---|---|---|---|
| Al | 8,8 | Cr | 8,3 ∙ 10 -3 |
| Fe | 4,65 | Zn | 8,3 ∙ 10 -3 |
| Ca | 3,38 | Ni | 8 ∙ 10 -3 |
| Na | 2,65 | Cu | 4,7 ∙ 10 -3 |
| K | 2,41 | Pb | 1,6 ∙ 10 -3 |
| Mg | 2,35 | Ag | 7 ∙ 10 -6 |
| Ti | 0,57 | Hg | 1,35 ∙ 10 -6 |
| Mn | 0,10 | Au | 5 ∙ 10 -8 |
Элементы, массовая доля которых в земной коре составляет менее 0,01 %, называются редкими. К числу редких металлов относятся, например, все лантаниды. Если элемент не способен концентрироваться в земной коре, т. е. не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам. Рассеянными, например, являются следующие металлы: Sc, Ga, In, Tl, Hf.
В 40-х годах XX в. немецкие ученые Вальтер и Ида Нолла к высказали мысль о том. что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы. Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа ученые все больше убеждаются в справедливости этих слов.
Поскольку все живые организмы находятся в тесном контакте с окружающей средой, то и в каждом из них должны содержаться если не все, то большая часть химических элементов периодической системы. Например, в организме взрослого человека массовая доля неорганических веществ составляет 6 %. Из металлов в этих соединениях присутствуют Mg, Са, Na, К. В составе многих ферментов и иных биологически активных органических соединений в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Сг и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия. Потребность в ионах натрия настолько велика, что их необходимо специально добавлять в пищу. Значительная потеря ионов натрия (в виде NaCl с мочой и потом) неблагоприятно сказывается на здоровье человека. Поэтому в жаркую погоду врачи рекомендуют пить минеральную воду. Однако и избыточное содержание соли в пище негативно сказывается на работе наших внутренних органов (в первую очередь, сердца и почек).
Курс минералогии
Главным объектом геологических, в том числе минералогических, исследований является земная кора , под которой подразумевается самая верхняя оболочка земного шара, доступная непосредственному наблюдению.
Наши фактические знания о строении и химическом составе земной коры основываются почти исключительно на наблюдениях над самыми поверхностными частями нашей планеты.
Горообразующие процессы, совершавшиеся в различные геологические эпохи и приводившие к образованию высоких горных хребтов, подняли из глубины самые различные породы, не образующиеся вблизи поверхности Земли. Наиболее глубинные по происхождению горные породы из доступных прямому изучению — мантийные ксенолиты, обнаруживаемые в трубках взрыва, — являются объектом пристального внимания исследователей. Их изучение дает возможность, как показывают геологические наблюдения и подсчеты, получить более или менее реальное представление о составе и строении земного шара только до глубины 100–150 км (радиус же его превышает 6300 км).
О строении и составе глубоких недр земного шара можно судить лишь на основании косвенных данных. Как показывает сопоставление плотностей всего земного шара (5,527) и земной коры (2,7–2,8), внутренние части нашей планеты должны обладать значительно большей плотностью, чем поверхностные. Различные данные (геофизические наблюдения, данные сравнения Земли с другими космическими телами, состав метеоритов и пр.) дают основания предполагать, что это обстоятельство обусловлено не только увеличением с глубиной давления, но и изменением состава внутренних частей нашей планеты.
Согласно современным моделям, построенным на основании геофизических данных, в строении Земли выделяется несколько концентрических оболочек (геосфер, рис. 3), различающихся по физическим свойствам и составу (табл. 1).
Таблица 1. Характеристики геосфер Земли
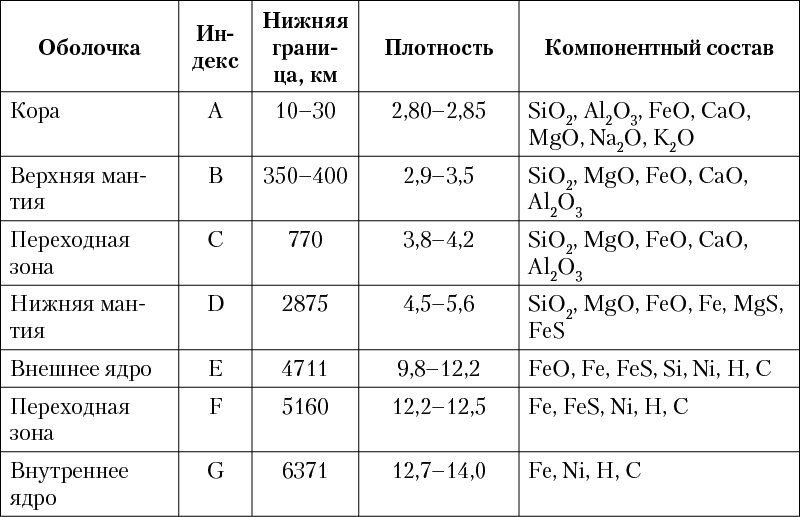
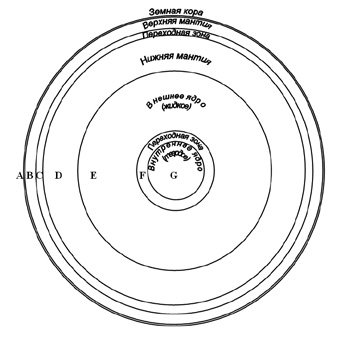
Рис. 3. Схема внутреннего строения Земли
(мощность земной коры отражена вне масштаба)
Состав земной коры
Впервые состав твердой части земной коры в весовых процентах подсчитал американский исследователь Ф. Кларк в 1889 г. Большая работа по уточнению полученных цифр была проделана В. И. Вернадским, А. Е. Ферсманом, И. и В. Ноддаками, Г. Гевеши, В. М. Гольдшмидтом и А. П. Виноградовым. Последний подсчитал средний химический состав лишь литосферы (без учета гидросферы и атмосферы).
По предложению акад. Ферсмана средние цифры содержаний отдельных элементов земной коры стали называть «числами Кларка», или просто кларками. Он же предложил выражать эти величины не только в весовых процентах, но и в атомных.
Из более чем 100 химических элементов, приведенных в периодической таблице элементов Менделеева (табл. 2), лишь немногие широко распространены в земной коре. Такие элементы в таблице располагаются преимущественно в верхней ее части, т. е. относятся к числу элементов с малыми порядковыми номерами.
Таблица 2. Периодическая система элементов Д. И. Менделеева
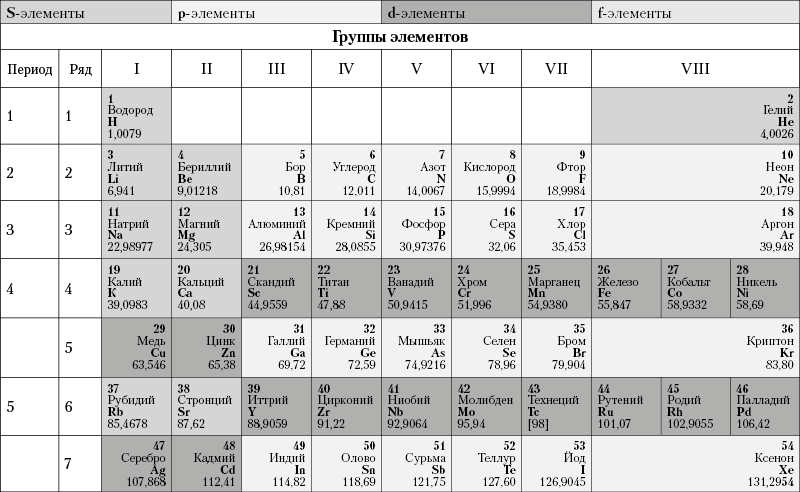
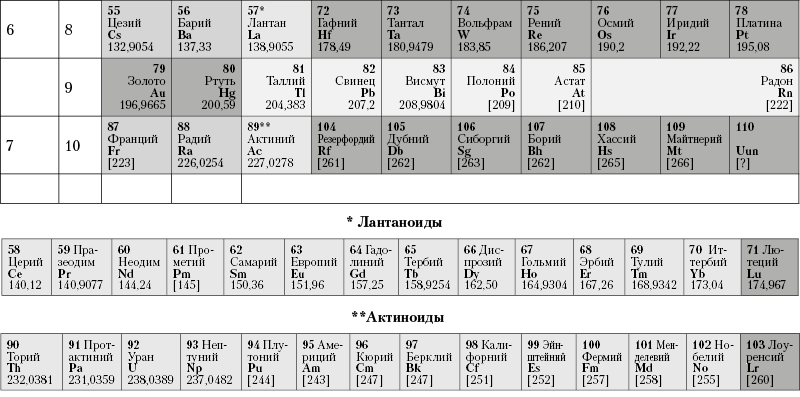
Наиболее распространенными элементами являются: О, Si, Al, Fe, Ca, Na, К, Mg, Ti, H и С. На долю всех остальных элементов, встречающихся в земной коре, приходится всего лишь несколько десятых процента (по весу). Подавляющее большинство этих элементов в земной коре присутствует почти исключительно в виде химических соединений. К числу элементов, встречающихся в самородном виде, относятся очень немногие. Те и другие возникают в результате химических реакций, которые протекают в земной коре при различных геологических процессах, приводящих к образованию самых разнообразных по составу массивов горных пород и месторождений полезных ископаемых.
Если главнейшие элементы расположить в порядке их процентного (весового) содержания в земной коре на группы по декадам 1 , то получится такая картина (табл. 3).
Таблица 3. Средний химический состав литосферы в вес. %
(по А. П. Виноградову, 1949, с уточнениями)*
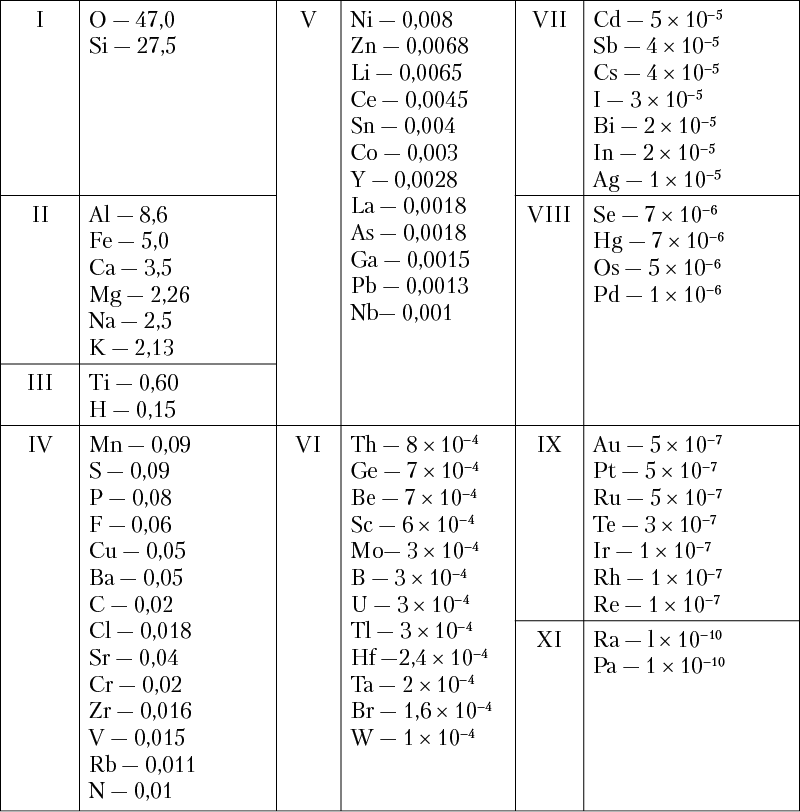
* В таблице приведены не все элементы из группы редких земель, а также благородные газы, количественные определения которых ненадежны. Данные для первых восьми элементов, а также для серы исправлены согласно последним указаниям А. П. Виноградова.
Из таблицы 3 видно, что подавляющая масса минералов земной коры должна представлять соединения элементов первых двух декад, на долю которых в весовом выражении приходится основная масса. В самом деле, в земной коре чрезвычайно широко распространены кислородные соединения кремния, алюминия, железа, а также щелочноземельных и щелочных металлов — кальция, магния, натрия и калия. К их числу относятся главным образом окислы и кислородные соли (преимущественно силикаты, алюмосиликаты, карбонаты, сульфаты и др.), входящие в состав различных горных пород, слагающих земную кору.
Кларки тяжелых металлов, играющих большую роль в промышленности, в подавляющем большинстве выражаются ничтожными величинами и попадают в последние столбцы элементов, разбитых на декады по степени распространения (табл. 4).
Таблица 4. Распространенность главных металлов в земной коре
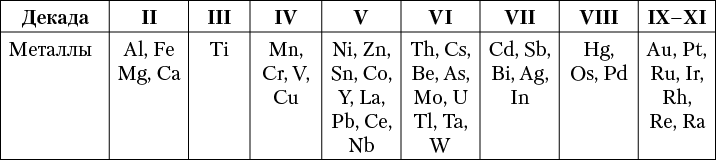
Некоторые особенности распределения тяжелых металлов в земной коре
Многие из указанных редких в земной коре элементов под влиянием совершающихся в природе геохимических процессов нередко образуют исключительно богатые скопления минерального вещества, носящие название рудных месторождений. Если бы не существовало процессов, приводящих к образованию таких месторождений, которые имело бы смысл разрабатывать с целью извлечения ценных для промышленности металлов, то можно с уверенностью сказать, что не было бы и столь мощного развития техники и культуры, какое наблюдается в настоящее время.
Тогда многие металлы, извлеченные из пород в лабораторных условиях, являлись бы исключительно дорогими. Весьма характерно, что кларки таких металлов, как ванадий, цезий, галлий и др., во много раз выше кларков ртути, висмута, серебра, золота и др. Но, несмотря на их весьма ценные свойства, они не распространены в человеческом быту, так как их месторождения с промышленными концентрациями в природе крайне редки.
Природные соединения тяжелых металлов представляют собой в основном сравнительно простые соединения. Часть этих элементов (Fe, Mn, Sn, Сr, W, Nb, Та, Th, U) преимущественно распространена в виде кислородных соединений, но зато многие другие элементы (Fe, Ni, Co, Zn, Cu, Pb, Hg, Mo, Bi, As, Sb, Ag и пр.) встречаются главным образом в виде скоплений сернистых, мышьяковистых и сурьмянистых соединений. Железо совмещает в себе свойства сидерофильных, литофильных и халькофильных элементов, обладая заметным сродством как с кислородом, так и с серой.
На диаграмме (рис. 4) по оси абсцисс расположены порядковые номера химических элементов, а по оси ординат — логарифмы их атомных кларков. Можно видеть, что с увеличением порядкового номера кривые кларков как четных, так и нечетных элементов в общем обнаруживают тенденцию к понижению. Это означает, что для большинства химических элементов имеет место обратно пропорциональная зависимость их среднего содержания в земной коре от порядкового номера, хотя встречаются и исключения (например, для Li, Be, В и др.).
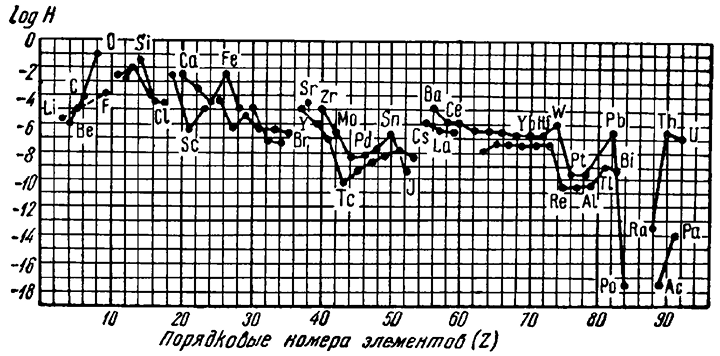
Рис. 4. Распространенность элементов в верхней части литосферы. На диаграмме даны логарифмы атомных кларков (H) как функция порядкового номера (Z), причем кислород принят за единицу
Если сравнить распространенность химических элементов в земной коре в атомных кларках с числами минералов, в которые они входят (табл. 5), то, как указал П. П. Пилипенко, между ними, за небольшим исключением, устанавливается некоторая прямая (симбатная) зависимость. Это имеет место преимущественно для элементов, обладающих малым атомным весом 2 .
Таблица 5. Взаимосвязь числа минералов
легких элементов и их атомных кларков
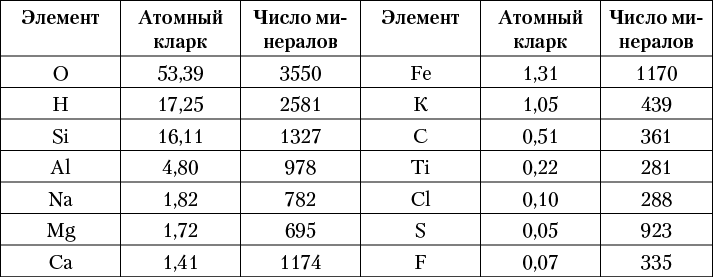
Некоторые из легких элементов играют особую роль в минералах, являясь типичными анионами или анионообразователями. Среди таких элементов прежде всего можно отметить кислород, а также водород (как компонент гидроксильного иона), серу, углерод и некоторые другие. Так как подавляющее большинство минералов являются полярными соединениями, в составе каждого из них должны присутствовать элементы, играющие роль катионов и анионов. Типичных анионов и анионообразователей среди элементов периодической системы гораздо меньше, чем катионообразующих элементов, поскольку металлы составляют около 3 / 4 всех элементов. По этой причине каждый из немногих элементов-анионообразователей будет представлен в относительно большем числе минералов по сравнению с элементами, атомы которых играют роль катионов. Этим объясняется столь значительное количество минералов — кислородных соединений, а также водосодержащих минералов и сульфидов. Для большинства распространенных элементов-металлов (главным образом легких и средних атомных весов) число минеральных видов проявляет устойчивую пропорциональность их атомным кларкам.
Для многих тяжелых металлов подобная зависимость не устанавливается. Так, теллур, атомный кларк которого в земной коре примерно в 40 раз меньше, чем кларк селена, в природных условиях образует около 150 самостоятельных минералов, в то время как для селена их известно всего около 100, и то главным образом в ассоциации с серой. Для цинка с атомным кларком в 17 раз большим по сравнению с кларком свинца мы имеем около 250 минералов, тогда как для свинца — около 450, и т. д.
Указанные различия, несомненно, вызываются химическими свойствами самих элементов, обусловленными строением их ионов и определяемыми положением этих элементов в периодической системе Менделеева. Для элементов с одинаковыми свойствами, аналогичными строением и размерами ионов, но с различными концентрациями в данном растворе или расплаве естественно ожидать, что при кристаллизации элементы с меньшей концентрацией будут входить в кристаллические структуры, образуемые господствующими элементами, как бы растворяясь в них. Если же данный элемент в окружающей среде не находит аналогичных себе по размерам и строению ионов других элементов, то в каком бы количестве он ни присутствовал в растворе при кристаллизации, он должен образовать самостоятельное соединение. Весьма показательно, что двухвалентный марганец в главной своей массе входит в состав минералов в виде изоморфной примеси к двухвалентным железу и кальцию, но зато четырехвалентный марганец всегда образует явно индивидуализированные соединения. Этим же объясняется то, что такие элементы, как рубидий, скандий, гафний, индий, рений и др., обладающие низкими атомными кларками, в природе образуют лишь несколько самостоятельных минералов, преимущественно же находятся в рассеянном состоянии, присутствуя в виде изоморфной примеси к другим элементам. В значительной мере это относится и к таким более распространенным элементам, как селен, ванадий, цезий, кадмий и др. Наоборот, элементы с очень низкими атомными кларками — теллур, золото, группа платиновых металлов, висмут и др. — сравнительно часто устанавливаются в виде самостоятельных минералов.
1 От греч. дека — десять.
2 В число минералов не включены лишь разновидности, в которые данный элемент входит в виде изоморфной примеси.
Читайте также:
