Многие металлы при различных температурах имеют различное кристаллическое строение
Обновлено: 05.07.2024
Изучение металлов в соответствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур:
А1 – кубическая гранецентрированная решетка (ГЦК)
Кубической гранецентрированной решеткой обладают следующие металлы: g - Fe, Al, Cu, Ni, a - Co, Pb, Ag, Au, Pt и др.
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис.1.5).
Каждый атом в этой решетке окружен 12-ю ближайшими соседями, располагающихся на одинаковых расстояниях, равных = 0,707×а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12-ти называется координационным числом кристаллической решетки. Кроме этих ближайших атомов, в кристаллической решетке имеется 6 атомов, удаленных на значительно большие расстояния, равные а.
Рассматриваемая кристаллическая решетка имеет два вида пустот, (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах) образующих твердые растворы внедрения.
Наибольшие междоузлия или пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК решетки, занимающими места в вершинах правильного октаэдра. В связи с этим, они называются октаэдрическими пустотами (рисунок 1.5, б). Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке g - Fe.
Кроме этих пустот в ГЦК решетке имеются более мелкие пустоты, называемые тетраэдрическими, в связи с тем, что их окружают 4 атома. Всего в ГЦК решетке 8 тетраэдрических пустот (рисунок 1.5, в).
Размеры тетраэдрических и октаэдрических пустот можно ощутить, если предположить, что решетка построена из жестких шаров, радиусом r, соприкасающихся друг с другом; в этом случае в имеющиеся промежутки можно было бы поместить сферы, радиусом 0,41 r и 0,225 r соответственно для октаэдрической и тетраэдрической пустот.
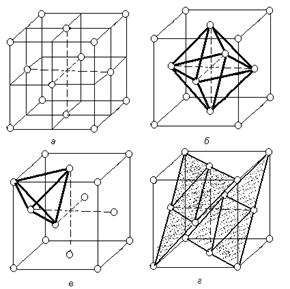 |
| Рисунок 1.5. Гранецентрированная кубическая решетка (а), размещение в ней октаэдрических (б) и октаэдрических (в) пустот; г - расположение плотноупакованных плоскостей (111) |
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба являются плоскости изображенные на рисунке. Их условное обозначение (рисунок 1.5., г).
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы a - Fe, хром, вольфрам, молибден, ванадий, натрий, литий и другие. Структура А2 является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рисунок 1.6).
Каждый атом в этой ячейке имеет 8 ближайших соседей, располагающихся на расстоянии где, а – длина ребра куба. Следовательно, координационное число решетки равно 8. Иногда его обозначают (8 + 6), т.к. следующие по удаленности атомы расположено на расстоянии а, число их равно 6.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рисунок 1.6, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рисунок 1.6, г). Если структуру ОЦК решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические - 0,154 r.
 |
| Рисунок 1.6. Объемноцентрированная кубическая решетка (а), размещение в ней наиболее плотной системы плоскостей (110) б; тетраэдрических (в) и октаэдрических (г) |
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК.
Внедрение других атомов в октаэдрическую пору ОЦК решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки a - Fe.
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства (рисунок 1.6.б). В этих плоскостях имеются 2 направления, в которых жесткие шары могут соприкасаться.
Гексагональной плотноупакованной решеткой А3 (ГПУ) обладают такие металлы, как Zn, b - Co, Cd, Mg, a - Ti, a - Zr.
Гексагональная решета построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояиях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рисунок 1.7).
 |
| Рисунок 1.7. Гексагональная плотноупакованная решетка (ГПУ): а - расположение атомов; б - выделенные типы пустот в решетке: октаэдрическая (вверху) и тетраэдрическая (внизу) |
Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки через с. Шесть ближайших соседей, расположенных в смежных слоях будут также находиться на расстоянии, а от данного атома, если отношение осей с/а составит, то такая структура называется идеальной плотноупакованной. Причем координационное число в этом случае, также как и в ГЦК решетке, равно 12.
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси С. В гексагональной плотноупакованной решетке, также как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рисунок 1.7, б).
Диаметры жестких сфер, которые могут быть помещены в эти пустоты также как и для ГЦК равны 0,41 r и 0,225 r.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК решетки (рисунок 1.8, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК решетке: АВСАВС (рисунок 1.8, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна и, в связи с этим, последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, так называемых дефектов упаковки.
Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рисунок 1.8).
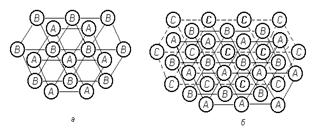 |
| Рисунок 1.8. Схема расположения плотноупакованных атомных слоев в решетках: а - ГПУ; б - ГЦК |
Углерод в виде алмаза, кремний, германий, a - олово (серое) имеют двойную кубическую решетку типа алмаза (рисунок 1.9). Она отличается от ГЦК решетки наличием в четырех из восьми тетраэдрических пустот дополнительно четырех атомов. В результате, структура оказывается более рыхлой.
Каждый атом алмаза окружен лишь четырьмя ближайшими соседями, располагающимися в углах правильного тетраэдра. Координационное число такой структуры равно 4.
Как было показано выше, одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела.
| Рисунок 1.9. Кристаллическая решетка алмаза |
В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы a - Fe с объемно-центрированной кубической решеткой в высокотемпературную форму g - Fe с гранецентрированной кубической решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С g - Fe в d - Fe с объемно-центрированной кубической решеткой, аналогичной a - Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются a - Ti, a - Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются b - Ti и b - Zr, обладающие объемно-центрированной решеткой.
Как вы видели, аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава претерпевающего аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла. Температура перехода называется критической точкой превращения. При температуре (Т0) наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева при нагреве.
Аллотропическое превращение происходит, так же как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии.
Кристаллическая структура металлов
Строение металлов
В технике под металлами понимают вещества, обладающие комплексов металлических свойств: характерным металлическим блеском, высокой электропроводностью, хорошей теплопроводностью, высокой пластичностью.
Кристаллические решетки. Все вещества в твердом состоянии могут иметь кристаллическое или аморфное строение. В аморфном веществе атомы расположены хаотично, а в кристаллическом — в строго определенном порядке. Все металлы в твердом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой,
На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток. В кубической объемно-центрированной решетке (рис. 2, а) атомы расположены в ушах ячейки и один атом в центре куба.
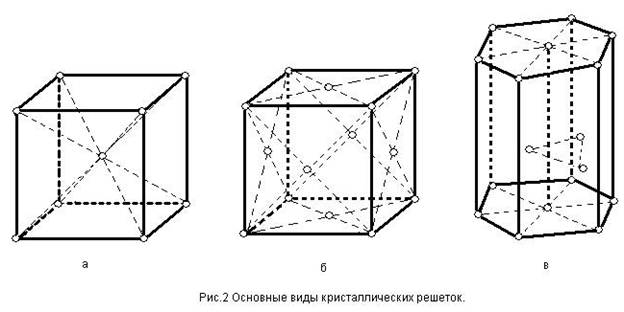
Такую решетку имеют хром, вольфрам, молибден и др. В кубической гранецентрированной решетке (рис. 2, б) атомы расположены в вершинах куба и в центре каждой грани. Эту решетку имеют алюминий, медь, никель и другие металлы. В гексагональной плотноупакованной решетке (рис. 2, в) атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома в середине призмы. Такой тип решетки имеют магний, цинк и некоторые другие металлы.
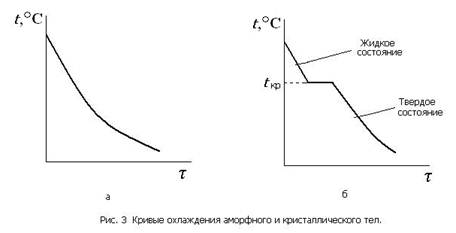
Кристаллизация металлов. Процесс образования в металлах кристаллической решетки называется кристаллизацией. Для изучения процесса кристаллизации строят кривые охлаждения металлов, которые показывают изменение температуры (t) во времени (τ). На рис. 3 приведены кривые охлаждения аморфного и кристаллического веществ. Затвердевание аморфного вещества (рис. 3, а) происходит постепенно, без резко выраженной границы между жидким и твердым состоянием- На кривой охлаждения кристаллического вещества (рис. 3, б) имеется горизонтальный участок с температурой tкр, называемой температурой кристаллизации. Наличие этого участка говорит о том, что процесс сопровождается выделением скрытой теплоты кристаллизации. Длина горизонтального участка — это время кристаллизации.
Кристаллизация металла происходит постепенно. Она объединяет два процесса, происходящих одновременно: возникновение центров кристаллизации и рост кристаллов. В процессе кристаллизации когда растущий кристалл окружен жидкостью, он имеет правильную геометрическую форму. При столкновении растущих кристаллов их правильная форма нарушается (рис. 4). После окончания кристаллизации образуются кристаллы неправильной
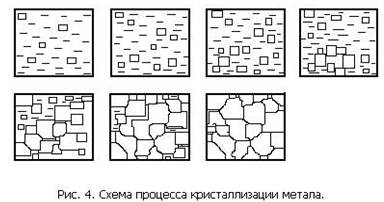
формы, которые называются зернами или кристаллитами. Внутри каждого зерна имеется определенная ориентация кристаллической решетки, отличающаяся от ориентации решеток соседних зерен.
Полиморфизм. Некоторые металлы в зависимости от температуры могут существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением. Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре. Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Важное значение имеет полиморфизм железа. На рис. 5 изображена кривая охлаждения железа.
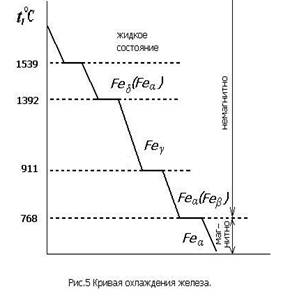
Полиморфные превращения характеризуются горизонтальными участками на кривой охлаждения, так как при них происходит полная перекристаллизация металла. До 911°С устойчиво Feα, имеющее кубическую объемноцептрированную решетку. В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ. Остановка на кривой охлаждения при 768 °С связана не с полиморфным превращением, а с изменением магнитных свойств. До 768 °С железо магнитно, а выше — немагнитно.
Дефекты кристаллического строения. Реальный металлический кристалл всегда имеет дефекты кристаллического строения. Они подразделяются на точечные, линейные и поверхностные (рис. 6).
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а), а также замещенные атомы примеси (рис. 6, б) и внедренные атомы (рис. 6, в) которые могут быть как примесными, так и атомами основного металла.
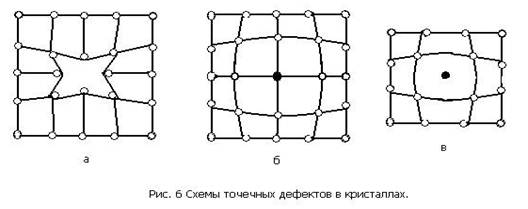
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями. Краевая дислокация (рис. 7) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости.
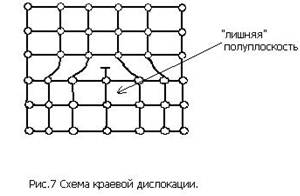
Поверхностные дефекты малы только в одном измерении. К ним относятся, например, границы между отдельными зернами или группами зерен.
Наклеп и рекристаллизация. При пластической деформации изменяется не только форма и размеры металла, но также его внутреннее строение и механические свойства. Зерна разворачиваются, деформируются и сплющиваются, вытягиваясь в направлении деформации. Образуется волокнистая структура. При этом прочность и твердость металла повышаются, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом.
Волокнистое строение и наклеп могут быть устранены при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве (до 300…400 °С для железа). Но волокнистая структура при этом сохраняется. При нагреве до более высокой температуры в металле происходит образование новых равноосных зерен. Этот процесс называется рекристаллизацией. Наклеп при этом снимается полностью.
Температура, при которой начинается процесс рекристаллизации называется температурой рекристаллизации. Абсолютная температура рекристаллизации Тp связана с абсолютной температурой плавления простой зависимостью:
где а — коэффициент, зависящий от состава и структуры металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3…0,4, для сплавов а = 0,5…0,6.
Если деформирование металла происходит при температуре, которая выше температуры рекристаллизации, то наклеп после деформации не возникает. Такая деформация называется горячей. При горячей деформации идут одновременно процессы упрочнения и рекристаллизации. Деформация, которая происходит ниже температуры рекристаллизации называется холодной.
Параметры решетки, базис, координационное число

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.

Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Примеры материалов
Все металлы характеризуются кристаллическим строением. Они отличаются наличием малоподвижных ионов с положительным зарядом и движущимися между ними электронами. Данные структуры именуют металлическими связями.
Объемно-центрированная кубическая решетка свойственна для Fe при комнатной температуре, W, V, Cr, Mo и прочих металлов.

Гранецентрированная кубическая решетка встречается на Mg, Ti, Zn, Zr и прочих металлах.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.

Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Структура и геометрия
Кристаллические решетки представляют совокупность кристаллитов. В ближних зернах они взаимно расположены под некоторым углом. Атомы, представляющие собой микроскопические частицы вещества и наименьшие части химических элементов, в кристаллитах размещены в соответствии с ближним и дальним порядком. Первый подразумевает определенный порядок размещения и стабильности ближайших друг к другу микрочастиц, второй – самых отдаленных. Возможно покидание отдельными атомами мест расположения вследствие диффузии, однако это не приводит к нарушению упорядоченности строения.

Тип решетки определяют формой простейшего геометрического тела, образующего ее. Кубические решетки дифференцируют на четыре вида:
- кубическая с микрочастицами в углах;
- объемно-центрированный вариант имеет восемь атомов, расположенных по углам, и один в центре;
- гранецентрированная кубическая решетка отличается размещением атомов в центрах граней и вершинах;
- гексагональная плотноупакованная с нахождением микрочастиц в углах шестигранной призмы, в центре оснований и трех в центральной плоскости.
К основным параметрам решеток относят компактность, под которой понимают степень заполнения объема атомами. Ее определяют тремя прочими показателями:
- параметр решетки – значение межатомного расстояния в нм по ребру простейшей ячейки (характеризуется для кубических вариантов длиной ребра);
- координационное число, под которым понимают количество ближайших соседних микрочастиц;
- плотность упаковки, представленная отношением общего атомного объема решетки и ее общего объема.

Для измерения параметра решеток применяют рентгеноструктурный метод анализа. При подсчете количества атомов учитывают, что каждый из них принадлежит к нескольким ячейкам сразу. Для кубических решеток исключение представляет размещенная в центре куба микрочастица.
Для объемно-центрированного типа координационное число составляет 8 по числу ближайших атомов к центральному. Для гранецентрированного варианта микрочастица на кубической грани размещена на одинаковом расстоянии от четырех в углах, четырех на гранях, четырех ближайшей кристаллической ячейки. То есть, координационное число составляет 12.
Различные варианты кристаллических решеток характеризуются разной плотностью упаковки. Для простой кубической решетки координационное число равно 6, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
Для объемно-центрированного варианта объемы микрочастиц и межатомных промежутков соотносятся в пропорции 68/32%, для ГЦК значения соответствующих параметров равны 74 и 26% соответственно. Компактность решетки определяется особенностями металлической электронной структуры и характером атомной связи.
Ввиду упорядоченности решетки возможно выделение кристаллографических плоскостей и направлений.
Под направлениями понимают прямые, вдоль которых находятся атомы. То есть они представлены ребрами, диагоналями и гранями.
Плоскости подразделяют на диагональные и плоскости кубических граней.
Для обозначения данных категорий применяют трехзначные индексы. Для направлений их определяют путем нахождения ближайшего атома и использования его координат относительно точки O. Для плоскостей находят координаты точек их пересечения с осями координат и меняют на обратные.
Следует отметить, что в кристаллических телах наблюдается изменение механических свойств вдоль направлений. Данная особенность, называемая анизотропией, объясняется различной атомной плотностью. Так, для кубических решеток вдоль диагоналей и на диагональных плоскостях данный показатель больше, чем вдоль ребер и на проходящих сквозь грани плоскостях. При этом анизотропия наблюдается в пределах кристаллита либо монокристалла. Для поликристаллических тел она нехарактерна ввиду усреднения параметров по всем направлениям для большого числа произвольно взаимно ориентированных зерен. Ввиду этого металлы относят к псевдо- или квазиизотропным телам.
Кроме того, для некоторых металлов (Ti, Fe, Sn) характерна аллотропия, под которой понимают изменение кристаллического строения путем изменения типа простейшей ячейки. Также данное свойство называют полиморфизмом.
Так, у железа в температурном интервале 911-1392 °C кубическая решетка гранецентрированного типа, а при температурах за пределами приведенного диапазона – отдельно-центрированная (до плавления при 1539 °C). Для дифференциации аллотропических форм применяют греческие буквы.
Возможно наличие дефектов решетки. Их классифицируют на несколько типов.
- Точечные, по размеру близкие к атомам, представлены вакансиями (пустые узлы, межузельные микрочастицы), примесными атомами замещения (того же размера, что и исходные) и внедрения (маленькие микрочастицы в междоузлиях).
- Линейные (протяженные) представлены дислокациями (плоскостные смещения). Их классифицируют на наиболее распространенные краевые (экстраплоскость или полуплоскость) и винтовые (закручивание плоскостей).
- Поверхностные – искажения на границах зерен ввиду передвигающихся зерен дислокации.
- Объемные – поры и трещины.

Названные дефекты по-разному сказываются на прочности. Для точечных степень влияния на данный показатель определяется их характером и числом в конкретном объеме. Линейные дефекты ввиду большой подвижности значительно сказываются на прочности, упрощая сдвиги кристаллитов под влиянием напряжений. Воздействие линейных дефектов на прочность оценивают по их плотности (отношение их общей длины к объему материала). Ее предельное значение – 1013 см-2 (при большем происходит разрушение). На основе того, что мелкозернистые материалы более прочны в сравнении с крупнозернистыми при большей общей протяженности границ, поверхностные дефекты наоборот повышают прочность. Объемные, помимо непосредственного снижения прочности, значительно повышают напряжения от рабочих нагрузок, концентрируя их.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.

Рис. 3. Кристаллические ячейки составляют решётку.
Типы кристаллических решеток
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
– один из классов конструкционных материалов, характеризующийся определенным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов. Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Элементарная ячейка
– элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Все металлы и металлические сплавы – тела кристаллические. Атомы (ионы) расположены в металлах закономерно, в геометрически правильном порядке и образуют пространственную кристаллическую решетку.
Решетка характеризуется наличием каркаса из малоподвижных заряженных ионов, в промежутках которого с огромной скоростью движутся свободные электроны. Если через атомы в кристаллических решетках провести плоскости, то атомы в них будут располагаться в геометрически правильном порядке, образуя кристаллографические плоскости. Наименьший объем металла, который характеризует атомно–кристаллическое строение всего объема, называется элементарной кристаллической решеткой.
Пространственные кристаллические решетки полностью определяют строение кристалла.
Различают простые и сложные кристаллические решетки. В простой решетке атомы (ионы) расположены только в вершинах, а в сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. Всего существует четырнадцать типов решеток, но основными являются три — это:
— Объемно-центрированная кубическая решетка (ОЦК);
— Гранецентрированная кубическая решетка (ГЦК);
— Гексагональная плотноупакованная решетка (ГПУ).
1) В элементарной ячейке ОЦК атомы находятся в вершинах куба и в центре на пересечении пространственных диагоналей. Всего 9 атомов (рис.1).
2) В гранецентрированной кубической решетке атомы расположены в вершинах куба и в центрах каждой грани куба. Всего 14 атомов (рис.2).
3) Гексагональная плотноупакованная решетка. Элементарная ячейка – шестигранная призма, в которой атомы находятся в вершинах и в центре оснований призмы, а также внутри призмы — 3 атома. ГПУ содержит 17 ионов (рис.3).
Кристаллические решетки характеризуют следующие основные параметры: период решетки, атомный радиус, координационное число, базис и коэффициент компактности решетки.
- Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (a,b,с). Периоды решетки выражаются в ангстремах – А (1А=10-8 см).
- Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при нормальной температуре и атмосферном давлении. Однако атомный радиус не является неизменной величиной, а изменяется в зависимости от ряда факторов, важнейшим из которых являются координационное число и тип химической связи между атомами в кристалле.
- Координационное число Кпоказывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке. Чет выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
- Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
- Коэффициент компактности η решетки определяется отношением объема, занимаемого атомами Va, ко всему объему решетки Vp, т.е. η = Va / Vp.
Рассмотрим эти параметры для основных типов кристаллических решеток.

ОЦК решетка
Период решетки – а = 0,286 — 0,607 нм.
Координационное число К
Каждый угловой атом входит в восемь соединительных ячеек, следовательно, одной ячейке принадлежит от угловых атомов только 1/8 атома; только внутренний атом целиком принадлежит данной ячейки. Таким образом, на одну ячейку объемно-центрированной кристаллической решетки приходится 8 * 1/8 + 1 = 2 атома.
Объемно-центрированную кубическую решетку имеют металлы: Li, Na, K, V, Cr, Feα, Rb, Nb, Mo, W и др.
ГЦК решетка
Период решетки – а.
Каждый угловой атом входит в восемь ячеек, а находящийся в центре грани – в две соседние ячейки; в центре атома нет. Следовательно, на одну ячейку приходится 8*1/8+6*1/2 = 4 атома.
Гранецентрированную кубическую решетку имеют металлы: AI, Ca, Feγ, Ni, Cu, Pb, Ag, Pt, Au, Pd и др.
ГПУ решетка
Период решетки а и с (а = 0,228 — 0,398 нм; с = 0,357 — 0,652 нм), причем с/а = 1,633 (если с/а > 1,633, то данная решетка будет гексагональной, но не плотноупакованная, характерная для Mg, Zn).
Базис решетки – 6 атомов.
На одну ячейку кристаллической решетки приходится 6 атомов: 2 атома, лежащие в центре шестиугольника, входят в две соседние ячейки (2*1/2) = 1атом, а 12 атомов, образующие вершины призмы, — в 6 соседних ячеек (12*16/) = 2 атома, 3 атома, лежащие внутри призмы, целиком принадлежат данной ячейке (3*1 = 3 атома).
В гексагональной системе кристаллизуются Be, Мg, Cd, Ti, Co, Zn и другие металлы.
Многие металлы при разных температурах имеют неодинаковые кристаллические решетки. Это явление называется полиформизмом или аллотропией (например Fe, имеет α и γ решетки).
Лекция "Особенности атомно-кристаллического строения металлов"по дисциплине "Основы материаловедения"
Материаловедение - это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами.
Создание научных основ металловедения по праву принадлежит. Чернову Д.К., который установил критические температуры фазовых превращений в сталях и их связь с количеством углерода в сталях. Этим были заложены основы для важнейшей в металловедении диаграммы состояния железоуглеродистых сплавов.
Открытием аллотропических превращений в стали, Чернов заложил фундамент термической обработки стали. Критические точки в стали, позволили рационально выбирать температуру ее закалки, отпуска и пластической деформации в производственных условиях.
В своих работах по кристаллизации стали, и строению слитка Чернов изложил основные положения теории литья, не утратившие своего научного и практического значения в настоящее время.
Великий русский металлург Аносов П.П. впервые применил микроскоп для исследования структуры металлов. Ему принадлежит приоритет в создании легированных сталей. Разработал теорию и технологию изготовления клинков из булатной стали. Из его работ стало ясно, что так называемый булатный узор на поверхности стали, непосредственно зависит от ее внутренней структуры.
В 1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Для решения практических задач знание фазового равновесия в той или иной системе необходимо, но не достаточно для определения состава и относительного количества фаз. Обязательно знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а также распределение, размер и форму кристаллов каждой фазы.
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов.
В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз.
В пятидесятых годах, когда началось исследование природы свойств металлических материалов, было показано, что большинство наиболее важных свойств, в том числе сопротивление пластической деформации и разрушению в различных условиях нагружения, зависит от особенностей тонкого кристаллическо строения. Этот вывод способствовал привлечению физических теорий о строении реальных металлов для объяснения многих непонятных явлений и для конструирования сплавов с заданными механическими свойствами. Благодаря теории дислокаций, удалось получить достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики.
Основными направлениями в развитии металловедения является разработка способов производства чистых и сверхчистых металлов, свойства которых сильно отличаются от свойств металлов технической чистоты, с которыми преимущественно работают. Генеральной задачей материаловедения является создание материалов с заранее расчитаными свойствами применительно к заданным параметрам и условиям работы. Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и высокие температуры и давление).
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
По данным института имени Байкова А.Н. в нашей стране есть все условия чтобы в течении 10…15 лет машиностроение могло перейти на выпуск алюминиево-титановой подвижной техники, которая отличается легкостью, коррозионной стойкостью и большим безремонтным ресурсом.
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических) – пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Металлы, особенности атомно-кристаллического строения
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определ¨нным набором свойств:
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объ¨му металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определ¨нным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объ¨ма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
размеры р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определ¨нными. ·
· углы между осями ().
координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. ·
базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки. ·
плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) ·
Рис.1.1. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
примитивный – узлы решетки совпадают с вершинами элементарных ячеек; ·
· базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
объемно-центрированный – атомы занимают вершины ячеек и ее центр; ·
гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней ·
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических реш¨ток являются:
1. Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, )
2. Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, )
3. Гексагональная, в основании которой лежит шестиугольник:
o простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
o плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим располохением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Д ля обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Для определения индексов кристаллографической кристаллографической плоскости необходимо:
установить координаты точек пересечения плоскости с осями координат в единицах периода решетки; ·
взять обратные значения этих величин; ·
привести их к наименьшему целому кратному, каждому из полученных чисел. ·
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках. Примеры обозначения кристаллографических плоскостей на рис. 1.3 а.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
одну точку направления совместить с началом координат; ·
установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки ·
привести отношение этих координат к отношению трех наименьших целыж чисел. ·
Индексы кристаллографических направлений указываются в квадратных скобкаж [111]
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют теже индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Магнитные превращения
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
Читайте также:
