Многоатомные спирты как и одноатомные реагируют активными металлами с выделением водорода
Обновлено: 19.05.2024
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
Кислотные свойства
1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
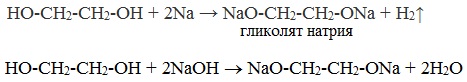
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
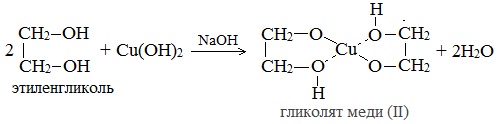
Глицерат меди
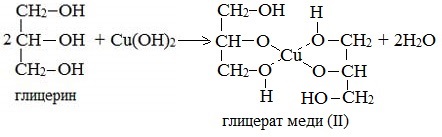
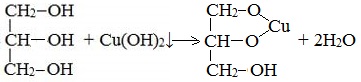
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства
1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
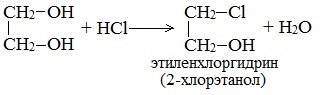
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
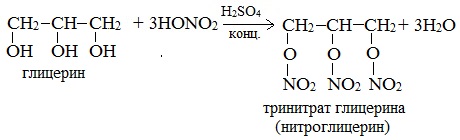
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
Химические свойства спиртов

Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция практически не идет.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |

Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Многоатомные спирты также реагируют с активными металлами:

1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |

Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |

2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
| Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин): |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
| Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода. |
| Например, в присутствии концентрированной серной кислоты при нагревании выше 140 о С из бутанола-2 в основном образуется бутен-2: |
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |

| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |

| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |

| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
4. Окисление этанола
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |

Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами.
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы
очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al2O3), при этом образуются алкоголяты металлов и выделяется водород:
Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
2) Реакция этерификации
Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al2O3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
Большая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара-положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов:
Многоатомные спирты как и одноатомные реагируют активными металлами с выделением водорода
Многоатомные спирты (полиспирты, полиолы) – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Многоатомные спирты — соединения, у которых две или несколько гидроксильных групп расположены у соседних атомов углерода.
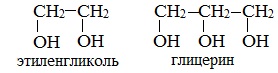
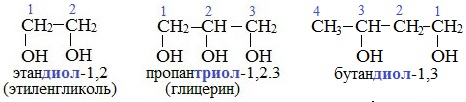
Важнейшими представителями многоатомных спиртов являются двухатомный спирт этандиол-1,2 (этиленгликоль), и трехатомный спирт пропантриол-1,2,3 (глицерин):
Существуют многоатомные спирты, содержащие и большее количество групп -ОН в молекуле, например, пятиатомный спирт ксилит, который используют в качестве заменителя сахара:
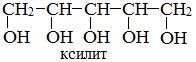
или шестиатомный спирт гексанол (сорбит):
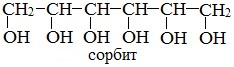
Двухатомные спирты, содержащие две гидроксильные группы -ОН, называются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы, — глицеринами, или триолами.
I. Гликоли (диолы)
Этиленгликоль С2Н4(ОН)2 — представитель предельных двухатомных спиртов - гликолей.
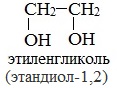
Название гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» — сладкий).
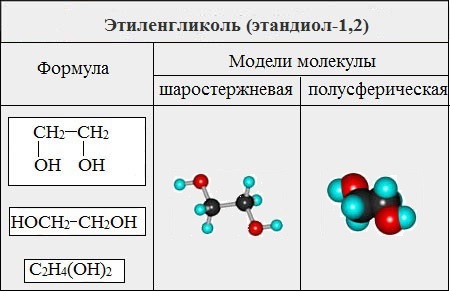
II. Глицерины (триолы)
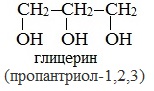
Глицерин (С 3 Н 5 ОН) 3 — простейший представитель трехатомных предельных спиртов - глицеринов .
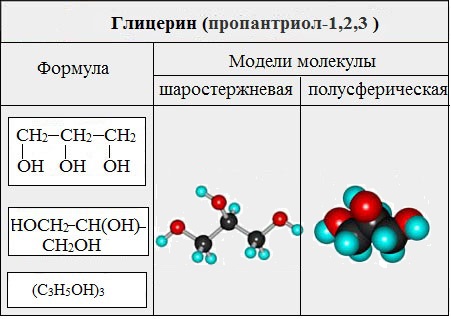
Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Физические свойства
Этиленгликоль — сиропообразная, вязкая бесцветная жидкость, tпл = 11,5 0 C, tкип = 197,6 0 C. Этиленгликоль гигроскопичен, смешивается с водой и этиловым спиртом в любых отношениях. Он сильно понижает температуру замерзания воды, поскольку раствор этиленгликоля в воде имеет низкую температуру замерзания (60%-ый раствор замерзает при -49 0 С).
Поэтому этиленгликоль широко используется в системах охлаждения двигателей в качестве антифриза (от анг. to freeze — «замерзать») – вещества с низкой температурой замерзания, заменяющего воду в радиаторах автомобильных и авиационных моторов в зимнее время. Антифризы также замедляют ее испарение летом.
Этиленгликоль используется также для производства синтетического волокна полиэфирного волокна – лавсана.
Этиленгликоль очень токсичен! Это сильный яд! Этиленгликоль вызывает длительное угрожающее жизни угнетение центральной нервной системы и поражение почек. Продуктами его превращения в организме являются щавелевая кислота и другие не менее ядовитые соединения. Он имеет спиртовой запах, в связи, с чем может быть принят за этиловый спирт и стать причиной тяжелых отравлений.

Видеоопыт «Изучение физических свойств глицерина»
Глицерин – бесцветная, вязкая, сиропообразная жидкость, сладкая на вкус. Не ядовит. Глицерин не имеет запаха, его tпл = 18 0 С, tкип = 290 0 С. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. На этом свойстве основано применение глицерина в косметической промышленности, где глицерин используется для увлажнения кожи.

Абсолютно чистый безводный глицерин затвердевает при +18 0 С, но получить его в твердом виде чрезвычайно сложно.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов – жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции. Благодаря этим свойствам глицерин является важным компонентов многих пищевых продуктов, кремов, косметических средств.
Этиленгликоль и глицерин, благодаря наличию гидроксильных групп, могут образовывать водородные связи с молекулами воды, этим объясняется их не ограниченная растворимость в воде.
Читайте также:







