Мягкие металлы в таблице менделеева
Обновлено: 15.05.2024
Почти все сталкивались хоть раз с таким металлом, как золото, ведь оно используется во многих сферах нашей жизни. Пользу для человека приносят и другие самые мягкие металлы – ртуть, калий, натрий и др.
Насколько золото мягкое, и как используется это свойство металла?
Сложно назвать какой-то другой металл, кроме золота, сыгравший в истории человечества столь важную роль. Из-за золота разжигались войны, оно побуждало немало страстей, в надежде обрести «золотые горы» человек мог идти на невероятные лишения. История этого металла сопоставима с историей цивилизации. По мнению археологов, золотом пользовались еще в Месопотамии и Египте, есть строчки о нем и в Ветхом Завете.
Этот металл достаточно сильно распылен в природе. Золото содержится в морской воде, в человеческом организме, его можно обнаружить практически в любом осколке гранита. И это притом, что золота лишь миллионные доли процента в земной коре.
В чистом виде цвет этого металла – желтый с оттенком красного, что отличает его от всех других металлов. Золото является мягким благородным металлом. Под действием окружающей среды оно легко разрушается.

В чистом виде это настолько мягкий металл, что его несложно поцарапать даже ногтем. Известно, что из одного грамма данного металла можно вытянуть трехкилометровую проволоку, так же грамма будет достаточно, чтобы изготовить тончайшую золотую фольгу, которая будет в сотни раз тоньше волоса человека, при этом будет гнуться не ломаясь.
По механической прочности и по своей химической стойкости этот драгметалл уступает почти всем платиноидам, но он незаменим для электрических контактов. Именно поэтому в микроэлектронике повсеместно используются гальванические покрытия и золотые проводники. В ядерных исследованиях не обходится без золота, где его используют как мишень. Применяют его и в нейтронной бомбе в качестве нейтронной оболочки.

Благодаря такому свойству золота, как мягкость, ему можно придать абсолютно любую форму, оно легко поддается обработке. В ювелирном искусстве уже более чем пять тысяч лет используется золото. Ранее из него изготавливали дворцовую утварь, культовые изделия, золотили одежду. Благодаря примесям других металлов, получают золото разных цветов. Так как абсолютно очистить золото от примесей невозможно, нет стопроцентного золота. Даже на банковских слитках написано 99,99%.

Что делают из мягких металлов?
Мягкими металлами кроме золота являются медь, серебро, алюминий, но самые мягкие – это цезий, калий, натрий, рубидий и др. Притом, что серебра на планете в двадцать раз больше чем золота, этот драгоценный металл так же считается редким. Его легко обрабатывать, в этом оно уступает лишь золоту. Из него делают посуду, ювелирные украшения, монеты и приборы.

Мягкий металл медь был известен с давних времен и имел огромное значение в развитии человечества и материальной культуры. Всем известно о медном веке, когда люди пользовались орудиями труда из этого металла и его сплавов. Сегодня она широко используется в медицине, искусстве и промышленности.

Калий используют в сельском хозяйстве в виде солей калия. Основное же применение этого металла - приготовление пероксида калия. Без такого металла, как цезий не обходится производство катодов, фотоэлектронных умножителей, электровакуумных фотоэлементов и электронно-оптических преобразователей. Применение в разных областях нашел и рубидий. Однако нельзя сказать, что область его применения широка. В мире производство этого металла - всего несколько десятков килограмм в год. Его соединения применяют для изготовления специальной оптики, в атомной и электронной промышленности, в аналитической химии, при изготовлении измерительных приборов.

Широкое применение и у натрия. Практически нет ни одной отрасли промышленности, которая обходится без натрия. Этот металл в жидком виде, а так же в виде сплавов с калием используют как теплоноситель в атомной энергетике. В металлургии натрий служит восстановителем при получении циркония, урана, титана, тория и других металлов. Используют натрий и в химической промышленности при производстве антисептиков и удобрений. В легкой промышленности натрий необходим для обработки кожи.
Самый мягкий металл в мире
Одним из удивительнейших химических элементов считается ртуть, так как будучи металлом, она находится в жидком состоянии. Из-за этого ртуть признана самым мягким в мире металлом.

К ртути у человека особое отношение. Все дело в том, что она способна испаряться, находясь в жидком состоянии. Многие века ртуть служила на благо человека и использовалась в разнообразных сферах его деятельности. Сегодня известно более одной тысячи областей ее применения – это приборостроение, оборонная промышленность, сельское хозяйство, вакуумная техника, горное дело, электротехника, химическая промышленность и др.
Металлы – вид материалов, которые используются человеком с давних времен. Эта группа веществ очень многочисленна, но все они имеют общие физические характеристики, которые принято называть металлическими свойствами.

Твердость среди них - обычное, но не определяющее. Более специфичны другие, которыми обладает и самый мягкий металл. Эти свойства определяются особенностями их строения на молекулярном уровне.
Свойства металлов
Железо и его сплавы (сталь, чугун), медь, алюминий. Применение этих материалов знаменовало рывки научно-технического прогресса на разных этапах развития цивилизации. У каждого из этих металлов есть характеристики, придающие ему уникальную практическую ценность. Общими признаками для них являются высокая тепло- и электропроводность, пластичность – способность сохранять целостность при деформации, металлический блеск.
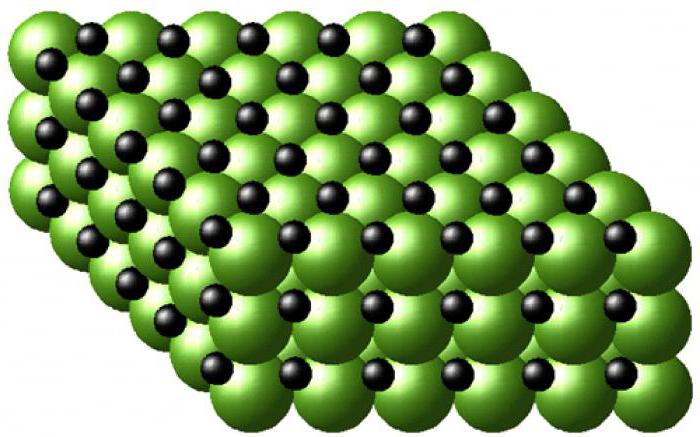
Булатный клинок, разрубающий железные доспехи, и самый мягкий металл, на котором остаются следы от малейшего воздействия, имеют сходное внутреннее устройство. В его основе – кристаллическая решетка, в узлах которой – атомы с положительным и нейтральным зарядом, между которыми находится «электронный газ» - частицы, покинувшие внешние оболочки атомов из-за ослабления связи с ядром. Особая металлическая связь между положительными ионами, расположенными в узлах кристаллической решетки, осуществляется за счет сил притяжения, возникающих в «электронном газе». Твердость, плотность, температура плавления металла зависят от концентрации этого «газа».
Критерии оценки
Ответ на вопрос о том, какой металл самый мягкий, всегда будет предметом обсуждения, если не согласовать критерии оценки и определить само понятие мягкости. Мнение об этой характеристике материала будет различным у специалистов разных отраслей. Металлург может понимать мягкость как повышенную ковкость, тенденцию воспринимать деформации от абразивных материалов и т. д.

Для материаловедов важно иметь возможность объективно сравнивать разные характеристики веществ. Мягкость также должна иметь общепринятые критерии оценки. Самый мягкий металл в мире должен иметь общепризнанные показатели, доказывающие его «рекордные» характеристики. Существует несколько методик, целью которых является измерение мягкости различных материалов.
Методы измерения
Большинство сертифицированных способов измерения твердости, основаны на измеряемом с помощью точных инструментов контактном воздействии на исследуемый материал со стороны более твердого тела, называемого индентором. В зависимости от вида индентора и от способов измерения различают несколько основных методов:
- Метод Бринелля. Определяется диаметр отпечатка, оставляемого металлическим шариком при вдавливании в поверхность исследуемого вещества.
- Метод Роквелла. Измеряется глубина вдавливания в поверхность шарика или алмазного конуса.
- Метод Виккерса. Определяется площадь отпечатка, оставляемого алмазной четырехгранной пирамидкой.
- Твердость по Шору. Есть свои шкалы для очень твердых и очень мягких материалов – измеряется глубина погружения специальной иглы или высота отскока от поверхности специального бойка.
Шкала твердости Мооса
Этот шкала для определения относительной твердости минералов и металлов была предложена в начале XIX века немцем Фридрихом Моосом. Она основан на методе царапания, когда более твердый образец оставляет отметку на более мягком, и очень удобна для выяснения - какой металл самый мягкий. По отношению к 10 эталонным минералам, которым присвоен условный показатель твердости, для испытываемого вещества определяется место в шкале и цифровой индекс. Самый мягкий эталонный минерал – тальк. Он имеет твердость по Моосу - 1, а самый твердый, алмаз – 10.

Оценка твердости по шкале Мооса происходит по принципу "мягче - тверже". Точно определить, во сколько раз, например, алюминий, имеющий индекс по шкале Мооса 2,75, мягче вольфрама (6,0), можно только имея результаты измерений, основанных на других методах. Но чтобы определить самый мягкий металл в таблице Менделеева этой таблицы вполне достаточно.
Самые мягкие – щелочные металлы
Из минералогической шкалы Мооса видно, что самыми мягкими являются вещества, относящиеся к щелочным металлам. Даже ртуть, знакомая многим по жидкости из градусника, имеет показатель твердости 1,5. Мягче её несколько веществ, обладающих сходными физико-механическими и химическими свойствами: литий (0,6 по шкале Мооса), натрий (0,5), калий (0,4), рубидий (0,3). Самый мягкий металл - это цезий, имеющий по шкале твердости Мооса показатель 0,2.
Физические и химические свойства щелочных металлов определяются их электронной конфигурацией. Она лишь слегка отличается от строения инертных газов. Электрон, расположенный на внешнем энергетическом уровне обладает подвижностью, которая определяет высокую химическую активность. Самым мягким металлам свойственна особая летучесть, их трудно добывать и сохранять в неизменном виде. Им присущи бурные химические взаимодействия с воздухом, водой, кислородом.
Элемент № 55
Название "цезий" происходит от латинского caesius – “небесно-голубой»: в спектре, излучаемом сильно нагретым веществом, в инфракрасном диапазоне видны две ярко-синие полоски. В чистом виде он хорошо отражает свет, похож на светлое золото и имеет серебристо – желтый цвет. Цезий - самый мягкий металл в мире, показатель твердости по Бринеллю – 0,15 Мн/м 2 (0,015 кгс/см 2 ). Температура плавления: +28,5°С, поэтому в обычных условиях, при комнатной температуре цезий находится в полужидком состоянии.

Это редкий, дорогой и чрезвычайно химически активный металл. В электронике, радиотехнике и химической промышленности высоких технологий цезий и сплавы на его основе находят всё большее применение и потребность в нем растет постоянно. Востребованы его химическая активность, способность образовывать соединения с высочайшей электропроводностью. Цезий – важный компонент производства специальных оптических приборов, светильников с уникальными свойствами и других высокотехнологических изделий. При этом мягкость – не самое его востребованное качество.
Полный список металлов, известных науке
Посмотрите вокруг на секунду. Сколько металлических вещей вы можете увидеть? Обычно, когда мы думаем о металлах, мы вспоминаем о веществах, которые являются блестящими и прочными. Однако они также находятся в нашей пище и в наших телах. Давайте познакомимся с полным списком металлов, известных науке, узнаем их основные свойства и выясним, почему они такие особенные.

Элементы, легко теряющие электроны, которые являются блестящими (отражающими), податливыми (могут быть отлиты в другие формы) и считаются хорошими проводниками тепла и электричества, называют металлами. Они имеют решающее значение для нашего образа жизни, так как не только являются частью структур и технологий, но и важны для производства почти всех предметов. Металл есть даже в человеческом теле. Взглянув на этикетку состава мультивитаминов, вы увидите десятки перечисленных соединений.
Возможно, вы не знали, что такие элементы, как натрий, кальций, магний и цинк, необходимы для жизни, и, если они отсутствуют в наших телах, наше здоровье может быть в серьезной опасности. Например, кальций необходим для здоровых костей, магний - для метаболизма. Цинк усиливает функцию иммунной системы, а железо помогает клеткам крови переносить кислород по всему телу. Однако металлы в наших телах отличаются от металла в ложке или стальном мосте тем, что они потеряли электроны. Они называются катионами.
Металлы также обладают антибиотическими свойствами, поэтому перила и ручки в общественных местах часто изготавливаются из этих элементов. Известно, что многие инструменты делаются из серебра для предотвращения размножения бактерий. Искусственные суставы изготавливаются из титановых сплавов, которые одновременно предотвращают заражение и делают реципиентов сильнее.
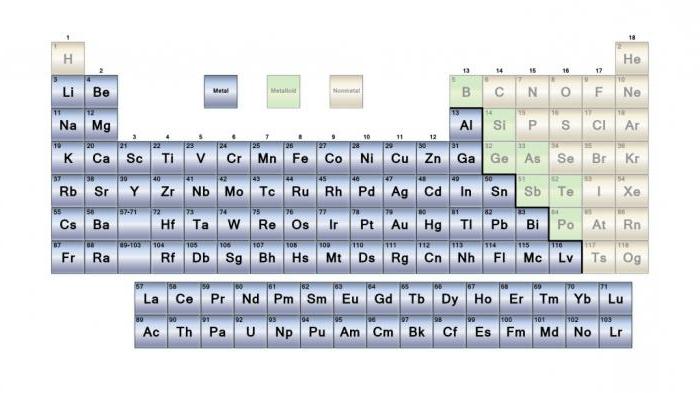
Металлы в периодической таблице
Все элементы в периодической системе Дмитрия Менделеева делятся на две большие группы: металлы и неметаллы. Первая является самой многочисленной. Большинство элементов - металлы (синий). Неметаллы в таблице изображены на желтом фоне. Есть также группа элементов, которые относят к металлоидам (красный). Все металлы сгруппированы в левой части таблицы. Обратите внимание, что водород сгруппирован с металлами в верхнем левом углу. Несмотря на это, он считается неметаллическим. Однако некоторые ученые теоретизируют, что в ядре планеты Юпитер может быть металлический водород.

Металлическое связывание
Многие из замечательных и полезных качеств элемента связаны с тем, как его атомы соединяются друг с другом. При этом возникают определенные связи. Металлическое взаимодействие атомов приводит к созданию металлических структур. Любой образец этого элемента в повседневной жизни, от автомобиля до монет в кармане, включает в себя металлическое соединение.

Во время этого процесса атомы металла разделяют свои внешние электроны равномерно друг с другом. Электроны, протекающие между положительно заряженными ионами, легко передают тепло и электроэнергию, делая эти элементы такими хорошими проводниками тепла и электричества. Медные провода используются для электроснабжения.

Реакции металлов
Реакционная способность относится к тенденции элемента реагировать с химическими веществами в его окружении. Она бывает разная. Некоторые металлы, например, калий и натрий (в колонках 1 и 2 в периодической таблице), легко реагируют со многими различными химическими веществами и редко встречаются в своей чистой, элементарной форме. Оба обычно существуют только в соединениях (связанных с одним или несколькими другими элементами) или как ионы (заряженная версия их элементарной формы).

С другой стороны, существуют и другие металлы, их еще называют ювелирными. Золото, серебро и платина являются не очень реактивными и обычно встречаются в чистом виде. Эти металлы легче теряют электроны, чем неметаллы, но не так легко, как реактивные металлы, например, натрий. Платина относительно нереакционноспособна и очень устойчива к реакциям с кислородом.
Свойства элементов
Когда вы изучали алфавит в начальной школе, вы обнаружили, что все буквы имеют свой собственный уникальный набор свойств. Например, у некоторых были прямые линии, у некоторых - кривые, а у других были линии обоих типов. То же самое можно сказать и об элементах. Каждый из них имеет уникальный набор физических и химических свойств. Физические свойства - это качества, присущие определенным веществам. Блестящий или нет, насколько он хорошо проводит тепло и электричество, при какой температуре тает, насколько большую имеет плотность.

Химические свойства включают те качества, которые наблюдаются при реагировании на воздействие кислородом, если они будут гореть (то, насколько сложно им будет удерживать их электроны во время химической реакции). Различные элементы могут иметь общие свойства. Например, железо и медь являются одновременно элементами, которые проводят электричество. Однако они не имеют одинаковых свойств. Например, когда железо подвергается воздействию влажного воздуха, оно покрывается ржавчиной, но когда медь оказывается под действием тех же условий, она приобретает специфический зеленый налет. Вот почему статуя Свободы зеленая, а не ржавая. Она сделана из меди, а не железа).

Организация элементов: металлы и неметаллы
Тот факт, что элементы имеют некоторые общие и уникальные свойства, позволяет сортировать их в красивую, аккуратную диаграмму, которая называется периодической таблицей. Она организует элементы на основе их атомного числа и свойств. Итак, в периодической таблице мы находим элементы, сгруппированные вместе, которые имеют общие свойства. Железо и медь находятся близко друг к другу, оба являются металлами. Железо обозначено символом «Fe», а медь обозначается символом «Cu».

Большинство элементов периодической таблицы - это металлы, и они, как правило, находятся в левой части таблицы. Они группируются вместе, потому что обладают определенными физическими и химическими свойствами. Например, металлы плотные, блестящие, они хорошие проводники тепла и электричества, и они легко теряют электроны в химических реакциях. Напротив, неметаллы имеют противоположные свойства. Они не плотные, не проводят тепло и электричество, и стремятся получить электроны, а не отдать их. Когда мы смотрим в периодическую таблицу, мы видим, что большинство неметаллов сгруппированы справа. Это такие элементы, как гелий, углерод, азот и кислород.

Что такое тяжелые металлы?
Список металлов достаточно многочисленный. Некоторые из них могут накапливаться в организме и не наносить ему при этом вреда, как например, природный стронций (формула Sr), который является аналогом кальция, так как продуктивно откладывается в костной ткани. Какие из них называются тяжелыми и почему? Рассмотрим четыре примера: свинец, медь, ртуть и мышьяк.
Где находятся эти элементы и как они влияют на окружающую среду и здоровье человека? Тяжелые металлы представляют собой металлические, встречающиеся в природе соединения, которые имеют очень высокую плотность по сравнению с другими металлами - по меньшей мере, они в пять раз больше плотности воды. Они токсичны для людей. Даже небольшие дозы могут привести к серьезным последствиям.

- Свинец. Это тяжелый металл, являющийся токсичным для людей, особенно для детей. Отравление этим веществом может привести к проблемам неврологического характера. Несмотря на то что когда-то он был весьма привлекательным из-за его гибкости, высокой плотности и способности поглощать вредное излучение, свинец был выведен из употребления по многим направлениям. Этот мягкий серебристый металл, который встречается на Земле, является опасным для людей и накапливается в организме в течение долгого времени. Самое страшное, что от него нельзя избавиться. Он сидит там, накапливается и постепенно отравляет тело. Свинец токсичен для нервной системы и может вызвать серьезное повреждение головного мозга у детей. Он широко использовался в 1800-х годах для создания макияжа и вплоть до 1978 года использовался в качестве одного из ингридиентов в краске для волос. Сегодня свинец используется в основном в больших батареях, в качестве экранов для рентгеновских лучей или изоляции для радиоактивного материала.
- Медь. Это красновато-коричневый тяжелый металл, у которого есть множество применений. Медь по-прежнему является одним из лучших проводников электричества и тепла, и многие электрические провода сделаны из этого металла и покрыты пластиком. Монеты, в основном мелочь, также делают из этого элемента периодической системы. Острые отравления медью встречаются редко, но, как и свинец, она может накапливаться в тканях, что в конечном итоге приводит к токсичности. Люди, которые подвергаются воздействию большим количеством меди или медной пыли, также находятся в зоне риска.
- Ртуть. Этот металл токсичен в любой форме и может даже поглощаться кожей. Его уникальность состоит в том, что он является жидким при комнатной температуре, его иногда называют «быстрым серебром». Его можно увидеть в термометре, потому что в качестве жидкости он поглощает тепло, изменяя объем даже с малейшей разницей в температуре. Это позволяет ртути подниматься или падать в стеклянной трубке. Поскольку это вещество является мощным нейротоксином, многие компании переходят на спиртовые термометры, окрашенные в красный цвет.
- Мышьяк. Со времен Римской империи вплоть до викторианской эпохи мышьяк считался «королем ядов», а также «ядом царей». История пронизана бесчисленными примерами как королевских лиц, так и простых людей, совершающих убийства для личной выгоды, используя соединения мышьяка, у которых не было ни запаха, ни цвета, ни вкуса. Несмотря на все отрицательные влияния, этот металлоид также имеет свои области применения, даже в медицине. Например, триоксид мышьяка является очень эффективным препаратом, используемым для лечения людей с острым промиелоцитарным лейкозом.

Что такое драгоценный металл?
Драгоценный металл представляет собой металл, который может быть редким или трудно добываемым, а также экономически очень ценным. Каков список металлов, являющихся драгоценными? Всего их три:
- Платина. Несмотря на свою тугоплавкость, она используется в ювелирных изделиях, электронике, автомобилях, в химических процессах и даже в медицине.
- Золото. Этот драгоценный металл используется для изготовления ювелирных изделий и золотых монет. Однако он имеет много других применений. Он используется в медицине, производстве и лабораторном оборудовании.
- Серебро. Этот благородный металл серебристо-белого цвета является очень ковким. в чистом виде является достаточно тяжелым, оно легче свинца, но тяжелее меди.

Металлы: виды и свойства
Большинство элементов можно рассматривать как металлы. Они сгруппированы в середине в левой стороне таблицы. Металлы бывают щелочные, щелочноземельные, переходные, лантаноиды и актиниды.

- твердое вещество при комнатной температуре (за исключением ртути);
- обычно блестящее;
- с высокой температурой плавления;
- хороший проводник тепла и электричества;
- с низкой способностью к ионизации;
- с низкой электроотрицательностью;
- податливый (способный принимать заданную форму);
- пластичный (можно вытянуть в проволоку);
- с высокой плотностью;
- вещество, которое теряет электроны в реакциях.

Список металлов, известных науке
- литий;
- бериллий;
- натрий;
- магний;
- алюминий;
- калий;
- кальций;
- скандий;
- титан;
- ванадий;
- хром;
- марганец;
- железо;
- кобальт;
- никель;
- медь;
- цинк;
- галлий;
- рубидий;
- стронций;
- иттрий;
- цирконий;
- ниобий;
- молибден;
- технеций;
- рутений;
- родий;
- палладий;
- серебро;
- кадмий;
- индий;
- коперниций;
- цезий;
- барий;
- олово;
- железо;
- висмут;
- свинец;
- ртуть;
- вольфрам;
- золото;
- платина;
- осмий;
- гафний;
- германий;
- иридий;
- ниобий;
- рений;
- сурьма;
- таллий;
- тантал;
- франций;
- ливерморий.

Всего известно около 105 химических элементов, большая часть из которых - металлы. Последние являются очень распространенным элементом в природе, который встречается как в чистом виде, так и в составе всевозможных соединений.

Металлы залегают в недрах земли, их можно найти в различных водоемах, в составе тел животных и человека, в растениях и даже в атмосфере. В периодической системе они располагаются начиная с лития (металл с формулой Li) и заканчивая ливерморием (Lv). Таблица она продолжает пополняться новыми элементами, и в основном это металлы.
Положение металов в переодической таблице особенности строения атомов металов? Физические св-ва?
Большинство эл-тов табл. Менделеева - металлы.
Металлические свойства усиливаются сверху вниз и справа налево.
Самый активный металл - франций.
На внешнем уровне обычно 1-2 электрона, которые атомы металлов могут отдавать. Чем легче их отдать - тем активнее металл.
Металлы главной подгруппы 1 группы - щелочные. Литий, натрий, калий, цезий, рубидий, франций. Очень активны.
Кальций, стронций, барий, радий - щелочноземельные.
Физ. св=ва: металл. блеск, ковкость, тепло- и электропроводность
ПОЛОЖЕНИЕ МЕТАЛЛОВ В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ
Если в периодической таблице элементов Д. И. Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп) , а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.) , обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора) , IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго) .
ОСОБЕННОСТИ СТРОЕНИЯ АТОМОВ МЕТАЛЛОВ
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними передвигаются относительно свободные электроны.
ФИЗИЧЕСКИЕ СВОЙСТВА
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
1) Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду ––Au,Ag,Cu,Sn,Pb,Zn,Fe® уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность.
Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду ––Ag,Cu,Al,Fe® уменьшается.
При нагревании электропроводность уменьшается, т. к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло) ; самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т. пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
14 различных типов металлов

Термин "металл" происходит от греческого слова "metalléuō", что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы

Сплав титана 6AL-4V
Примеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы

Окисленные свинцовые конкреции и кубик размером 1 см3
Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы - это элементы с относительно высокой плотностью (обычно более 5 г/см³) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл

Подшипники из белого металла
Примеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы - это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл

Хрупкое разрушение чугуна
Примеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
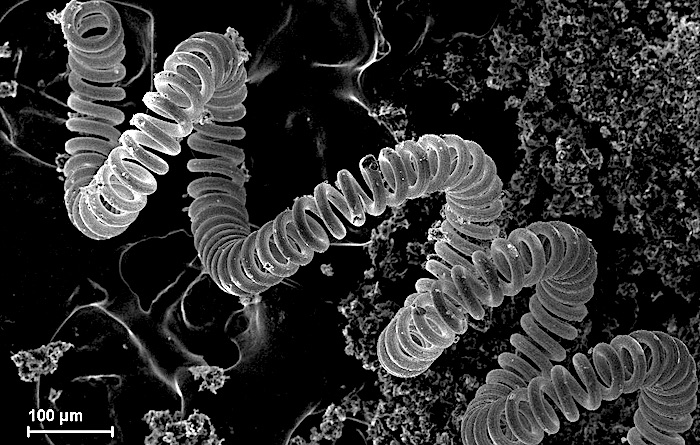
Микроскопическое изображение вольфрамовой нити в лампе накаливания
Примеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы

Валы-шестерни из (черной) нержавеющей стали
Черные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин "железо" происходит от латинского слова "Ferrum", что переводится как "железо". Таким образом, термин "черный металл" обычно означает "содержащий железо", тогда как "цветной металл" означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы

Ассортимент благородных металлов
Цветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы - это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель - для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы

Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулы
Примеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро - второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы

Твердый металлический натрий
Примеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие, как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов - использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы

Изумрудный кристалл, основной минерал бериллия.
Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
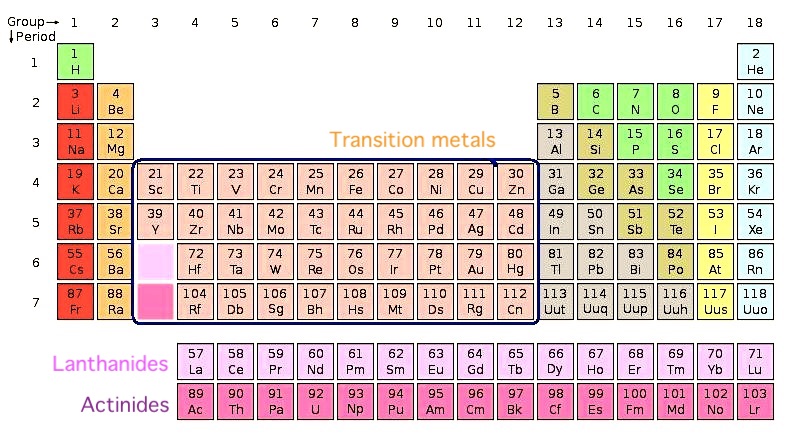
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы

Висмут в виде синтетических кристаллов
Примеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице - это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются "бедными" или "другими" металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий - в топливных элементах и полупроводниках.
2. Лантаноиды

1-сантиметровый кусок чистого лантана
Примеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды - это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды - это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды

Металлический уран, высокообогащенный ураном-235
Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Читайте также:
