На внешнем электронном слое у атомов металлов может быть
Обновлено: 17.05.2024
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
Электронные оболочки атомов и молекул
Неверие в квантово-механические представления о строении электронных оболочек атомов и молекул принято считать ересью, не заслуживающей серьёзного внимания. Тем не менее, регулярно появляются еретики, пытающиеся при построении своих теорий обойтись без принципа неопределённости, орбиталей, волновых функций и прочих постулатов квантовой механики. В основе большинства таких теорий лежит представление о кольцевом (или тороидальном) строении электрона («магнетона»), предложенное ещё в 1915 году Альфредом Парсоном. У авторов более современной теории струн электроны считаются кольцевыми струнами, но Вселенной приписывается не менее десяти измерений, из которых только четыре доступны человеческому восприятию. К последователям А.Парсона с менее буйной фантазией относятся A.Канарёв, А.Кушелев, З.Огжевальский, S.Allen, D.Bergman, P.Ošmera, K.Snelson, P.Vesly и многие другие авторы и сторонники теорий кольцевого (тороидального, вихревого, фрактального и т.п.) электрона.
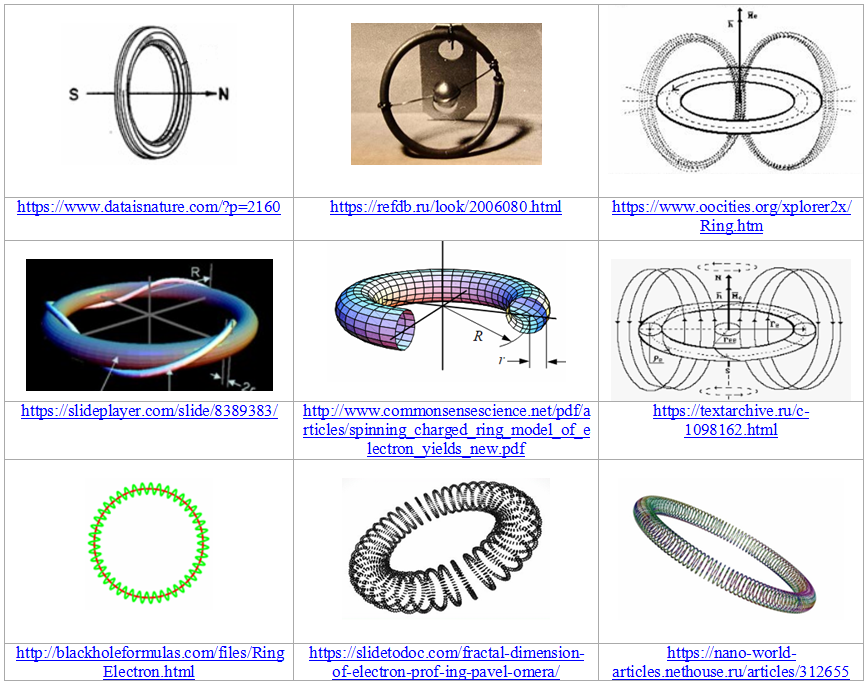
Рис. 1. Некоторые варианты кольцевых электронов
Один из возможных вариантов такой трансформации – дробление одного кольца, соответствующего верхнему (нулевому) энергетическому уровню электрона в атоме водорода, на пары мелких колечек. При этом количество таких пар (от 1 до 6) соответствует дискретным энергетическим состояниям электрона.
Такая схема формирования дискретных энергетических уровней электрона позволяет объяснить существование спектральных серий и линий излучения атомарного водорода.
Если электроны действительно являются не просто кольцевыми, а многокольцевыми, то этим определяется строение внешних электронных оболочек всех элементов таблицы Менделеева. И их электроны должны состоять из шести пар колец – как у атомарного водорода в невозбуждённом состоянии. Для подтверждения данной гипотезы необходимо построить модели различных оболочек из замкнутых 12-звенных электронов, и при помощи таких моделей попытаться объяснить физические и химические свойства соответствующих им атомов и молекул.
При построении моделей электронных оболочек элементов, относящихся к различным группам и периодам таблицы Менделеева, эту таблицу желательно иметь перед глазами. И ориентироваться не только на общее количество внешних электронов, но и на их чётность, а также на возможное влияние нижележащих оболочек на характер сборки внешних оболочек и, соответственно, на свойства атомов.
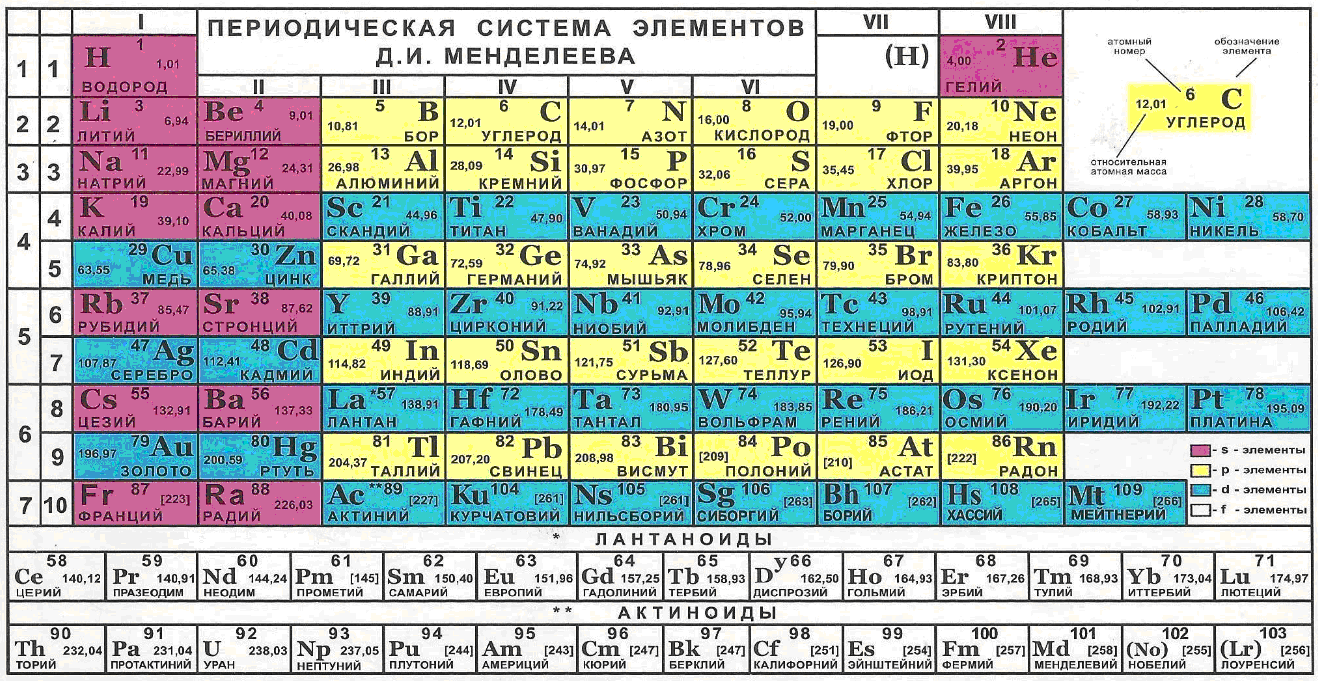
Рис. 4. Периодическая система химических элементов (таблица Менделеева)
Многокольцевые электроны могут иметь несколько вариантов укладки составляющих их звеньев, отличающихся количеством контактных точек и плотностью распределения заряда. Можно предположить, что наиболее стабильные оболочки атомов и молекул состоят из электронов с симметричным расположением составляющих их одинаковых звеньев (колечек).
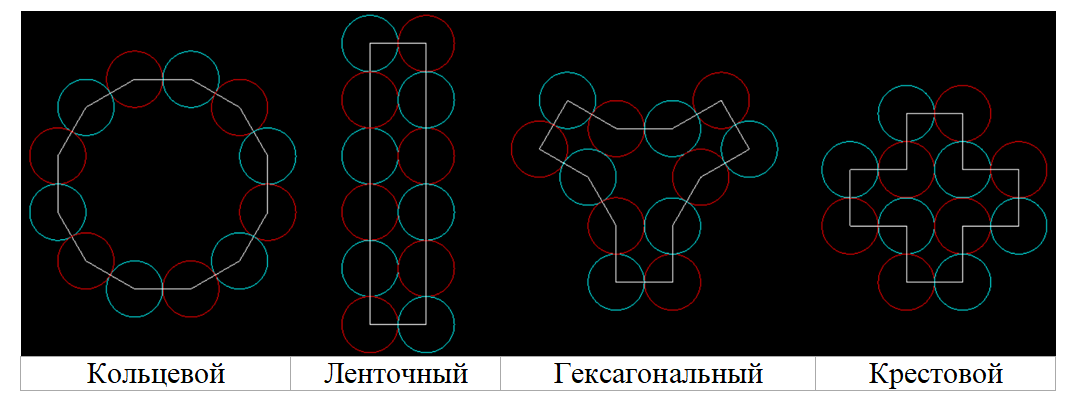
Рис. 5. Основные варианты симметричной укладки электронных звеньев
В трёхмерной модели атома водорода с электроном в основном (невозбуждённом) состоянии составляющие его звенья (с ленточной укладкой) могут располагаться на поверхности сферы с центральным атомным ядром (протоном). Такая электронная сфера обладает минимальным объёмом (и диаметром) и максимальным количеством точек соприкосновения звеньев с противоположной ориентацией магнитного поля.
Для двух электронов атома гелия возможны по крайней мере два варианта укладки составляющих их 24 (12х2) звеньев. Сферический может соответствовать гелию-I – химически инертному, с экстремально низкой температурой кипения (4,2°K). Трубчатый вариант должен легко полимеризоваться и подходит для гелия-II, образующегося при температуре
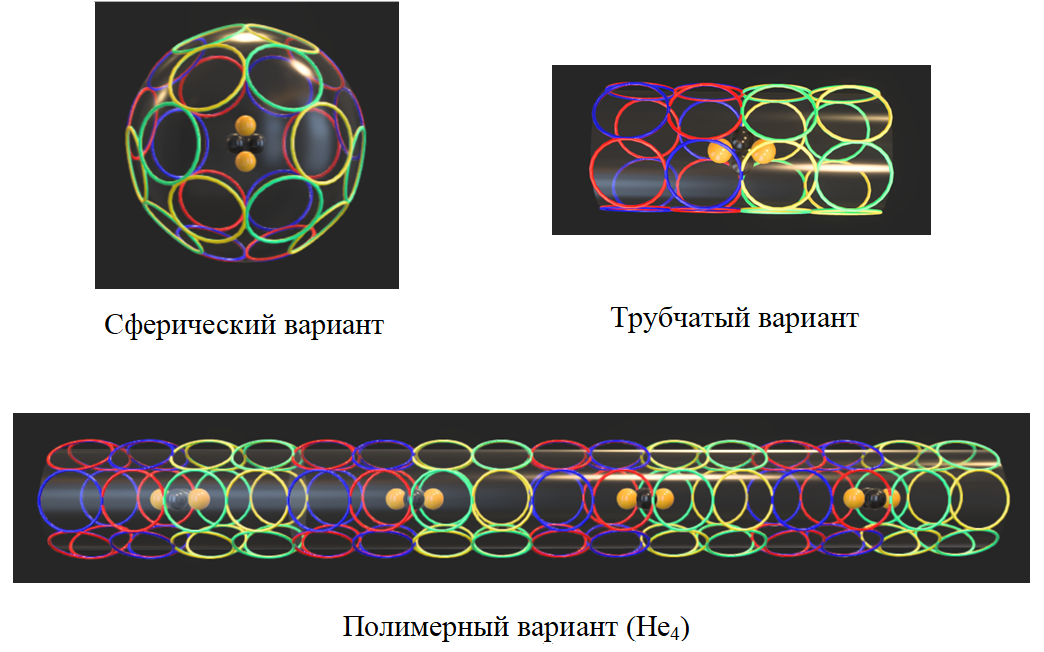
Рис. 7. Варианты построения двухэлектронных оболочек гелия
Немаловажным преимуществом двухслойной оболочки является простота построения её производных, у которых нехватка электронов во внешнем слое компенсируется атомами водорода – с протонами, расположенными в соединительных шестизвенных колодцах (венчиках) на максимальном удалении друг от друга. Для второго периода таблицы Менделеева такими производными являются метан (СН4), аммиак (NH3), вода (H2O) и фтороводород (HF). Причём в оболочке воды возможно не только угловое (мета-), но и прямое (пара-) расположение протонов.
Для атомов щелочных металлов (Li, Na, K, Rb, Cs, Fr) можно предложить несколько вариантов моделей их электронных оболочек, но для компенсации магнитных полей электронов они должны быть димерными, причём склонными к полимеризации. Димерная природа щелочных металлов редко упоминается в учебниках, но хорошо известна специалистам.
Полимеризацией двухэлектронной оболочки может объясняться и прочность металлического бериллия. А полимеризация трёхэлектронных оболочек способна определять сверхпрочность конструкционных волокон бора, получаемых его осаждением на тонкую нить или проволоку.

Рис. 11. Модели мономерных и полимерных электронных оболочек бериллия и бора
Полимерные трёхэлектронные оболочки трубчатого типа подходят также для металлов третьей группы, легкоплавкость которых (галлий - 29,76°C, индий - 156,6°C, таллий - 304°C) может объясняться лёгкостью перестроения полимерной формы в сферическую.

Рис. 12. Модель сферической трёхэлектронной оболочки
Неуравновешенность магнитных полей у таких трёхэлектронных сфер (нечётность количества их электронов) может определять и нелетучесть, и сравнительно высокие температуры кипения расплавов этих металлов (Ga – 2477°C; In – 2072°C; Tl - 1746°C).
Внешняя оболочка атома углерода содержит 4 электрона, из которых при соединении двух кольцевых и двух крестовых электронов можно построить очень компактную сферу. Но обладающие такой сферической оболочкой элементы должны быть если не газообразными, то хотя бы легкоплавкими, что для углерода явно не характерно. Его свойства проще объяснить формированием трубчатой оболочки из четырёх кольцевых электронов, которое может быть обусловлено нестабильностью крестовой структуры электрона, отличающейся высокой плотностью отрицательного заряда.

Рис. 13. Варианты четырёхэлектронных оболочек
Атомы углерода с трубчатыми четырёхэлектронными оболочками должны легко димеризоваться. А димеры – полимеризоваться, образуя при линейной полимеризации карбин, при двухмерной – графен, а при объёмной – фуллерен, нанотрубки и их многочисленные производные.

Рис. 14. Варианты полимерных оболочек углерода

Рис. 15. Двухслойный вариант 10-электронной оболочки
Для объяснения строения внутренних 10-электронных оболочек данный вариант вполне подходит, но элементы с внешней оболочкой такого типа должны быть если не летучими, то хотя бы легкоплавкими. А это явно не соответствует свойствам ковких и пластичных металлов - никеля и палладия. Им больше подходит полимерная оболочка, мономеры которой могут получаться трансформацией торцевых крестовых электронов в соединительные электронные кольца.

Рис. 16. Внешние 10-электронные оболочки никеля/палладия
Вероятно, компактные крестовые электроны внешних оболочек перестраиваются в менее компактные кольцевые из-за взаимного отталкивания составляющих их отрицательно заряженных звеньев. Во внутренних оболочках такое отталкивание может компенсироваться притяжением атомного ядра.

Рис. 17. Модели электронных оболочек железа и его углеродных соединений
За платиной в таблице Менделеева следует золото, полимерная оболочка которого может отличаться от платиновой присутствием одного внутреннего крестового электрона.

Рис. 18. Электронная оболочка золота
Уникальные свойства следующей за золотом ртути могут быть обусловлены соотношением размеров её внешнего двухэлектронного пояса и внутренней 4-электронной сферы, которая выступает по бокам и препятствует характерной для металлов полимеризации внешних электронных оболочек.
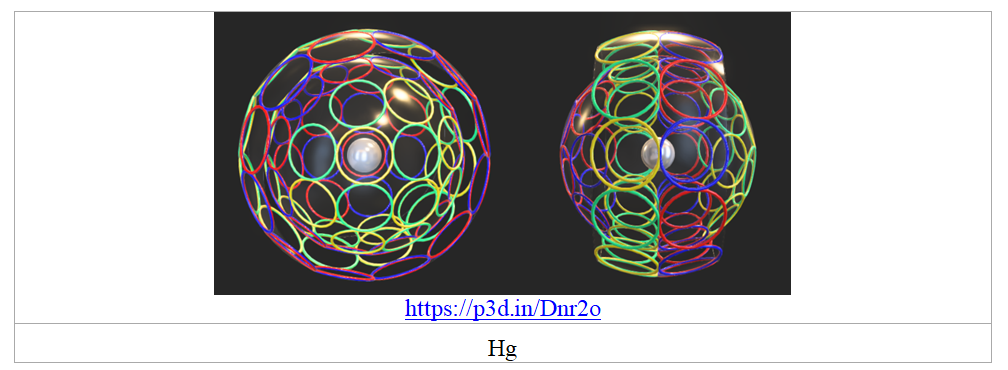
Рис. 19. Модель электронной оболочки ртути
Если оболочки атомов действительно состоят из 12-звенных электронов (что очень похоже на правду), то построить подобные модели можно и для всех молекул. Но для таких построений лучше использовать не трудоёмкое 3D-моделирование, а специально разработанные программы. Ещё лучше – компьютерные игры, позволяющие легко и просто собирать виртуальные электронные оболочки атомов и молекул любой сложности из готовых элементов, которых может быть совсем не много. Например, для моделирования структуры алмаза достаточно электронов всего одного типа.

Рис. 20. Моделирование электронной структуры алмазного кристалла
Ещё я ничего (вообще ничего!) не понимаю в UE5, Unity3D, Godot Engine и прочих платформах и программах для геймдева. Поэтому буду признателен за любые идеи, предложения и соображения по их использованию для молекулярного макетирования.
Металлическая связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
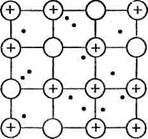
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
Любой гидроксид содержит гидроксидные группы – OH.
а. Радиус атомов уменьшается;
б. Заряд ядра увеличивается;
в. Электроотрицательность увеличивается;
г. Число электронов на внешнем слое увеличивается;
д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть. Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи. Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова. В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается. Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
2. Альдегиды
Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Металлические и неметаллические свойства простых веществ

У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
| Номер периода | Символ элемента | Заряд ядра атома | Число электронных слоев | Число электронов на внешнем слое | Валентность в высших оксидах |
|---|---|---|---|---|---|
| 1 | — | — | — | — | — |
| 2 | C | 6+ | 2 | 4 | IV |
| 3 | Si | 14+ | 3 | 4 | IV |
| 4 | Ge | 32+ | 4 | 4 | IV |
| 5 | Sn | 50+ | 5 | 4 | IV |
| 6 | Pb | 82+ | 6 | 4 | IV |
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным.
Читайте также:
