На внешнем электронном слое у атомов металлов
Обновлено: 27.04.2024
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
Количество электронов на внешнем уровне
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds
Все остальные элементы B-подгрупп, кроме палладия.
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
3s 2 3p 6 3d 5 4s 1
3s 2 3p 6 3d 6 4s 2
3s 2 3p 6 3d 5 4s 2
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s 2 3p 6 4s 2 3d 5 . s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns 2 (n-1) d 10
Решение задания:
Для начала разберемся со страшной формулой ns 2 (n-1) d 10 . Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s 2 (4-1)d 10 или 4s 2 3d 10 . Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d 10 4s 2 . Получившаяся формула приблизительна, вместо нее может быть 4d 10 5s 2 или 5d 10 6s 2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s 2 5p 3 , что соответствует структурно-электронной формуле:
Элемент имеет три неспаренных p-электрона.
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
Любой гидроксид содержит гидроксидные группы – OH.
а. Радиус атомов уменьшается;
б. Заряд ядра увеличивается;
в. Электроотрицательность увеличивается;
г. Число электронов на внешнем слое увеличивается;
д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть. Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи. Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова. В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается. Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
2. Альдегиды
Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Электронные оболочки атомов и молекул
Неверие в квантово-механические представления о строении электронных оболочек атомов и молекул принято считать ересью, не заслуживающей серьёзного внимания. Тем не менее, регулярно появляются еретики, пытающиеся при построении своих теорий обойтись без принципа неопределённости, орбиталей, волновых функций и прочих постулатов квантовой механики. В основе большинства таких теорий лежит представление о кольцевом (или тороидальном) строении электрона («магнетона»), предложенное ещё в 1915 году Альфредом Парсоном. У авторов более современной теории струн электроны считаются кольцевыми струнами, но Вселенной приписывается не менее десяти измерений, из которых только четыре доступны человеческому восприятию. К последователям А.Парсона с менее буйной фантазией относятся A.Канарёв, А.Кушелев, З.Огжевальский, S.Allen, D.Bergman, P.Ošmera, K.Snelson, P.Vesly и многие другие авторы и сторонники теорий кольцевого (тороидального, вихревого, фрактального и т.п.) электрона.
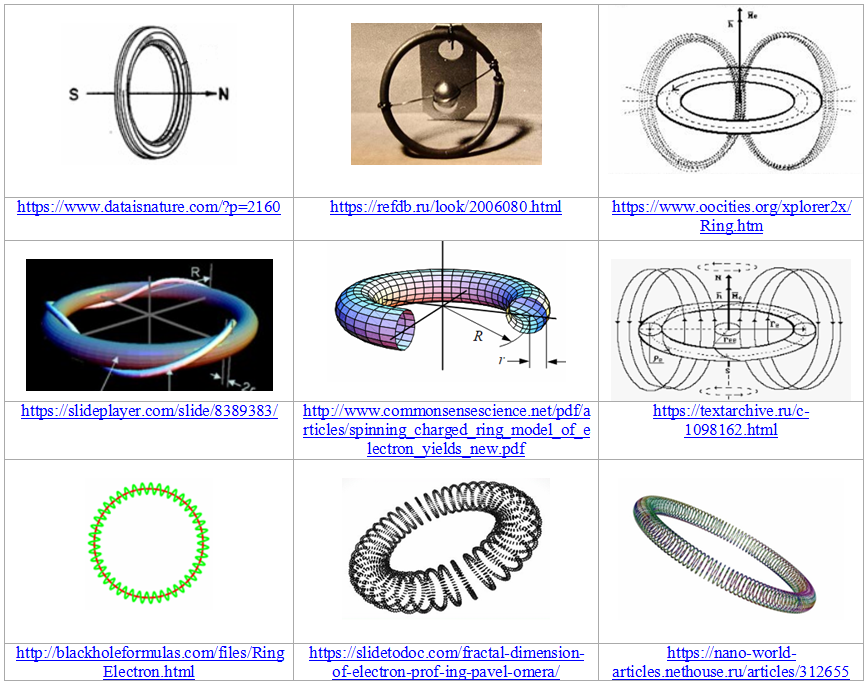
Рис. 1. Некоторые варианты кольцевых электронов
Один из возможных вариантов такой трансформации – дробление одного кольца, соответствующего верхнему (нулевому) энергетическому уровню электрона в атоме водорода, на пары мелких колечек. При этом количество таких пар (от 1 до 6) соответствует дискретным энергетическим состояниям электрона.
Такая схема формирования дискретных энергетических уровней электрона позволяет объяснить существование спектральных серий и линий излучения атомарного водорода.
Если электроны действительно являются не просто кольцевыми, а многокольцевыми, то этим определяется строение внешних электронных оболочек всех элементов таблицы Менделеева. И их электроны должны состоять из шести пар колец – как у атомарного водорода в невозбуждённом состоянии. Для подтверждения данной гипотезы необходимо построить модели различных оболочек из замкнутых 12-звенных электронов, и при помощи таких моделей попытаться объяснить физические и химические свойства соответствующих им атомов и молекул.
При построении моделей электронных оболочек элементов, относящихся к различным группам и периодам таблицы Менделеева, эту таблицу желательно иметь перед глазами. И ориентироваться не только на общее количество внешних электронов, но и на их чётность, а также на возможное влияние нижележащих оболочек на характер сборки внешних оболочек и, соответственно, на свойства атомов.
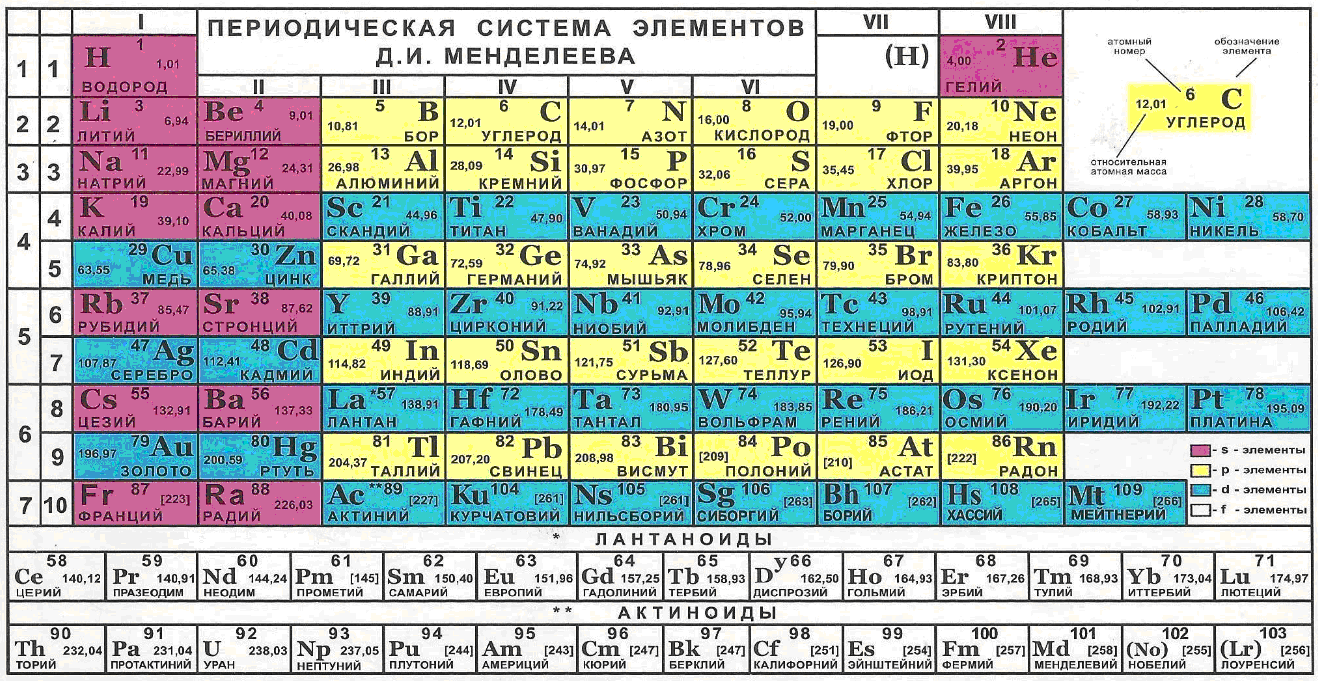
Рис. 4. Периодическая система химических элементов (таблица Менделеева)
Многокольцевые электроны могут иметь несколько вариантов укладки составляющих их звеньев, отличающихся количеством контактных точек и плотностью распределения заряда. Можно предположить, что наиболее стабильные оболочки атомов и молекул состоят из электронов с симметричным расположением составляющих их одинаковых звеньев (колечек).
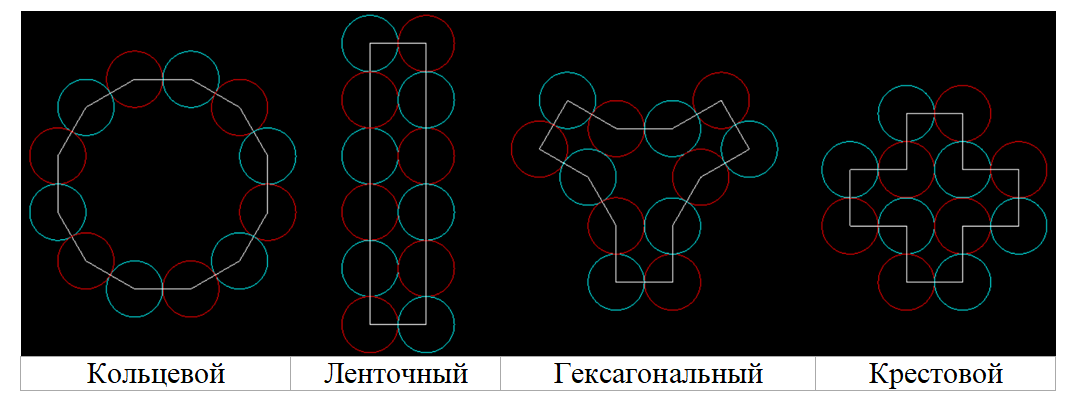
Рис. 5. Основные варианты симметричной укладки электронных звеньев
В трёхмерной модели атома водорода с электроном в основном (невозбуждённом) состоянии составляющие его звенья (с ленточной укладкой) могут располагаться на поверхности сферы с центральным атомным ядром (протоном). Такая электронная сфера обладает минимальным объёмом (и диаметром) и максимальным количеством точек соприкосновения звеньев с противоположной ориентацией магнитного поля.
Для двух электронов атома гелия возможны по крайней мере два варианта укладки составляющих их 24 (12х2) звеньев. Сферический может соответствовать гелию-I – химически инертному, с экстремально низкой температурой кипения (4,2°K). Трубчатый вариант должен легко полимеризоваться и подходит для гелия-II, образующегося при температуре
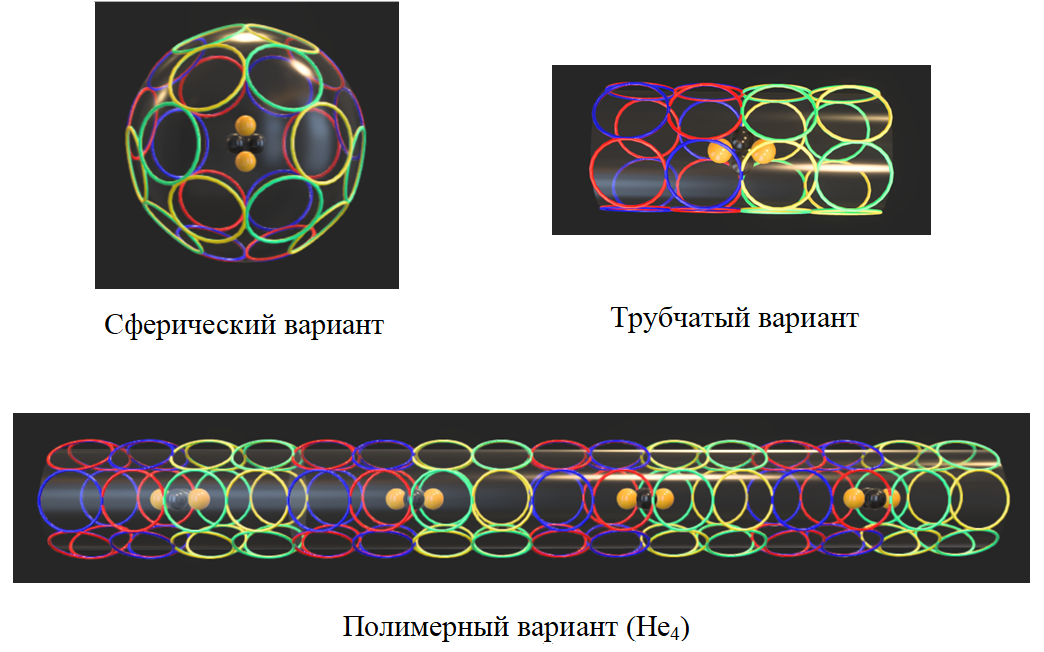
Рис. 7. Варианты построения двухэлектронных оболочек гелия
Немаловажным преимуществом двухслойной оболочки является простота построения её производных, у которых нехватка электронов во внешнем слое компенсируется атомами водорода – с протонами, расположенными в соединительных шестизвенных колодцах (венчиках) на максимальном удалении друг от друга. Для второго периода таблицы Менделеева такими производными являются метан (СН4), аммиак (NH3), вода (H2O) и фтороводород (HF). Причём в оболочке воды возможно не только угловое (мета-), но и прямое (пара-) расположение протонов.
Для атомов щелочных металлов (Li, Na, K, Rb, Cs, Fr) можно предложить несколько вариантов моделей их электронных оболочек, но для компенсации магнитных полей электронов они должны быть димерными, причём склонными к полимеризации. Димерная природа щелочных металлов редко упоминается в учебниках, но хорошо известна специалистам.
Полимеризацией двухэлектронной оболочки может объясняться и прочность металлического бериллия. А полимеризация трёхэлектронных оболочек способна определять сверхпрочность конструкционных волокон бора, получаемых его осаждением на тонкую нить или проволоку.

Рис. 11. Модели мономерных и полимерных электронных оболочек бериллия и бора
Полимерные трёхэлектронные оболочки трубчатого типа подходят также для металлов третьей группы, легкоплавкость которых (галлий - 29,76°C, индий - 156,6°C, таллий - 304°C) может объясняться лёгкостью перестроения полимерной формы в сферическую.

Рис. 12. Модель сферической трёхэлектронной оболочки
Неуравновешенность магнитных полей у таких трёхэлектронных сфер (нечётность количества их электронов) может определять и нелетучесть, и сравнительно высокие температуры кипения расплавов этих металлов (Ga – 2477°C; In – 2072°C; Tl - 1746°C).
Внешняя оболочка атома углерода содержит 4 электрона, из которых при соединении двух кольцевых и двух крестовых электронов можно построить очень компактную сферу. Но обладающие такой сферической оболочкой элементы должны быть если не газообразными, то хотя бы легкоплавкими, что для углерода явно не характерно. Его свойства проще объяснить формированием трубчатой оболочки из четырёх кольцевых электронов, которое может быть обусловлено нестабильностью крестовой структуры электрона, отличающейся высокой плотностью отрицательного заряда.

Рис. 13. Варианты четырёхэлектронных оболочек
Атомы углерода с трубчатыми четырёхэлектронными оболочками должны легко димеризоваться. А димеры – полимеризоваться, образуя при линейной полимеризации карбин, при двухмерной – графен, а при объёмной – фуллерен, нанотрубки и их многочисленные производные.

Рис. 14. Варианты полимерных оболочек углерода

Рис. 15. Двухслойный вариант 10-электронной оболочки
Для объяснения строения внутренних 10-электронных оболочек данный вариант вполне подходит, но элементы с внешней оболочкой такого типа должны быть если не летучими, то хотя бы легкоплавкими. А это явно не соответствует свойствам ковких и пластичных металлов - никеля и палладия. Им больше подходит полимерная оболочка, мономеры которой могут получаться трансформацией торцевых крестовых электронов в соединительные электронные кольца.

Рис. 16. Внешние 10-электронные оболочки никеля/палладия
Вероятно, компактные крестовые электроны внешних оболочек перестраиваются в менее компактные кольцевые из-за взаимного отталкивания составляющих их отрицательно заряженных звеньев. Во внутренних оболочках такое отталкивание может компенсироваться притяжением атомного ядра.

Рис. 17. Модели электронных оболочек железа и его углеродных соединений
За платиной в таблице Менделеева следует золото, полимерная оболочка которого может отличаться от платиновой присутствием одного внутреннего крестового электрона.

Рис. 18. Электронная оболочка золота
Уникальные свойства следующей за золотом ртути могут быть обусловлены соотношением размеров её внешнего двухэлектронного пояса и внутренней 4-электронной сферы, которая выступает по бокам и препятствует характерной для металлов полимеризации внешних электронных оболочек.
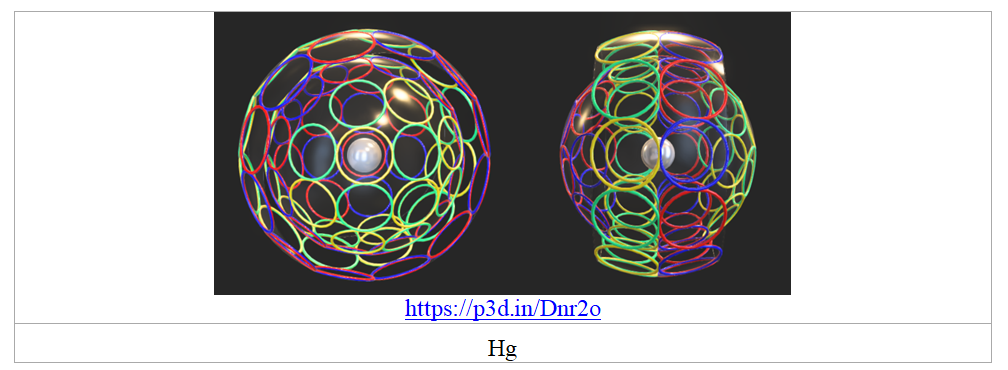
Рис. 19. Модель электронной оболочки ртути
Если оболочки атомов действительно состоят из 12-звенных электронов (что очень похоже на правду), то построить подобные модели можно и для всех молекул. Но для таких построений лучше использовать не трудоёмкое 3D-моделирование, а специально разработанные программы. Ещё лучше – компьютерные игры, позволяющие легко и просто собирать виртуальные электронные оболочки атомов и молекул любой сложности из готовых элементов, которых может быть совсем не много. Например, для моделирования структуры алмаза достаточно электронов всего одного типа.

Рис. 20. Моделирование электронной структуры алмазного кристалла
Ещё я ничего (вообще ничего!) не понимаю в UE5, Unity3D, Godot Engine и прочих платформах и программах для геймдева. Поэтому буду признателен за любые идеи, предложения и соображения по их использованию для молекулярного макетирования.
Вопрос по химии (8 класс)
Металлические и неметаллические свойства элементов. Что за свойства? Как сравнить у какого атома больше проявлены металлические свойства (или неметаллические. ) Задание : расставить элементы в порядке возрастания неметаллических свойств: S,O.Se.
Расставить в порядке возрастания металлических свойств: Si,Na,Al .Сделайте пожалуйста эти задания и обясните, почему именно так. Очень нужна помощь, так как завтра контрольная.
У атомов металлов малых периодов (1-3) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе 4. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца) .
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным.
Металлические и неметаллические свойства простых веществ

У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
| Номер периода | Символ элемента | Заряд ядра атома | Число электронных слоев | Число электронов на внешнем слое | Валентность в высших оксидах |
|---|---|---|---|---|---|
| 1 | — | — | — | — | — |
| 2 | C | 6+ | 2 | 4 | IV |
| 3 | Si | 14+ | 3 | 4 | IV |
| 4 | Ge | 32+ | 4 | 4 | IV |
| 5 | Sn | 50+ | 5 | 4 | IV |
| 6 | Pb | 82+ | 6 | 4 | IV |
Читайте также:
